神经节苷脂对脑瘫大鼠大脑皮质区Nestin、NGF表达的影响
金 玲,何小进,尹玲桃,江兴林*
(湖南怀化医学高等专科学校诊断教研室,湖南 怀化 418000)
神经节苷脂对脑瘫大鼠大脑皮质区Nestin、NGF表达的影响
金 玲,何小进,尹玲桃,江兴林*
(湖南怀化医学高等专科学校诊断教研室,湖南 怀化 418000)
目的观察神经节苷脂(GM1)对脑瘫大鼠大脑皮质区神经巢蛋白(Nestin)、神经生长因子(NGF)表达的影响,探讨GM1促进脑瘫神经修复的可能机制。方法选择出生10周雄性SD大鼠200只,随机分为3组:假手术组60只,脑瘫模型140只,再分为模型组70只,腹腔注射生理盐水;GM1组70只,腹腔注射GM1。分别在术后0~24 h的7个时间点利用酶联免疫法检测大鼠大脑皮质区Nestin、NGF表达情况,并在实验前和后1~4 d观察大鼠的体质量变化情况。 结果 (1)大鼠大脑皮质区 Nestin表达 GM1组 0~24 h、模型组 0~12 h明显高于假手术组(P<0.01);GM1组 16~24 h明显高于模型组 (P<0.01)。(2)GM1组大鼠大脑皮质区NGF表达0~24 h明显高于模型组 (P<0.05)和假手术组 (P<0.01)。模型组 NGF 表达仅 0、4、8 h 高于假手术组(P<0.05)。(3)GM1组术后第 1、2 天体质量缓慢增加,至第 3、4 天明显高于模型组(P<0.05),接近假手术组(P>0.05),模型组体质量增加不明显。结论预防性使用GM1是通过增强大脑皮质的Nestin和NGF表达并延长表达时间来发挥其对实验性脑瘫大鼠的神经保护作用。
脑性瘫痪;神经节苷脂;神经巢蛋白;神经生长因子;大鼠
脑性瘫痪简称脑瘫,是一种中枢神经系统损伤引起的非进行性功能障碍[1]。随着新生儿医学的进步,新生儿死亡率逐年下降,但脑瘫的发病率反而有升高趋势,世界范围内大约有1 500万脑瘫患儿,我国发病率为1.8‰~4‰[2]。脑瘫的治疗至今仍为世界性医学难题,是神经科学领域的研究热点之一。虽然现代医学对脑瘫的病因学、病理研究取得了一定进展,但治疗上并无大的突破,故寻求新的治疗脑瘫思路、方法、药物以提高脑瘫患儿的生存质量并减少由此致儿童残疾是医学界努力的目标。为了解决这一临床上的难题,不少科研工作者把目光投到脑损伤修复机制的研究上。本实验观察神经节苷脂(GM1)对脑瘫大鼠大脑皮质区神经细胞神经巢蛋白(Nestin)、神经生长因子(Nerve growth factor,NGF)表达的影响,初步探讨药物干预对脑损伤大鼠受损神经功能修复的可能机制,为临床应用药物治疗脑瘫提供实验依据。现将方法和结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 选取出生10周并经适应性喂养3 d至体质量在200~250 g的健康雄性SD大鼠200只(来源于湖南斯莱克景达实验动物有限公司,许可证书号:SCXK(湘)2011-0003)。适应性喂养采用的饲料及屏蔽环境实验设施由中南大学实验动物中心(SPF级)提供,在光/暗周期为12 h/12 h(光照时间7:00-9:00)的条件下饲养于笼中,自由获得饲料和饮水。
1.1.2 药物 GM1,商品名“申捷”,北京四环制药有限公司生产,药品批准文号:H20083224,生产批号:4010531,注射剂,2 mg/mL。
1.1.3 主要仪器和试剂 采用芬兰352型352017148酶标分析仪,芬兰AC8型洗板机;NGF酶联免疫分析试剂盒、Nestin酶联免疫分析试剂盒,均购自北京永辉生物科技有限公司。
1.2 方法
1.2.1 造模与分组 造模方法按楚胜华等[3]运用特制的造模打击装置,以自由落体撞击建立动物脑瘫模型。将200只大鼠随机分为假手术组60只,GM1组和模型组各70只。大鼠造模前禁食8 h,实验时将大鼠俯卧位固定于脑立体定向仪上,消毒头部皮肤,按以10%水合氯醛按0.35 g/kg进行腹腔内注射麻醉,正中切开头皮后剥离骨膜,充分暴露右顶骨,用牙科钻在冠状缝后1.5 mm、中线旁2.5 mm处钻一直径5 mm的骨窗,并保持硬膜完整。假手术组:不施加砝码撞击即封闭头皮,未致脑瘫;模型组和GM1组:用20 g砝码于30 cm高处坠落,撞击撞杆从而撞击硬膜,致右顶叶中度脑挫裂伤,最后封闭头皮。术后苏醒带回到原饲养处喂养,并按楚胜华的旷野试验等[3]行为学测评标准确定脑瘫模型的建立。成功后才用于实验,实验完成后剩余大鼠一律处死。
1.2.2 给药方法 假手术组、模型组均按20 mL/(kg·d) 腹腔注射生理盐水;GM1组给予浓度为2 mg/mL 的 GM1注射液按 20 mL/(kg·d)腹腔注射,以上各组每天1次,术前连续注射3 d。
1.2.3 标本采集 造模后在 0、2、4、8、12、16、24 h时间点,分别在各组中提取6只大鼠,以颈动脉取血后处死大鼠,剪断头颅,沿正中线切开头皮,剥开颅骨,暴露完整的大脑组织,撕开硬脑膜后,用弯镊取出大脑最外层顶叶皮质放入标记好的冰冻管,置-80℃冰箱保存。所有的标本处理好后,分别称取各份标本2 g,加入pH 7.4的磷酸盐缓冲液(PBS)2 mL中,将标本充分研成匀浆,2 000 r/min离心20 min,收集上清液,分装后冷冻待用。
1.3 检测指标
1.3.1 Nestin、NGF的检测 采用芬兰352型酶标分析仪、芬兰AC8型洗板机,按NGF酶联免疫和Nestin酶联免疫分析试剂盒操作使用说明,进行两个指标的检测。即通过包被、加样、加酶标抗体、加底物液显色、终止反应,在酶标仪上于450 nm波长处,以空白管调零测定吸光度值。
1.3.2 体质量测定 3组大鼠分别于手术前、术后第1~4天,各随机取10只,采用动物电子天平测定体质量。
1.4 统计学分析
2 结果
2.1 各组大鼠术后不同时间点大脑皮质区Nestin含量的比较
GM1组0~24 h和模型组 0~12 h大鼠大脑皮质区Nestin含量明显高于假手术组,差异有统计学意义(P<0.01)。GM1组大鼠大脑皮质区的 Nestin 0~12 h含量与模型组比较无显著差异 (P>0.05),16~24 h明显高于模型组,差异有显著统计学意义(P<0.01)。结果见表1。
2.2 各组大鼠不同时间点大脑皮质区NGF含量的比较
GM1组大鼠大脑皮质区NGF含量0~24 h均明显高于模型组(P<0.05)和假手术组(P<0.01);模型组大鼠大脑皮质区NGF含量仅0、4、8 h高于假手术组(P<0.05)。 结果见表 2。
2.3 各组大鼠不同时间点体质量变化的比较
3组大鼠各随机取10只,分别于手术前、术后第1天至第4天5个时间点测量体质量。术前3组大鼠平均体质量无显著性差异(P>0.05);术后假手术组体质量逐天增加,至第3、4天明显高于模型组(P<0.05);GM1组第 1、2 天体质量缓慢增加, 至第3、4天明显高于模型组(P<0.05),接近假手术组。结果见表3。
3 讨论
GM1是一种促进中枢神经系统损伤后修复的药物,是重要的内源性神经营养因子前体增强剂,可以增强神经营养因子活性,具有促进神经生长、恢复神经功能等作用[4]。Nestin是中枢神经系统一种独特的中间丝蛋白[5],出生后表达很快降低并消失,仅在少数保持神经发生功能的部位有表达。Nestin是反映中枢神经系统损伤最早、快速应答的敏感标志物之一[6-7],如缺血性脑损伤早期Nestin即可在损伤最严重的区域表达最明显,并且可诱导中枢神经系统细胞的原位增殖和神经细胞的再生[8]。NGF也是神经营养因子之一,是神经系统中最重要的生物活性物质之一,NGF具有神经元营养和促突起生长双重生物学功能,对神经元的损伤修复和功能恢复有重要的调控作用[9]。
表1 各组大鼠术后不同时间点大脑皮质区Nestin含量的比较 (±s,ng/L)

表1 各组大鼠术后不同时间点大脑皮质区Nestin含量的比较 (±s,ng/L)
注:与假手术组比较 *P<0.05,**P<0.01;与模型组比较△△P<0.01。下表同。
组 别假手术组模型组GM1组n 6 6 6 0 h 100.1±2.7 143.3±3.3**142.4±2.6**2 h 109.0±2.6 135.4±4.4**142.3±1.2**4 h 107.5±1.2 130.9±2.6**142.1±3.0**8 h 108.1±7.1 144.6±5.0**141.5±4.6**12 h 115.1±3.2 144.6±2.1**139.4±2.8**16 h 117.8±1.1 114.9±9.9 136.7±2.2**△△24 h 116.6±2.0 115.8±7.3 137.8±4.9**△△
表2 各组大鼠术后不同时间点大脑皮质区NGF含量的比较 (±s,ng/L)

表2 各组大鼠术后不同时间点大脑皮质区NGF含量的比较 (±s,ng/L)
组 别假手术组模型组GM1组n 6 6 6 0 h 188.7±33.7 229.6±27.3*401.1±24.3**△△2 h 201.2±50.3 208.4±6.8 362.2±36.2**△△4 h 193.9±44.6 264.9±43.2*327.7±47.0**△△8 h 209.4±18.6 249.1±27.6*292.2±57.9**△△12 h 219.2±25.7 193.7±31.2 287.5±35.1**△△16 h 205.6±8.6 198.4±9.1 295.2±18.1**△△24 h 218.5±55.2 218.5±25.3 294.3±4.5**△△
表3 各组大鼠术前及术后4 d内平均体质量变化比较 (±s,g)
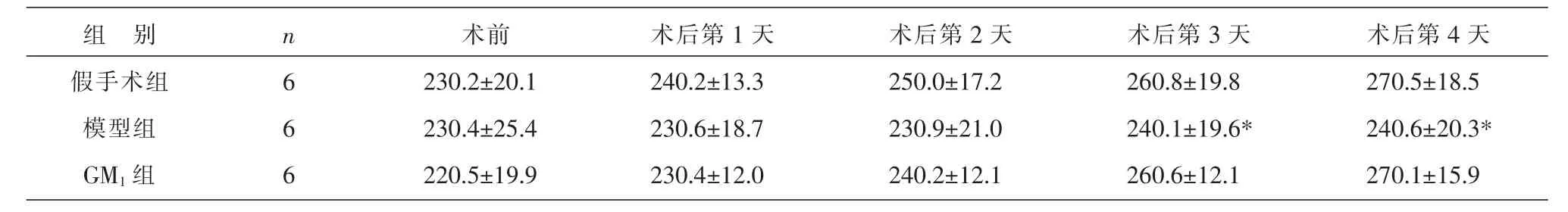
表3 各组大鼠术前及术后4 d内平均体质量变化比较 (±s,g)
注:与假手术组和GM1组同时间点比较*P<0.05。
组 别假手术组模型组GM1组n 6 6 6术前230.2±20.1 230.4±25.4 220.5±19.9术后第1天240.2±13.3 230.6±18.7 230.4±12.0术后第2天250.0±17.2 230.9±21.0 240.2±12.1术后第3天260.8±19.8 240.1±19.6*260.6±12.1术后第4天270.5±18.5 240.6±20.3*270.1±15.9
在设计本实验时,我们增加了0 h这个时间点,假手术组是于大鼠封闭头皮苏醒后立即测定为0 h;GM1组与模型组是于大鼠封闭头皮苏醒后确定脑瘫模型建立,再立即进行测定为0 h。其目的是观察动物手术或脑瘫模型建立后是否快速出现Nestin、NGF的应激性表达增加。实验结果证明确实如此。脑瘫大鼠(包括GM1组和模型组)大脑皮质Nestin、NGF表达0 h即显著高于假手术组。0 h以后,GM1组Nestin、NGF表达明显高于模型组,这证明了GM1的保护作用。GM1组大鼠大脑皮质区Nestin表达0~24 h高于假手术组,16~24 h高于模型组;NGF表达0~24 h高于假手术组和模型组。实验中GM1组大鼠体质量增长明显高于模型组。这提示大鼠造模前保护性用药GM1可降低脑损伤的程度,增加神经营养因子Nestin、NGF的表达,这与诸葛小寅等[10]的研究结果基本一致。由此看来,预防性使用药物GM1可以显著提高实验性脑瘫大鼠大脑皮质Nestin、NGF的表达和延长表达时间,这可能是GM1降低了脑瘫损伤,起到保护作用的主要原因。
实验观察术后4 d内实验动物的体质量变化情况。GM1组脑瘫模型动物术后第1、2天体质量缓慢增长,至术后第3、4天平均体质量增长明显高于模型组,接近假手术组。模型组脑瘫模型动物体质量增长不明显,术后第3、4天平均体质量明显低于GM1组和假手术组。这说明假手术组动物手术麻醉后虽打开颅骨,大脑本身却未受损伤,动物醒后无脑瘫,对平时的饮食影响不大,体质量每天有所增加。GM1组因为预防性的使用了GM1,脑瘫模型动物的受损程度得到保护,进食影响较少。模型组脑瘫后进食受阻,每天体质量增加不明显,且因体质衰弱,死亡较多,这与郑修元等[8]的研究相似,本实验中各组死亡率比较已有论文发表[11]。由此推测,GM1对实验性脑瘫大鼠可能起到了保护作用。
[1]付 强,祁岩超,唐纯志,等.针刺和神经干细胞联合治疗脑瘫幼鼠的效果评价[J].湖南中医药大学学报,2011,31(6):51-53.
[2]赵彩娇,卢海泉,金瑞勤,等.针刺治疗小儿脑瘫常用穴规律探析[J].湖北中医杂志,2014,36(3):56-59.
[3]楚胜华,陈二涛,冯东福,等.脑外伤后抑郁状态模型的建立及效果评价[J].中华急诊医学杂志,2012,21(7):718-724.
[4]费立博,狄佳,聂时南,等.神经生长因子联合神经节苷脂干预弥漫性轴索损伤患者的临床观察 [J].中国急救医学,2014,34(2):155-158.
[5]吴洪阳,王 华,吴绪平,等.头穴透刺对急性脑缺血大鼠海马齿状回 nestin 影响的研究[J].中国康复,2013,28(2):87-89.
[6]Park D,Xiang AP,Mao FF,et a1.Nestin is required for the proper selfrenewal of neural stem cells[J].Stem Cells,2010(28):2 162-2 171.
[7]Suzuki S,Namiki J,Shibata S,et a1.The neural stem/progenitor cellmarkernestin isexpressed in proliferative endothelial cells,but not in mature vasculature[J].J Histochem Cytochem,2010(58):721-730.
[8]郑修元,李胜活,燕铁斌,等.功能性电刺激对急性脑梗死大鼠神经功能及梗死侧皮质巢蛋白表达的影响[J].中华物理医学与康复杂志,2011,33(5):325-328.
[9]朱 尧,汪青松,黄海丽,等.脐带血间充质干细胞改善兔脑梗死神经生长因子和神经元凋亡的研究 [J].中华老年心脑血管病杂志,2013,15(12):1 316-1 320.
[10]诸葛小寅,曹云涛.去铁胺对新生鼠缺氧缺血性脑损伤海马DG区BrdU和nestin表达的影响 [J].临床儿科杂志,2012,7(30):661-665.
[11]金 玲,黄民江,李洪亮,等.神经节苷脂对实验性颅脑外伤大鼠的保护作用及机制[J].中国康复医学杂志,2013,12(28):1 142-1 145.
(本文编辑 徐爱良)
Sdudy Ganglioside on Expression of Nestin and NGF in Cerebral Palsy Cerebral Cortex
JIN Ling,HE Xiaojin,YIN Lingtao,JIANG Xinglin*
(Department of Diagnosis,Huaihua Medical College,Huaihua,Hunan 418000,China)
ObjectiveTo observe the ganglion monoglyceride(GM1)body weight of rats in cerebral palsy and brain cortex Nestin(Nestin),nerve growth factor(NGF)expression,and to explore GM1may promote nerve repair mechanisms of cerebral palsy.Methods10 weeks birth of 200 male SD ratswere randomly divided into three groups:sham group 60-no cerebral palsy,cerebral palsy model 140,divided into model group 70,intraperitoneal injection of saline,the GM1group 70,intraperitoneal injection GM1.Nestin and NGF expressions of cerebral cortex Nestin in rats were detected by immunohistochemistry at 7 time points of the postoperative 0~24 h periods.The total weight of experimental animals was observed during preoperative and postoperative 1~4 days.Results① The GM1group 0~24 h,the model group 0~12 h Nestin expression in ratcerebralcortex wassignificantly higherthan the sham group(P<0.01);GM1group 16~24h Nestin expression in rat cerebral cortex was significantly higher than the model group(P<0.01). ② The GM1group 0~24 h NGF expression in rat cerebral cortex was significantly higher than the model group(P<0.05)and the sham group(P<0.01).Model rat cerebral cortex expression of NGF only at 0,4,8 h higher than the sham group(P<0.05).③GM1group after the first 2 days of weight increased slowly,while the weight after 3 or 4 days was significantly higher(P<0.05),close to the sham group(P>0.05).Model group,the weight was not significant.ConclusionGM1was used preventability and its neuroprotective effects on experimental rat cerebral cortex of the brain were improved by enhancing Nestin and NGF expression.
cerebral palsy;GM1;Nestin;NGF;Rat
R651.1,R969
A
10.3969/j.issn.1674-070X.2014.08.004.013.04
2014-03-03
湖南省科技厅科技计划项目(2009FJ3200);湖南省中医药管理局科研计划项目(2012124)。
金 玲,女,硕士,副教授,主要从事心脑血管系统疾病的防治和研究工作。
* 江兴林,男,教授,E-mail:jxlin6@163.com。
·中药分析与制剂·

