2-氨基 -4,5,6,7-四氢苯并[b]噻吩 -3-羧酸乙酯缩水杨醛Schiff碱的合成
杨 平,宋新建
(湖北民族学院化学与环境工程学院,湖北恩施445000)
2-氨基噻吩衍生物是一类重要的有机中间体,在农药、医药和染料等化合物的合成中具有广泛的应用.噻吩及其稠杂环化合物因具有抗氧化[1]、抗肿瘤[2-4]等多种药物活性而备受关注.含有C=N双键的Schiff碱具有优良的生物活性、配位性能和光电性能,广泛应用于药物[5-6]、催化[7]、化学分析[8]、电化学[9]以及功能材料[10-12]等诸多领域.同时考虑到化合物分子中引入酯基可以有效调节脂水分配系数,增加化合物的脂溶性,有利于透过细胞膜而促进机体吸收,从而可能改善化合物的生物活性.有关噻吩类化合物的合成及生物活性已有大量文献报道,但含酯基及噻吩杂环的Schiff碱尚未见报道.本文先通过环己酮、氰基乙酸乙酯与单质硫在碱催化条件下发生Gewald反应生成2-氨基-4,5,6,7-四氢苯并[b]噻吩-3-羧酸乙酯,再与水杨醛反应简便地合成出相应的Schiff碱产物,其结构经IR、1H NMR、MS和元素分析方法予以确认,合成路线如图1所示.
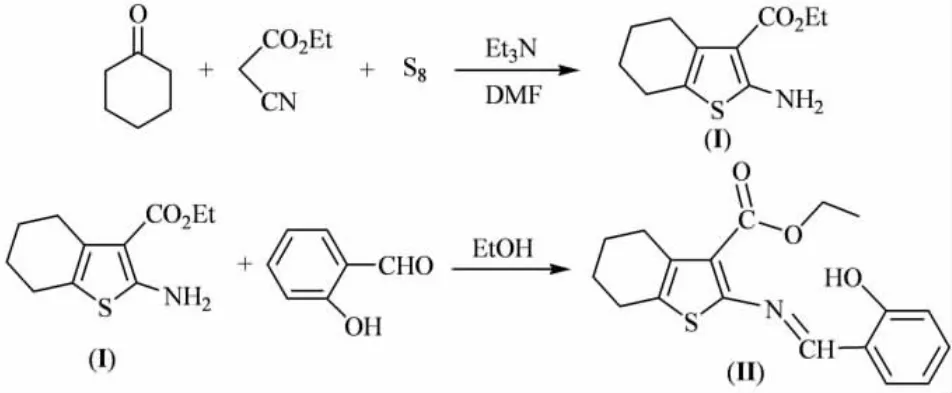
图1 目标化合物(II)的合成路线Fig.1 The synthetic procedure of the title compound II
1 实验部分
1.1 主要仪器和试剂
Varian Unity Inova-600型超导核磁共振仪(TMS为内标,DMSO-d6为溶剂);NEXUS 470型傅立叶红外光谱仪(KBr压片);Agilent 5975 inert质谱仪(EI离子源);Vario EL III CHNSO型元素分析仪;X4型显微熔点测定仪(温度未经校正).所用药品均为分析纯或化学纯试剂.
1.2 2-氨基 -4,5,6,7-四氢苯并[b]噻吩 -3-羧酸乙酯(I)的合成
在圆底烧瓶中加入4.90 g(0.05 mol)环己酮、5.66 g(0.05 mol)氰基乙酸乙酯、1.92 g(0.06 mol)升华硫和10 mL无水DMF,冰浴下边搅拌边缓慢滴加3.5 mL三乙胺(约15 min加完),再常温搅拌反应4 h,然后将反应液倒入15 mL冷水中,有大量固体析出,过滤,水洗,粗产品再用80%乙醇重结晶,得浅黄色粉末状固体(I),产率87%,熔点:116℃(文献[13]值115℃).
1.3 2-氨基-4,5,6,7-四氢苯并[b]噻吩-3-羧酸乙酯缩水杨醛Schiff碱(II)的合成
向圆底烧瓶中加入0.45 g(2 mmol)2-氨基-4,5,6,7-四氢苯并[b]噻吩-3-羧酸乙酯(I)、水杨醛0.24 g(2 mmol)和5 mL无水乙醇,50℃下搅拌反应6 h.反应结束后减压蒸去部分溶剂,冷却过滤得粗产品,用无水乙醇重结晶得黄色晶体(II),产率76%,熔点:132~133℃.1H NMR(600 MHz,DMSO-d6)δ:1.29(3H,t,J=7.2 Hz,COOCH2CH3),1.73(4H,dd,J=4.8 和4.4 Hz,5-位和6-位 CH2),2.67(2H,s,4-位 CH2),2.70(2H,s,7-位 CH2),4.27(2H,q,J=7.2 Hz,COOCH2CH3),6.93 ~7.65(4H,m,A-rH),8.75(1H,s,CH=N),12.56(1H,s,OH).IR(KBr)(v/cm-1):3435(O-H),1697(C=O),1601(C=N),1216,1137(C-O-C)cm-1;EI-MS m/z(%):329.4(74.6,M+),150(100);元素分析,C18H19NO3S,实验值(计算值,%):C 65.49(65.63),H 5.98(5.81),N 4.06(4.25).
2 结果与讨论
2.1 合成方法
2-氨基噻吩衍生物通常是通过Gewald反应合成,最常见的是三组分Gewald反应[14-17],即:含α-氢的醛或酮、活泼的氰基化合物(如氰基乙酸乙酯、氰基乙酰胺或α-氰基酮类化合物等)与单质硫在碱(如吗啡啉、哌啶、二乙胺或三乙胺等)作催化剂,于室温条件下发生反应,生成2-氨基噻吩衍生物.本文以环己酮、氰基乙酸乙酯与单质硫为原料在三乙胺催化条件下制备出2-氨基-4,5,6,7-四氢苯并[b]噻吩-3-羧酸乙酯(I).
与文献[18]方法相比,反应时间更短,产率更高,而且反应条件温和,分离纯化操作简单.中间体(I)再与水杨醛发生脱水缩合反应制得目标化合物(II),该反应在无水乙醇溶剂中进行,反应温度太低则反应速度慢甚至不反应,反应温度过高则生成的产物不稳定易分解,因此反应温度选择在50℃左右为宜.
2.2 结构表征
IR谱(见图2)中,在3435 cm-1附近出现酚O─H键的伸缩振动吸收谱带;酯羰基的吸收峰在1697 cm-1处呈强尖峰,较正常的羰基吸收峰波数(~1735 cm-1)有所降低,这是由于π-π共轭效应的存在致使C=O双键的极性减小,使得其伸缩振动频率降低,而在1216和1137 cm-1处分别出现酯中C─O─C的反对称和对称伸缩振动强吸收峰;由于C=N双键与苯环及噻吩杂环发生共轭也使其吸收峰(1601 cm-1)向低频方向移动.
在1H NMR谱(见图3)中,环己烯基上4个亚甲基质子的化学位移在1.71~2.70之间;酯基中CH2的化学位移在4.27附近,且被裂分成四重峰,而CH3的化学位移在1.29处出现三重峰,二者相互偶合,符合n+1规律,其偶合常数为7.2 Hz;δ 8.75处的单峰归属于亚胺碳氢(—CH=N—);酚羟基质子的化学位移出现在12.56处,远较正常值高,这是由于与亚胺氮原子形成六元环的分子内氢键所致(如图4所示),从而表现出相当大的去屏蔽效应使得酚羟基质子的化学位移显著地移向低场.MS谱(见图5)中存在分子离子峰,也进一步印证了目标化合物的结构.
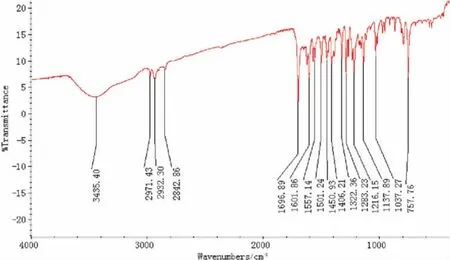
图2 化合物II的红外光谱图Fig.2 IR spectrum of compound II
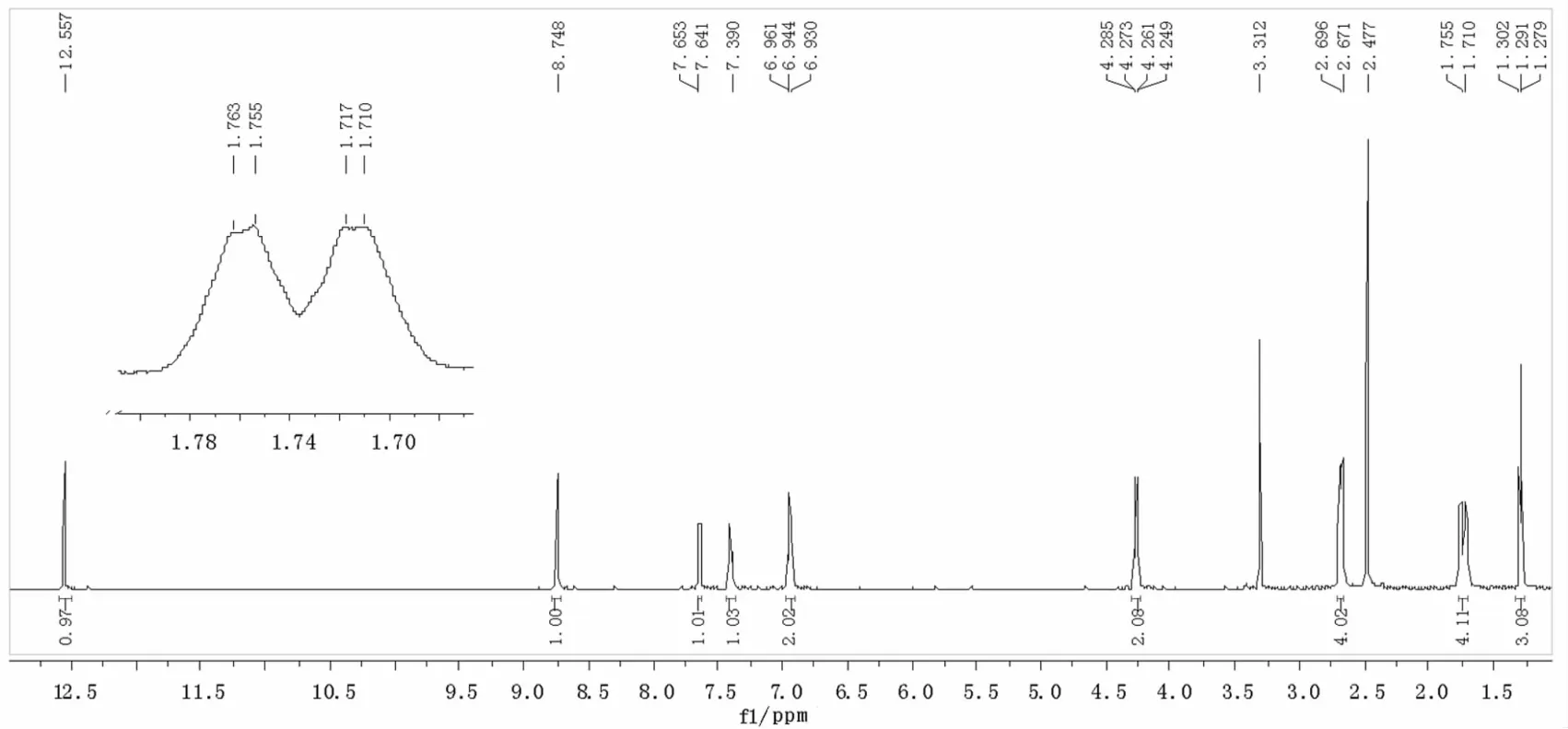
图3 化合物II的1H NMR谱图Fig.3 1H NMR spectrum of compound II
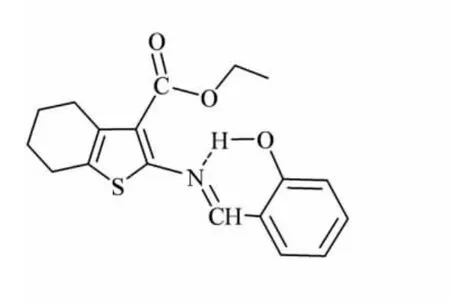
图4 化合物II的结构(虚线表示分子内氢键)Fig.4 Structure of compound II(intramolecular hydrogen bond is shown as dashed line)
图5 化合物Ⅱ的MS谱图Fig.5 MS spectrum of compoundⅡ
3 结论
本文以环己酮、氰基乙酸乙酯与单质硫为原料通过三组分Gewald反应采用“一锅”法简易合成出2-氨基-4,5,6,7-四氢苯并[b]噻吩-3-羧酸乙酯,再与水杨醛发生脱水缩合反应制得相应的Schiff碱.该合成方法具有反应条件温和、分离纯化简单、反应时间较短以及反应产率较高等优点.并对目标化合物的合成条件、波谱性质及结构特征进行了探讨.
[1] Kotaiah Y,Harikrishna N,Nagaraju K,et al.Synthesis and antioxidant activity of 1,3,4-oxadiazole tagged thieno[2,3-d]pyrimidine derivatives[J].Eur J Med Chem,2012,58:340-345.
[2] Romagnoli R,Baraldi P G,Carrion M D,et al.Synthesis and biological effects of novel 2-amino-3-(4-chlorobenzoyl)-4-substituted thiophenes as allosteric enhancers of the A1adenosine receptor[J].Eur J Med Chem,2013,67:409-427.
[3] Romagnoli R,Baraldi P G,Cruz-Lopez O,et al.Synthesis of novel antimitotic agents based on 2-amino-3-aroyl-5-(hetero)arylethynyl thiophene derivatives[J].Bioorg Med Chem Lett,2011,21(9):2746-2751.
[4] Romagnoli R,Baraldi P G,Cruz-Lopez O,et al.Concise synthesis and biological evaluation of 2-aroyl-5-aminobenzo[b]thiophene derivatives as a novel class of potent antimitotic agents[J].J Med Chem,2013,56(22):9296-9309.
[5] 叶红德,彭化南,郑大贵,等.含苯并噻唑环Schiff碱的合成及其抑菌活性[J].化学试剂,2013,35(10):947-950.
[6] 余英琳,廖向文,潘伟健,等.新型Schiff碱与DNA相互作用及其抗肿瘤活性研究[J].山西医科大学学报,2013,44(11):864-868.
[7] 靳文娟.希夫碱镍金属催化对L-丙交酯的开环聚合[J].精细化工,2013,30(9):1025-1030.
[8] 李亮,李浩克,颜朝国.单取代对叔丁基杯[6]芳烃Schiff碱的合成及对金属离子的识别性能[J].化学试剂,2013,35(10):883-886.
[9] 曹亚飞,李曦,董玉林,等.希夫碱铜配合物修饰电极对抗坏血酸的电催化性能研究[J].武汉理工大学学报,2013,35(5):45-49.
[10] 张复兴,王剑秋,邝代治,等.二苄基锡水杨醛缩邻氨基苯酚Schiff碱配合物的合成、结构及荧光性质研究[J].无机化学学报,2013,29(7):1442-1446.
[11] 冯舒航,丁国华,莫少慧,等.光致变色4-二乙胺基水杨醛缩对碘苯胺席夫碱的固相合成及其发光性能[J].功能材料,2013,44(23):3383-3387.
[12] 李光华,丁国华.一种新的有机光致变色及热致变色化合物间氨基苯甲酸缩3,5-二氯水杨醛希夫碱[J].发光材料,2011,32(11):1115-1119.
[13] Sridhar M,Rao R M,Baba N H K,et al.Microwave-accelerated Gewald reaction:Synthesis of 2-aminothiophenes[J].Tetrahedron Lett,2007,48(18):3171-3172.
[14] Gewald K,Schinke E,Böttcher H.Heterocyclen aus CH-aciden nitrilen,VIII:2-Amino-thiophene aus methylenaktiven nitrilen,carbonylverbindungen und schwefel[J].Chem Ber,1966,99:94-100.
[15] 张豹子,刘洋,王凌.Gewald反应及其在药物合成中的应用[J].中国抗生素杂志,2012,37(8):579-586.
[16] Wang T,Huang X G,Liu J,et al.An efficient one-pot synthesis of substituted 2-aminothiophenes via three-component Gewald reaction catalyzed by L-proline[J].Synlett,2010,9:1351-1354.
[17] Tayebee R,Javadi F,Argi G.Easy single-step preparation of ZnO nano-particles by sedimentation method and studying their catalytic performance in the synthesis of 2-aminothiophenes via Gewald reaction[J].J Mol Catal A-Chem,2013,368-369:16-23.
[18] Sopbue Fondjo E,Doepp D,Henkel G.Reactions of some anellated 2-aminothiophenes with electron poor acetylenes[J].Tetrahedron,2006,62(29):7121-7131.

