不同温度和N、Fe3+质量浓度对微拟球藻脂肪酸组成及SCD基因表达的影响*
黄一江,郑明刚,孙中涛,郑 立,王 玲,杨佰娟
(1.山东农业大学 生命科学学院,山东 泰安 271018;2.国家海洋局 第一海洋研究所,山东 青岛 266061;3.青岛大学 化学化工与环境学院,山东 青岛 266071)
不饱和脂肪酸(Unsaturated Fatty Acids,UFAs)广泛存在于动植物中,在一些藻类中的质量浓度尤其丰富[1]。有研究表明UFAs对治疗心血管疾病、癌症、风湿性关节炎等病症有着重要作用[2-5]。因此,人们越来越关注UFAs在制药和保健品中的应用。当前,许多重要的UFAs产自深海鱼油,而鱼类通过食用微藻来积累UFAs[6]。随着环境的污染,捕鱼业已经无法满足人们对UFAs日益增长的需求[7-8]。故研究海洋微藻中的UFAs,对缓解当前社会中UFAs的需求压力有着极其重要的意义。目前,微藻中不饱和脂肪酸的低提取量是限制其发展与应用的一大难题。因而,通过分子生物学手段来提高微藻中UFAs的质量浓度,为解决这一难题提供了新的思路。然而微藻中UFAs的合成受许多基因的调控,故研究这些基因的表达与UFAs合成的关系成为目前首要任务。
硬脂酰辅酶A去饱和酶(stearoyl-coenzyme A desaturase,SCD)在催化饱和脂肪酸形成不饱和脂肪酸的途径中起着重要的作用。它是催化饱和脂肪酸第9位碳链形成n-9系不饱和脂肪酸的关键酶,其催化底物主要以棕榈酸(C16∶0)和硬脂酸(C18∶0)为主[9]。该基因的表达与不饱和脂肪酸的合成有着密切的关系。该基因已经从大鼠、小鼠、牛、人类以及仓鼠中克隆获得。目前,对该基因的研究主要存在于动物体中。在微藻中对SCD基因的研究主要集中在该基因的克隆与结构的分析以及该基因在脂肪酸合成代谢中的作用机制,然而在转录水平上揭示SCD基因与不饱和脂肪酸合成关系的报道尚未发现。有研究表明当基因的表达量增加时,其所催化合成的代谢产物的质量浓度也随之增加[10-11]。因此,研究SCD基因表达差异对探明不饱和脂肪酸合成的分子机制有重大意义。
本研究测定了不同的温度和N、Fe3+质量浓度对微拟球藻脂肪酸组成以及SCD基因表达的影响。实验结果将有助于进一步揭示SCD基因表达与微拟球藻不饱和脂肪酸合成之间的关系。同时为日后利用海洋微藻生产不饱和脂肪酸打下了理论基础。
1 材料与方法
1.1 微藻培养及总RNA提取
实验选用国家海洋局第一海洋研究所藻种库的微拟球藻藻种(NannochloropsisgaditanaHH-1)。将微拟球藻接入f/2培养基中,在温度为25℃,光照强度7 000lx的条件下培养[12]。培养至指数后期,离心收集藻体(4℃、5 000rpm、5min),并接种到新的f/2培养基中,分别在不同温度和N、Fe3+质量浓度的条件下对其进行处理,分别设置条件如下:15℃(低温)、25℃(对照)、35℃(高温),0mg/L NaNO3(缺 N)、75mg/L NaNO3(对照)、150mg/L NaNO3(富N),0mg/L FeCl3(缺Fe)、3.159mg/L FeCl3(对照)、6mg/L FeCl3(富Fe)。当微拟球球藻细胞密度达到7×108cell/mL时,离心(4℃,4 000rpm,5min)收集,保存于液氮中。
用Trizol Reagent提取总RNA,经琼脂糖凝胶电泳检测其完整性。利用TransScript First-Strand cDNA Synthesis SuperMix Kit(TransGen公司,中国北京)对RNA进行反转录,合成cDNA。
1.2 SCD基因的表达分析
以本实验室获得的转录组数据库为基础,设计SCD基因的荧光定量引物(前引物:5′-TTGTGGGCTCATCGTTCCTA-3′,后引物:5′-AACATCACTGTGCCATCCTG-3′)。 根据TransStartTMTop Green qPCR SuperMix Kit说明,设置qRT-PCR的反应条件:94℃3min;94℃15s,55℃15s,72℃34s,40个循环。以微拟球藻的actin和18SrRNA基因作双内参。
1.3 脂肪酸组成分析
脂肪酸甲脂化:称取1g的油脂,加入盐酸-甲醇溶液(V(HC)∶V(CH3OH)=1∶9)4.0mL,混匀,充N2保护,在60℃水浴环境下甲酯化20min,甲酯化过程中每隔10min震荡一次,甲酯化后的样品冷却后加入饱和氯化钠3.0mL,正己烷1.0mL,充分震荡,静置,取正己烷层用无水硫酸钠脱水后进行色谱分析。
脂肪酸组成分析:采用美国Aglient 7890AGC system气相色谱仪(氢火焰离子化检测器(FID)和HP-5毛细管柱(规格)),程序升温以10℃/min从50℃初温升到280℃。进样口温度为270℃,载气为高纯度氦,流速1mL/min。采用无分流进样,进样量为1μL,以面积归一化法计算脂肪酸组分的相对含量。
1.4 数据处理
用SPSS软件对所得数据进行单因素方差分析,以P<0.05作为差异显著性水平,以P<0.01作为差异极显著性水平。采用Duncan多重比较法对平均值进行多重比较。
2 结 果
2.1 不同N质量浓度对微拟球藻脂肪酸组成的影响
由图1可见,不同的N质量浓度对脂肪酸组成有着显著的影响。相比于对照组,在缺N处理下,微拟球藻中C14∶0占总脂肪酸的比例有显著提高,提高了44.48%,而C18∶2、C18∶1、C20∶4占总脂肪酸的比例则有明显的降低趋势,降幅分别为18.18%、6.11%和22.51%。在富N处理组中,C18∶2、C20∶4和C20∶5在微拟球藻总脂肪酸中的比例明显提高,分别提高了9.91%、9.12%和21.46%。而C16∶0和C18∶0占总脂肪酸的比例分别降低了8.52%和29.81%。这表明富N可以促进多不饱和脂肪酸的形成,而缺N条件更有利于饱和脂肪酸的合成。
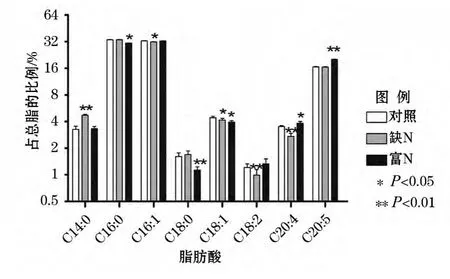
图1 不同N质量浓度下微拟球藻几种主要脂肪酸的组成Fig.1 Major fatty acids composition in Nannochloropsis gaditana under different nitrogen concentrations
2.2 不同培养温度对微拟球藻脂肪酸组成的影响
由图2可见,相比于对照组,在高温处理条件下,微拟球藻中C16∶1和C18∶1占总脂肪酸的比例有显著提高,分别提高了8%和70.81%,而C20∶4和C20∶5占总脂肪酸的比例则明显降低,降幅分别为17.09%和19.41%。在低温处理组中,C18∶2和C20∶4在微拟球藻总脂肪酸中的比例明显提高,分别提高了35.54%和15.67%。而C20∶5占总脂肪酸的比例降低了12.69%。这些结果表明高温可以促进单不饱和脂肪酸的积累,而低温更有利于多不饱和脂肪酸的积累。
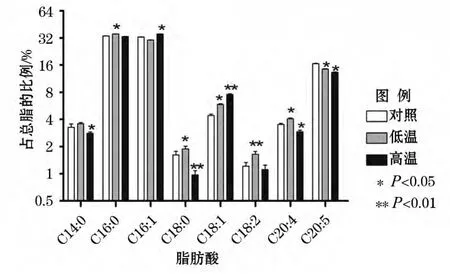
图2 不同温度下微拟球藻几种主要脂肪酸的组成Fig.2 Major fatty acids composition in Nannochloropsis gaditana at different temperatures
2.3 不同Fe3+质量浓度对微拟球藻脂肪酸组成的影响
由图3可见,与对照组比较,在缺Fe的处理组中,C14∶0和C16∶1在微拟球藻总脂肪酸中的比例明显提高,分别提高了5.83%和4.59%,而C16∶0、C18∶1、C18∶0和C20∶5在总脂肪酸的比例显著降低,降幅分别是15.25%、12.89%、40.37%和15.05%。在富Fe的处理组中,C18∶2、C20∶4和C20∶5在微拟球藻总脂肪酸中的比例明显提高,分别提高了8.26%、14.81%和40.75%。而C16∶0和C18∶0在总脂肪酸的比例显著降低,降幅分别是3.66%和40.99%。结果表明,随着Fe3+质量浓度的增加,不饱和脂肪酸尤其是C20∶4和C20∶5发生积累。
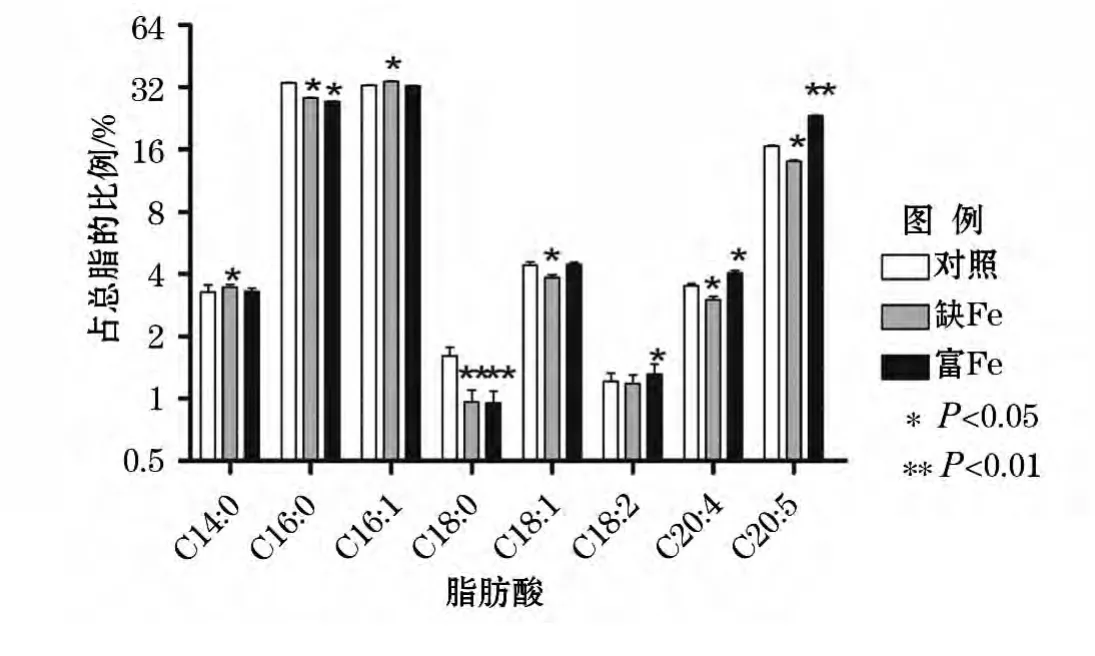
图3 不同Fe3+质量浓度下微拟球藻几种主要脂肪酸的组成Fig.3 Major fatty acids composition in Nannochloropsis gaditana under different Fe concentrations
2.4 不同条件对SCD基因表达的影响
利用实时荧光定量技术对微拟球藻在缺N、富N、低温、高温、缺Fe和富Fe条件处理下,SCD基因的表达差异进行了分析。结果表明:在富N、低温、高温以及富Fe的条件下,SCD基因的表达量比对照要高,其中,富N、高温和富Fe条件下SCD基因的表达量约为对照的15倍。而在缺N和缺Fe条件下SCD基因的表达量要低于对照(图4)。
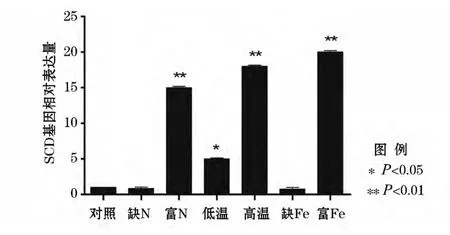
图4 不同处理条件下SCD基因的表达差异Fig.4 Differential expression of SCD gene in Nannochloropsis gaditana under different treatments
3 结 论
藻类的脂肪酸组成受多种环境因素的影响。培养基中N的水平、培养温度以及Fe3+质量浓度都是影响微藻脂肪酸组成的重要因素。不同温度和N、Fe3+质量浓度对单细胞藻类的脂肪酸组成影响较大。Yongmanitchai[13]发现,在高质量浓度的N处理条件下,小球藻(Chlorellasp.)、栅藻(Scenedesmussp.)和三角褐指藻(PhaeodactylttmtricornutumBohlin)的多不饱和脂肪酸质量浓度会显著增加[13]。有研究者指出,当处于缺N条件时,微藻细胞能够选择性地优先利用一种或多种含氮大分子,使细胞内的含氮物质(如蛋白质等)的质量浓度下降,而使细胞内的碳水化合物(如多糖及脂肪酸等)的质量浓度升高[14]。Converti等[15]发现,当温度从20℃升高至25℃时,微拟球藻脂肪酸质量浓度会增加一倍[15]。有研究表明高质量浓度的Fe3+可以促进总脂的积累,并且可以促进鱼类组织中长链多不饱和脂肪酸的合成[16]。
本研究发现,在缺N的条件下,微拟球藻中的饱和脂肪酸的比例显著提高,尤其是C14∶0,占总脂肪酸的比例提高了44.48%,而C18∶2、C18∶1、C20∶4则有明显的降低趋势,降幅分别为18.18%、6.11%和22.51%。这与之前研究三角褐指藻在N限制的培养条件下,多不饱和脂肪酸在总脂肪中的质量浓度下降的结果相符。在富N条件下C18∶2、C20∶4和C20∶5在微拟球藻总脂肪酸中的比例明显提高,分别提高了9.91%、9.12%和21.46%。在高温处理下,微拟球藻中C16∶1和C18∶1占总脂肪酸的比例有显著提高,分别提高了8%和70.81%。而C20∶4和C20∶5则有明显的降低趋势,降幅分别为17.09%和19.41%。在低温处理组中,C18∶2和C20∶4在微拟球藻总脂肪酸中的比例明显提高,分别提高了35.54%和15.67%。在富Fe条件下,多不饱和脂肪酸尤其是C20∶4和C20∶5发生积累。这表明富N、低温、高温以及富Fe可以使微拟球藻的不饱和脂肪酸增加,而缺N以及缺Fe则使得细胞内不饱和脂肪酸的质量浓度有所下降。N是许多酶的组成要素,同时也是微藻生长所不可或缺的营养要素,因此缺N的条件下不仅会影响微藻的生长同时也限制了如脂肪酸去饱和酶等一系列酶的合成,故而引起了不饱和脂肪酸质量浓度下降。而Fe则是许多脂肪酸去饱和酶的辅助因子,是这些酶发挥活性所必需的,缺Fe将使得这些酶的活性丧失从而导致不饱和脂肪酸的质量浓度下降。有研究表明,植物在低温环境下会产生不饱和脂肪酸以减小低温对其的伤害,而较高的温度则可以适当增加酶的活性,从而使体内不饱和脂肪酸质量浓度增加。
不饱和脂肪酸是由饱和脂肪酸经过去饱和酶的催化引入双键而形成的。不饱和脂肪酸的质量浓度多少与去饱和酶密切相关。有研究表明代谢物的质量浓度与合成该代谢物的相关基因的表达量呈正相关。SCD是催化饱和脂肪酸形成第一个双键的关键酶[17]。因此,为了从分子水平上揭示脂肪酸变化的原因,我们通过荧光定量技术检测了在不同温度和N、Fe3+质量浓度的条件下,微拟球藻SCD基因的表达情况。结果表明,富N、低温、高温以及富Fe使SCD基因的表达上调,而缺N和缺Fe则会抑制SCD基因的表达。结合GC-MS所测得的脂肪酸数据分析发现:当微拟球藻中不饱和脂肪酸质量浓度升高时SCD基因的表达也随之升高。二者之间呈现出显著的正相关。这一结果从某种程度上论证了,不饱和脂肪酸质量浓度升高的原因是不同的处理条件使得SCD基因的表达上调,从而增加了微拟球藻中SCD的质量浓度,进而催化了饱和脂肪酸形成双键。本实验揭示了SCD基因在不饱和脂肪酸合成途径中的重要作用,然而脂肪酸代谢是由多个基因共同调控的,因此更多的与不饱和脂肪酸合成相关的基因有待于进一步研究。
(References):
[1] VOLKMAN J K,BROWN M R,DUNSTAN G A,et al.The biochemical composition of marine microalgae from the class Eustigmatophyceae[J].Journal of Phycology,1993,29(1):69-78.
[2] HARPER C R,JACOBSON T A.Beyond the mediterranean diet:The role of omega-3fatty acids in the prevention of coronary heart disease[J].Preventive Cardiology,2003,6(3):136-146.
[3] LEITZMANN M F,STAMPFER M J,MICHAUD D S,et al.Dietary intake of n-3and n-6fatty acids and the risk of prostate cancer[J].The American Journal of Clinical Nutrition,2004,80(1):204-216.
[4] GRAHAM I,CIRPUS P,REIN D,et al.The use of very long chain polyunsaturated fatty acids to ameliorate metabolic syndrome:Transgenic Plants as an Alternative Sustainable Source to Fish Oils[J].Nutrition Bulletin,2004,29(3):228-233.
[5] RUBIO-RODRíGUEZ N,BELTRáN S,JAIME I,et al.Production of omega-3polyunsaturated fatty acid concentrates:a review [J].Innovative Food Science & Emerging Technologies,2010,11(1):1-12.
[6] PIEBER S,SCHOBER S,MITTELBACH M.Pressurized fluid extraction of polyunsaturated fatty acids from the microalgaNannochloropsisoculata[J].Biomass and Bioenergy,2012,47:474-482.
[7] PAULY D,ALDER J,BENNETT E,et al.The future for fisheries[J].Science,2003,302(5649):1359-1361.
[8] HITES R A,FORAN J A,CARPENTER D O,et al.Global assessment of organic contaminants in farmed salmon[J].Science,2004,303(5655):226-229.
[9] PENG G,DU Y L,XU S M,et al.Stearoyl-CoA desaturase-1and lipid metabolism[J].Chinese Bulletin of Life Sciences,2011,23(11):1101-1105.彭恭,杜雅兰,徐式孟,等.硬脂酰辅酶 A去饱和酶与脂代谢调控[J].生命科学,2011,23(11):1101-1105.
[10] REN A,QIN L,SHI L,et al.Methyl jasmonate induces ganoderic acid biosynthesis in the basidiomycetous fungus Ganoderma lucidum[J].Bioresource technology,2010,101(17):6785-6790.
[11] LIANG C X,LI Y B,XU J W,et al.Enhanced biosynthetic gene expressions and production of ganoderic acids in static liquid culture ofGanodermalucidumunder phenobarbital induction[J].Applied microbiology and biotechnology,2010,86(5):1367-1374.
[12] HARRISON P J,WATERS R E,TAYLOR F.A broad spectrum artificial sea water medium for coastal and open ocean phytoplankton1[J].Journal of Phycology,1980,16(1):28-35.
[13] YONGMANITCHAI W,WARD O.Growth of and omega-3fatty acid production byPhaeodactylumtricornutumunder different culture conditions[J].Applied and Environmental Microbiology,1991,57(2):419-425.
[14] SUEN Y,HUBBARD J,HOLZER G,et al.Total lipid production of the green algaNannochloropsissp.QII under different nitrogen regimes1[J].Journal of Phycology,1987,23(2):289-296.
[15] CONVERTI A,CASAZZA A A,ORTIZ E Y,et al.Effect of temperature and nitrogen concentration on the growth and lipid content ofNannochloropsisoculataandChlorellavulgarisfor biodiesel production[J].Chemical Engineering and Processing:Process Intensification,2009,48(6):1146-1151.
[16] SENADHEERA S D,TURCHINI G M,THANUTHONG T,et al.Effects of dietary iron supplementation on growth performance,fatty acid composition and fatty acid metabolism in rainbow trout(Oncorhynchusmykiss)fed vegetable oil based diets[J].Aquaculture,2012,342-343:80-88.
[17] LOS D A,RAY M K,MURATA N.Differences in the control of the temperature-dependent expression of four genes for desaturases inSynechocystissp.PCC 6803[J].Molecular Microbiology,1997,25(6):1167-1175.
- 海洋科学进展的其它文章
- 辽东湾北部LH01孔晚更新世24 ka以来古环境演变*1

