新型二苯甲酮光引发剂的合成及其光聚合性能
蒋 姗 朱晓丹 王克敏
(常州大学材料科学与工程学院 常州 213164)
光聚合技术是一种新型绿色工业技术,它能够高效、环保、节能并优质地处理材料表面,在涂料、粘合剂、光致抗蚀剂、齿科修复、油墨、药物释放和食品包装等诸多领域有着广泛的应用[1-3]。在光固化组成配方中,光引发剂是关键组成部分,它关系到配方体系在光照射时低聚物及稀释剂能否迅速由液态转变成固态。
二苯甲酮(BP)是广泛使用的一种夺氢型光引发剂,在受到紫外光照射之后,二苯甲酮分子从基态吸收能量变为激发态,但由于二苯甲酮分子中的两个苯环使得它的自由体积较大,产生较大的位阻效应,不能够直接引发聚合,需要夺取供氢体上的氢,把能量传给供氢体,从而引发聚合。
叔胺作为助引发剂要比醇类或者醚类反应性好,与二苯甲酮这类夺氢型光引发剂作用,形成激基复合物,N原子会失去一个电子,叔胺上N邻位α-C上的H呈强酸性,易以质子的形式离去,产生以C为中心的胺烷基自由基,从而引发反应。然而在实际应用中,若助引发剂在固化体系中的含量较高,会影响固化膜的表面硬度,而且还会引起黄变、毒性和诱变[4]。一般这类助引发剂为小分子的胺,而这类小分子胺助引发剂往往具有毒性,从而限制了二苯甲酮光引发剂在食品包装方面的应用。通过大分子的胺助引发剂及其与二苯甲酮的结合,可以减少小分子胺参与光引发体系,从而降低固化膜的毒性[5]。然而,这些改进不能从根本上消除胺助引发剂的缺点。
本文用叔丁醇钾对 4-(2,3-环氧丙氧基)二苯甲酮(EBP)开环反应合成了含有供氢体的4-(2-羟基-3-叔丁基)二苯甲酮(OEBP)[8]。值得注意的是,这种光引发剂在没有添加任何助引发剂的情况下可以产生自由基引发聚合。研究了该引发剂的光解反应,为了确定其引发效率,研究了光照强度,引发剂的浓度对光聚合动力学的影响,传统的光引发体系 BP和 BP/N, N-二甲基苯甲酸乙酯(EDAB)作为对比也进行了研究,并推测了OEBP的引发机理。
1 材料与方法
1.1 试剂
对羟基二苯甲酮、环氧氯丙烷、叔丁醇钾、1, 6-己二醇双丙烯酸酯(HDDA)、二苯甲酮、4-二甲基氨基苯甲酸乙酯(EDAB)和EBP按照文献[6]合成。
1.2 仪器
傅里叶变换红外光谱仪(Nicolet iS5)、紫外分光光度计(Hitachi U3900)、核磁共振仪(Bruker AV500)、紫外点光源(加拿大EFOS公司)、UV光强计(德国Honle公司)。
1.3 OEBP的合成
将2g EBP加入100mL的四口烧瓶,向其中加入20mL乙醇,四口烧瓶内呈固液两相,加热搅拌,冷凝回流,当瓶内温度升高到50 ℃时,EBP溶于乙醇,溶液呈无色透明。当温度升高到 70 ℃时,将质量浓度为5%的叔丁醇钾乙醇溶液用100mL的恒压滴液漏斗滴加到四口烧瓶中,控制滴加速度,1h后滴加完毕。继续反应24 h后停止,冷却至室温,倒入单口圆底烧瓶,旋转蒸发仪蒸出乙醇后,加入乙腈,并用砂芯漏斗过滤掉叔丁醇钾,再旋蒸出溶剂,得到淡黄色透明的粘稠液体。OEBP合成路线如图1所示。
1.4 实时红外光谱监测聚合反应进程
将单体与光引发剂配制成聚合体系,超声震荡2min保证体系混合均匀,然后,在室温下用紫外光点光源通过光纤定向照射样品,通过监测近红外区810 cm–1附近丙烯酸酯双键特征吸收峰峰面积的变化直观地反映聚合进行的程度。按式(1)计算单体的双键转化率(RDC, %)。
其中,RDC是紫外光照时间为t时C=C双键的转化率;A0为紫外光照前C=C双键吸收峰的初始面积;At为紫外光照时间为t时的双键吸收峰面积。
2 结果与讨论
2.1 OEBP的红外光谱
图2是OEBP的红外光谱图。从图2中可以看出,反应后在 3493 cm–1处出现明显的羟基伸缩振动吸收峰,证明环氧基团被打开,且 2929 cm–1处甲基亚甲基的伸缩振动峰峰面积增加,1487 cm–1出现亚甲基面外弯曲振动吸收,1380 cm–1处出现甲基不对称弯曲振动吸收,说明乙氧基结构引入到EBP结构上。红外光谱的基团特征吸收峰的变化可以确定EBP发生了开环氧化反应。
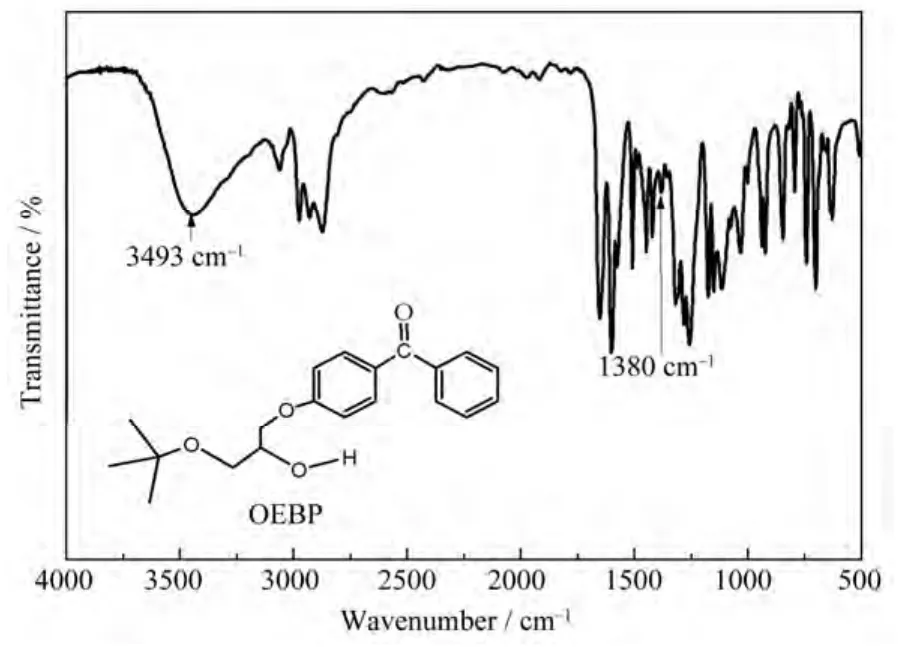
图2 OEBP 的红外光谱图Fig.2 IR spectra of OEBP
2.2 EBP核磁共振氢谱
图 3是 EBP和 OEBP的核磁共振氢谱图。δ=6.98–7.91为苯环上氢质子的特征信号,δ=2.79、2.96和3.42为EBP环氧基团上氢质子的特征信号,δ=4.05和 δ=4.35为-O-CH2-中亚甲基氢质子的化学位移。δ=2.79、2.96和3.42处EBP环氧基团上氢质子的特征信号几乎消失,而在 δ=3.6、2和 1.21处出现新的化学位移,分别为-O-CH2-CH-、-OH和-CH3。综合红外光谱和核磁共振谱图可以确定OEBP的结构。
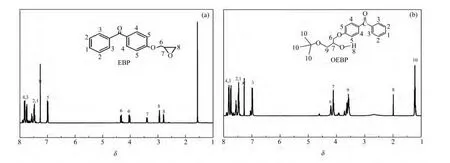
图3 EBP (a) and OEBP (b)的1H NMR图Fig.3 The 1H NMR spectrum of EBP (a) and OEBP (b)
2.3 OEBP紫外吸收光谱
图4 是OEBP、BP+EDAB及BP在乙腈溶液中的紫外吸收光谱图。从图4可知,二苯甲酮最大紫外吸收在255nm左右,OEBP和BP+EDAB 在此处都有吸收,而 OEBP在 280nm有最大吸收,BP+EDAB在318nm有最大吸收。光引发剂之所以能够引发光聚合反应,很大程度上是因为它吸收光的能力,通过比较可知这三者在255nm左右都有吸收峰,但OEBP最大吸收峰在280nm处。
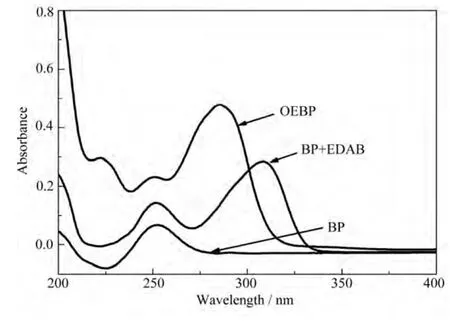
图4 OEBP、BP+EDAB和BP在乙腈溶液中紫外吸收光谱Fig.4 UV absorption spectra of OEBP, BP+EDAB and BP in acetonitrile solution
2.4 OEBP的紫外光降解
OEBP的光解反应通过其紫外吸收光谱的最大吸收峰的改变来监控,图5记录了OEBP在乙腈溶液中被紫外光光照0 min、10 min、30 min、50 min、90 min和120 min后的紫外吸收光谱的变化。在光分解的过程中,随着引发剂光照分解,其紫外吸收峰也会随之改变。从图5中可以看出,随着紫外光照的进行,OEBP的最大吸收峰280nm逐渐减少,其变化呈线性关系。
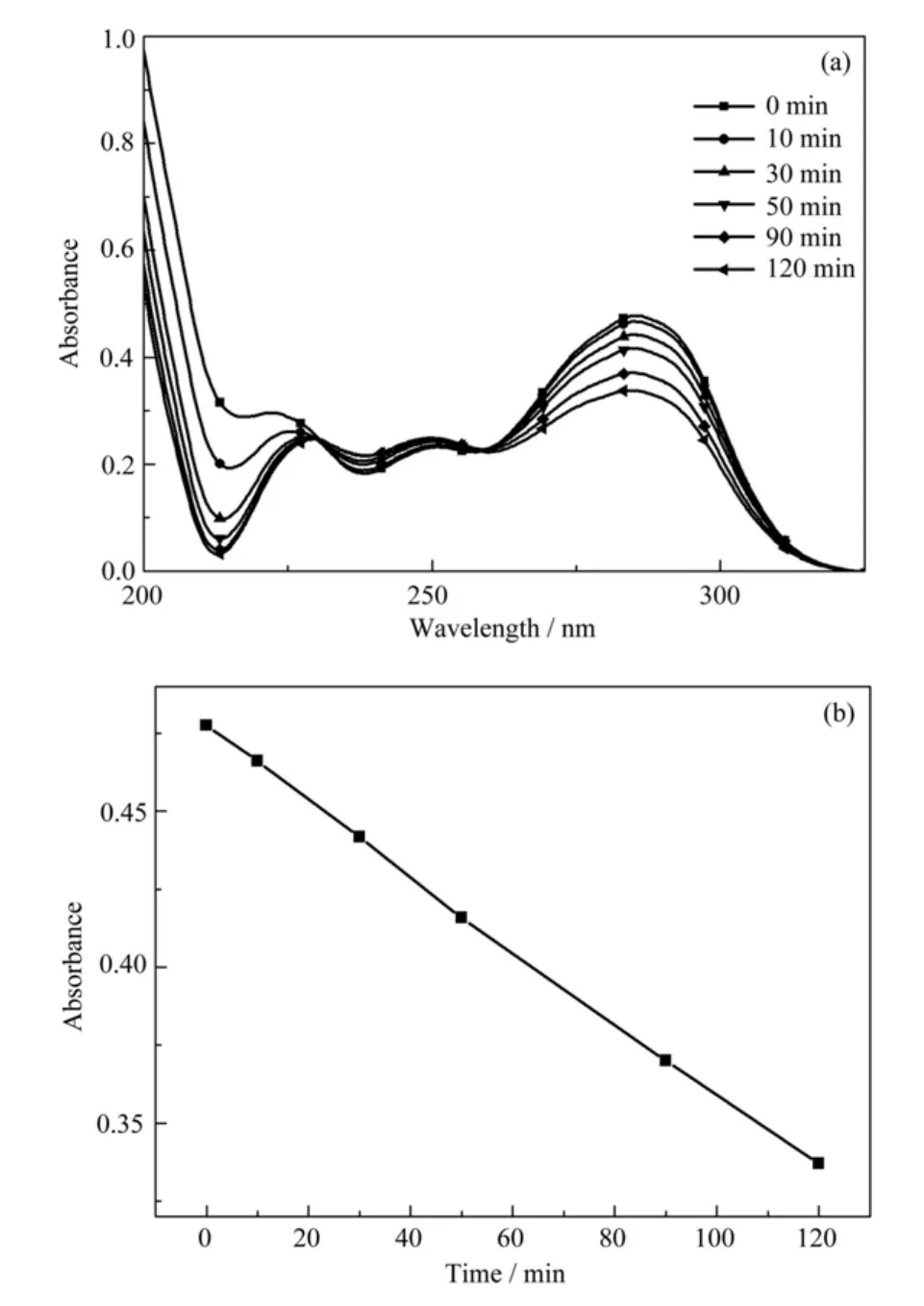
图5 OEBP在乙腈溶液中的紫外光降解(a)和OEBP在280nm处的紫外吸收随光照时间的变化(b)Fig.5 Typical UV spectra change of OEBP in acetonitrile by UV irradiation (a) and Photoreduction characteristics of OEBP at 280nm (b)
2.5 OEBP作为光引发剂的光聚合性能
光引发剂是光聚合反应体系最重要的影响因素之一,图6表示光强为50 mW·cm–2,单体为HDDA时,OEBP浓度对双键转化率的影响。聚合过程的速率变化用转化率–时间曲线表示。整个聚合过程一般可以分为诱导期、聚合初期、中期、后期等几个阶段。转化率达到10%–20%以后,聚合速率逐渐增加,出现了自动加速现象,加速现象可延续到转化率达到50%–70%,这个阶段称作聚合中期;以后聚合速率逐渐转慢,进入聚合后期。从图6中可以看出,随着引发剂浓度的增加,单体的最终双键转化率先增大后减小。当OEBP浓度为0.1%(重量分数)时,最终转化率为72%,且聚合速率慢;当引发剂浓度从0.1%增加到0.8%时,最终转化率从72%增加到90%;当OEBP浓度继续增大到1%时,最终转化率下降。这可能是因为当 OEBP浓度为 0.1%时,引发剂浓度较低,产生的活性自由基数量较少,故聚合速率不大,最终转化率也不高。随着引发剂浓度增加,单位时间内产生的自由基数量增加,就有更多的自由基可以参与链增长反应,当OEBP浓度增加到一定值的时候不仅没有促进聚合,反而使转化率下降,自由基浓度太高,它们之间相互碰撞的几率大大增加,使许多原本具有高活性的自由基淬灭失活,从而降低了转化率[7]。
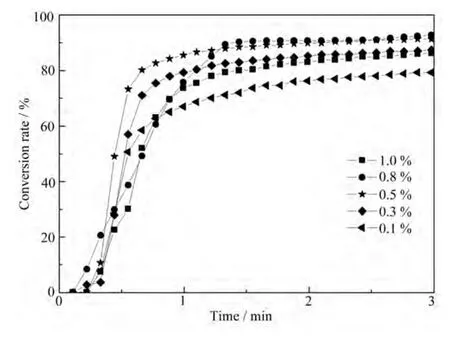
图6 不同OEBP浓度引发HDDA双键转化率随时间变化曲线Fig.6 Photopolymerization of HDDA vs. irradiation time with OEBP of different concentrations as initiator
图7 是OEBP浓度为0.5%时,光强对HDDA转化率的影响。由图7可知,光照强度增加,HDDA的转化率随之增加。光照强度为 10 mW·cm–2时,HDDA 的最终双键转化率为 60%。当光照强度从10 mW·cm–2增加至 50 mW·cm–2时,最终转化率和聚合速率增加显著,最终双键转化率从60%增加到83%。光照强度低的时候,单位时间内产生的光电子数少,使得光引发剂受激发的概率减小,产生的自由基较少,相对自由基浓度就比较低,容易形成“笼蔽效应”[8],因此聚合速率低。光照强度增强,自由基浓度会得到相应的提高,从而使最终双键转化率和聚合速率都增加。
图8是引发剂浓度为0.1 %,光强为30 mW·cm–2时,OEBP、 BP和 BP+EDAB对HDDA双键转化率的影响曲线。
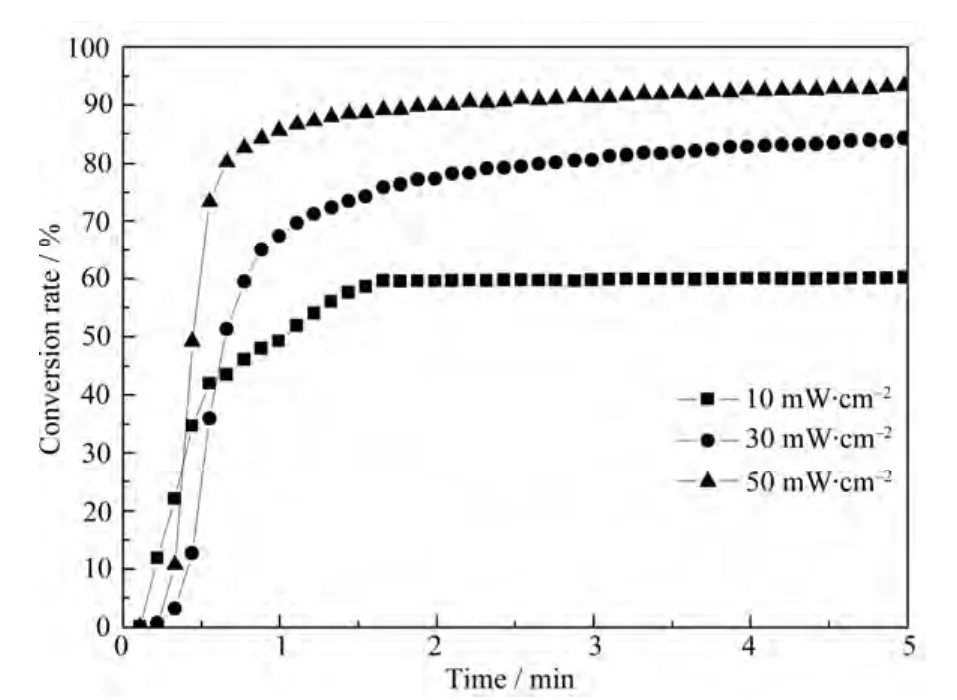
图7 不同光强引发HDDA双键转化率随时间变化曲线,OEBP浓度=0.5%Fig.7 Photopolymerization of HDDA vs. irradiation time with different light intensity, [OEBP]=0.5%
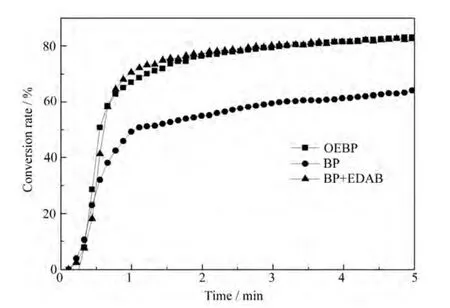
图8 不同引发剂类型引发HDDA双键转化率随时间变化曲线Fig.8 Photopolymerization of HDDA vs. irradiation time initiated by different photoinitiators
由图8可见,引发体系只有BP时,HDDA的最终转化率较低,只有50%左右,而OEBP引发的聚合速率和最终转化率都比BP高,并且OEBP引发单体的聚合速率和最终转化率都与BP+EDAB的相当。因此OEBP可以完全代替商业用的引发剂BP和BP/EDAB,而且 OEBP作为光引发剂最重要的优点是,OEBP可以不添加任何的胺助引发剂,从而可以克服胺助引发剂在光聚合中应用引起的缺点。
BP的引发体系中,必须有助引发剂才能发生有效的引发聚合。然而在OEBP的聚合体系中,并没有助引发剂的存在,但其引发效率与BP+EDAB相当。其原因是在 OEBP分子中,有-CH2O-结构的存在,该基团能够作为激发态BP的还原剂,产生引发聚合的自由基-C·HO-[9]。OEBP可能的引发机理如图9所示。
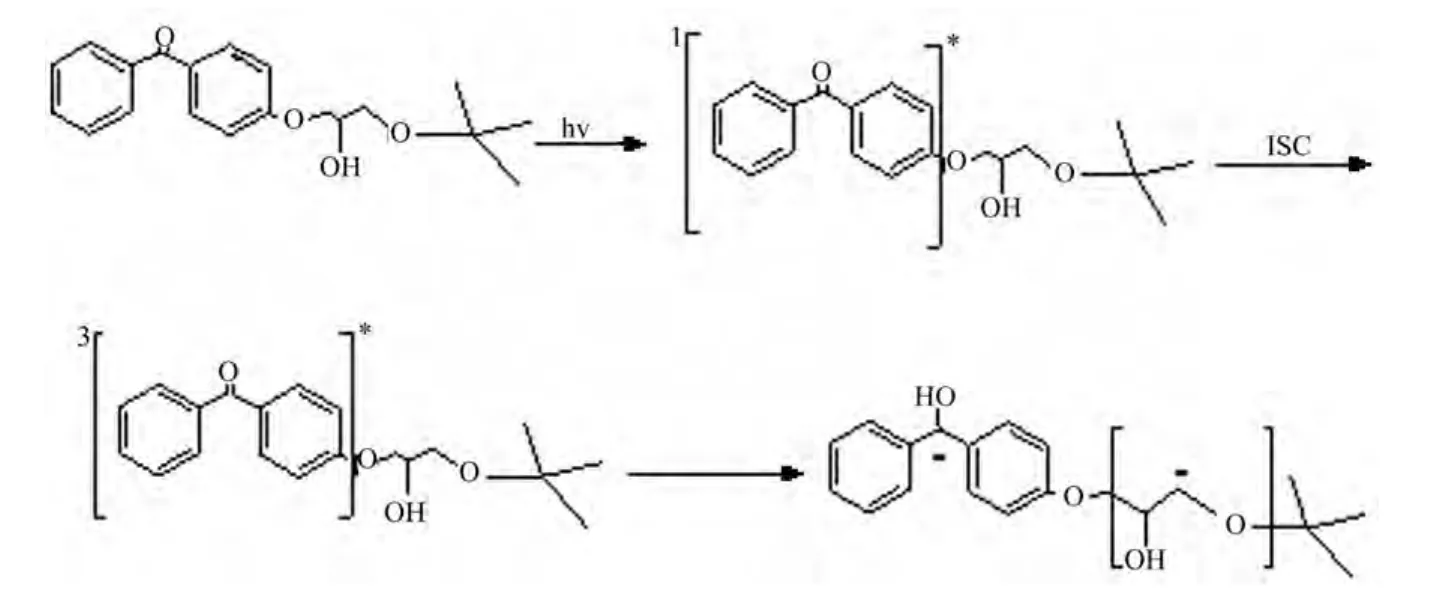
图9 OEBP可能的光反应机理Fig.9 Possible photoreaction mechanism of OEBP
3 结论
OEBP是一种有效的自由基聚合光引发剂,随着引发剂浓度的增加,单体的最终双键转化率先增大后减小,单体最终双键转化率随着光强的增大而增大。 而且OEBP与传统的光引发剂BP/EDAB引发效率相当。因此这种引发剂非常有吸引力,它可以不需要助引发剂单独引发丙烯酸类和多官能团的单体聚合。这些性质显示了OEBP可在各种实际的UV光聚合中应用,能够消除胺助引发剂的使用。
1 Onuki Y, Hoshi M, Okabe H, et al. Formulation optimization of photocrosslinked polyacrylic acid modified with 2-hydroxyethyl methacrylate hydrogel as an adhesive for a dermatological patch [J]. Journal of Controlled Release, 2005, 108(2-3): 331-340.
2 He H Y, Li L, Lee L J. Photopolymerization and structure formation of methacrylic acid based hydrogels in water/ethanol mixture [J]. Polymer, 2006, 47(5): 1612-1619.
3 Fouassier J P, Allonas X, Burget D. Photopolymerization reactions under visible lights: principle,mechanisms and examples of applications [J]. Progress in Organic Coatings, 2003, 47(1): 16-36.
4 Tasdelen M A, Moszner N, Yagci Y. The use of polyethylene oxide as hydrogen donor in type II photoinitiated free radical polymerization [J]. Polymer Bulletin, 2009, 63(2): 173-183.
5 Wei J, Liu F. Novel highly efficient macrophotoinitiator comprisingbenzophenone,coinitiator amine, and thio moieties forphotopolymerization [J]. Macromolecules,2009, 42(15): 5486-5491.
6 Chen L L, Shi W F. Synthesis and photoinitiating behavior of benzophenone-based polymeric photoinitiators used for UV curing coatings [J]. Progress in Organic Coatings,2011, 71(4): 355- 361.
7 Kloosterboer Jg, Van de Heig M M, Gossink Rg, et al.The effects of volume relaxation and thermal mobilization of trapped radicals on the final conversion of photopolymerized diacrylates [J]. Polymer communications, 1984, 25(11): 322-325.
8 潘祖仁. 高分子化学 [M]. 北京: 化学工业出版社,2008: 74-75.PAN Zuren. Polymer chemistry [M]. Beijing: Chemical Industry Press, 2008: 74-75.
9 Andrzejewska E, Hugg L, Andrzejewski M, et al.Trithianes as coinitiators in benzophenone-Induced photopolymerizations [J]. Macromolecules, 1999, 32(7):2173-2179.

