低剂量率中子-伽玛射线混合照射对大鼠肝细胞CYP7A1基因mRNA表达的影响
欧阳可汉 沈先荣, 何 颖
1(海军工程大学核能科学与工程系 武汉 430033)
2(海军医学研究所 上海 200433)
低剂量率电离辐射对健康的影响是学术界和公众十分关注的问题。而在一些存在放射性的工作场所中,如核电站,存在中子-γ射线混合照射。研究低剂量率中子-γ射线混合照射对机体的影响对维护职业受照人群的健康具有重大意义。Wong等[1]研究发现原子弹爆炸幸存者的血清胆固醇水平相对较高,认为其与电离辐射水平相关。胆固醇代谢异常将导致一些疾病的产生,比如动脉粥样硬化等心血管疾病,阿尔茨海默病等神经系统疾病[2-3]。肝脏作为唯一能够将体内过多的胆固醇转化为胆汁酸的器官,对胆固醇代谢起着至关重要的作用。肝脏的胆固醇代谢异常将导致一些疾病的发生,比如胆汁淤积、黄疸病、胆结石,使肝功能出现大范围异常[4-5]。同时胆固醇代谢和其他一些物质(葡萄糖、脂肪酸)的代谢途径还存在相互交叉。因此,当一个代谢系统被扰乱,将会出现更大范围的异常。故低剂量率电离辐射对机体胆固醇代谢的作用及其机制值得深入研究。
胆固醇 7α-羟化酶(CYP7A1)是胆固醇转化为胆汁酸经典途径的主要限速酶,它在胆固醇代谢中起着重要的作用[6]。本研究采用低剂量率中子-γ射线混合照射大鼠,在照射14 d(γ射线累积照射剂量为 0.4676 Gy、中子累积照射剂量为 7.84 mGy)和31 d(γ-射线累积照射剂量为1.0354 Gy、中子累积照射剂量为17.36 mGy)后采集样本,运用实时荧光定量PCR法对肝脏细胞CYP7A1基因及调控其表达的核转录因子的mRNA水平进行检测。旨在研究低剂量率中子-γ射线混合照射对大鼠胆固醇分解代谢关键分子胆固醇 7α-羟化酶(CYP7A1)基因表达的影响,并初步探讨其可能机制,为阐明低剂量率中子-γ射线混合照射对胆固醇代谢影响的作用机制奠定基础。
1 材料与方法
1.1 试剂与仪器
BIO RAD Chromo 4实时荧光定量PCR仪、Trizol reagent (Invitrogen 公司)、SYBR Green Premix Ex TapTM(TaKaBa,宝生物工程大连有限公司)、微量紫外分光光度计 NanoDrop 1000(Thermo 公司)、DL2000 Marker、琼脂糖。
1.2 动物分组及处理
购买雄性Wistar大鼠60只(上海西普尔-必凯实验动物有限公司),动物饲养于海军医学研究所。编号后按随机数字表法分为4组:(1)14 d后处死的空白对照组10只;(2)14 d后处死的混合照射组20只;(3)31 d后处死的空白对照组10只;(4)31 d后处死的混合照射组20只。照射组在海军医学研究所辐照室进行照射,照射条件为:与60Co源距离为4.38 m,γ射线照射剂量率为0.0167 Gy·h-1,每天照射2 h,同时与252Cf源距离为0.75 m,中子剂量率0.028 mGy·h-1,每天照射20 h。期间动物自由饮食饮水。在照射14 d (γ射线累积照射剂量0.4676 Gy、中子累积照射剂量7.84 mGy)、31 d (γ射线累积照射剂量1.0354 Gy、中子累积照射剂量17.36 mGy)后,马上处死空白对照组大鼠10只、混合照射组大鼠 20只。迅速取出肝脏,制成单细胞悬液,PPS洗2次后备用。
1.3 肝脏总RNA的提取及cDNA合成
采用Trizol法提取总RNA,紫外分光光度计测定 260nm与 280nm处吸光度(A)的比值,即A260/A280,然后进行总 RNA定量,-80℃下冷冻备用。cDNA合成是按照逆转录试剂盒操作说明书进行,取5000 ng的总RNA,加20 μL的试剂,再加双蒸水至总体积为100 μL。
1.4 实时定量 PCR引物的设计合成
根据GenBank中基因信息,应用Primer Primer 5软件设计用于实时定量PCR实验检测的目的基因和内参基因引物序列。引物由上海生工生物技术有限公司合成,并且纯化质检合格,具体信息见表 1。

表1 用于实时定量PCR测定的基因引物序列Table 1 Primers of genes used for RT-PCR
1.5 实时定量PCR检测基因表达
先分别对14 d和31 d样品进行混装:10只空白对照组大鼠的cDNA等量混装成为3管,其中2管是由随机选取的等量的3只大鼠的cDNA样本混合,1管是由等量的4只大鼠的cDNA样本混合;20只混合照射组大鼠的cDNA等量混装成为6管,其中4管是由随机选取的等量的3只大鼠的cDNA样本混合,2管是由随机选取的等量的4只大鼠的cDNA样本混合。PCR实验时每个样品设立3个平行孔。用实时定量PCR试剂盒,以不同浓度梯度的cDNA样本,分别建立目的基因和内参基因(β-actin)扩增的标准曲线,判断实时定量 PCR的扩增效率。采用优化条件中达到最佳扩增效率的cDNA样本和引物量进行检测[7]。20 μL反应体系中包括:SYBR 10 μL,双蒸水 8 μL,上下游引物各 0.5 μL,cDNA样本 1 μL。PCR 扩增条件为 95 ℃ 预变性 3 s;95 ℃变性10 s,60 ℃退火延伸30 s的条件下循环 41次,每次循环结束后进行荧光检测。扩增结束后于1 ℃的梯度逐步升温至 95 ℃进行熔解曲线分析,确定扩增产物的特异性。
1.6 实时定量PCR数据分析
分别测定每个样本的目的基因和内参基因(βactin)扩增的 Ct值,然后采用相对定量方法分析每个样本目的基因的 ΔCt值(ΔCt值=目的基因 Ct值-内参基因Ct值),再依据ΔΔCt(实验组ΔCt-对照组ΔCt)计算出 2-ΔΔCt。当目的基因与内参基因的扩增效率接近时,2-ΔΔCt的值就表示实验组样本中的目的基因相对于对照组样本中的目的基因转录水平变化倍数[7]。以靶基因相对表达变化2倍以上为有差异。
1.7 统计学处理
2 结果
2.1 肝脏总RNA质量
各样本的总 RNA 其 A260/A280都在 1.8-2.0之间,纯度较好。随机挑选的6个样品的总RNA的琼脂糖凝胶电泳图(图 1)有清晰的三条带。故提取的各样本总RNA质量合格。
图1 样品总RNA的琼脂糖凝胶电泳Fig.1 Gel images of the total RNA of liver samples
2.2 实时定量 PCR扩增的标准曲线相关系数和产物的确定分析
β-actin、CYP7A1、PXR、LXR、PPARα、FXR、HNF4α基因扩增曲线正常(R2为 0.995-0.999)扩增效率为95%-105%。结果说明,实时定量PCR检测系统建立成功且准确可靠,完全满足实时定量PCR检测优化条件,可以应用相对定量 2-ΔΔCt方法进行分析计算。熔解曲线分析显示基因的熔解曲线峰形均单一锐利,说明扩增产物无非特异信号干扰,扩增反应具有较好的特异性(图2)。琼脂凝胶电泳显示所得扩增产物均为目的条带(图3)。

图2 基因的熔解曲线:上排从左到右依次为β-actin、CYP7A1、PXR和FXR,下排从左到右为LXRα、HNF4α和PPARαFig.2 Dissociation curves of genes. From the left to the right are β -actin, CYP7A1, PXR, FXR in the upper row and LXRα, HNF4α, and PPARα in the bottom row
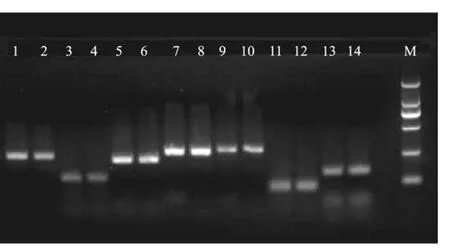
图3 基因的PCR扩增产物琼脂糖凝胶电泳M: DNA marker DL2000;1: β-actin(受照 14 d 后的样品);2: β-actin(受照 31 d 后的样品);3: CYP7A1(受照 14 d 后的样品);4: CYP7A1(受照31 d后的样品);5: PXR(受照14 d后的样品);6: PXR(受照31 d后的样品);7: FXR(受照 14 d 后的样品);8: FXR (受照 31 d 后的样品);9: LXRα(受照14 d后的样品);10: LXRα (受照31 d后的样品);11: HNF4 α (受照 14 d 后的样品);12: HNF4α (受照 31 d后的样品);13: PPARα (受照14 d后的样品);14:PPARα (受照31 d后的样品)Fig.3 Gel images of the PCR products of genes. M: DNA marker DL2000; 1: β-actin(sample was irradiated for 14 d);2: β-actin(sample was irradiated for 31 d);3:CYP7A1(sample was irradiated for 14 d); 4: CYP7A1(sample was irradiated 31 d); 5: PXR(sample was irradiated for 14 d); 6: PXR(sample was irradiated for 31 d); 7:FXR(sample was irradiated for 14 d); 8: FXR(sample was irradiated for 31 d); 9: LXRα (sample was irradiated for 14 d); 10: LXRα (sample was irradiated for 31 d); 11: HNF4α(sample was irradiated for 14 d); 12: HNF4 α (sample was irradiated for 31 d); 13: PPARα (sample was irradiated for 14 d); 14: PPARα (sample was irradiated for 31 d);
2.3 低剂量率中子-γ射线混合照射后大鼠肝细胞CYP7A1基因mRNA表达的变化
图4 显示各基因表达的检测结果,表明大鼠肝脏于全身混合照射14 d和31 d后基因扩增曲线良好。将空白对照组肝细胞CYP7A1基因mRNA表达水平设为 1,并据此确定混合照射组肝细胞CYP7A1基因mRNA的相对表达量。表2所列为用实时荧光定量 PCR 技术检测得到的各基因的Ct值、ΔCt值(ΔCt值=目的基因 Ct值一内参基因Ct值),再依据ΔΔCt(实验组ΔCt-对照组ΔCt)计算出相对表达倍数2-ΔΔCt。图5显示,在受照14 d后(γ射线累积照射剂量为0.4676 Gy、中子累积照射剂量为 7.84 mGy),混合照射组大鼠肝细胞CYP7A1基因 mRNA表达下调至空白对照组的44% (p<0.01),有非常显著差异;在受照31 d后(γ射线累积照射剂量为1.0354 Gy、中子累积照射剂量为 17.36 mGy),混合照射组大鼠肝细胞CYP7A1基因 mRNA表达下调至空白对照组的22% (p<0.01),有非常显著差异。在一定时期内,大鼠肝细胞CYP7A1基因mRNA表达随着受照剂量的增加而显著下降。
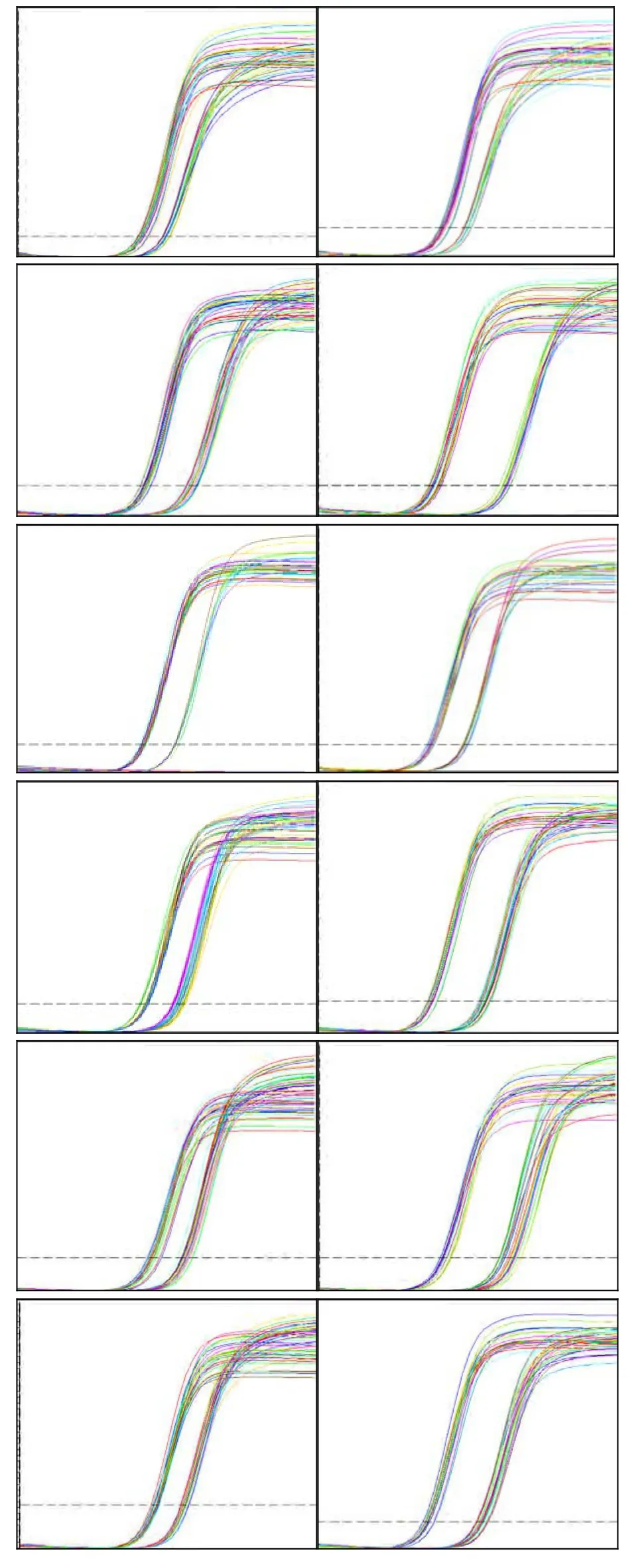
图4 照射14 d和31 d后大鼠肝脏基因表达实时定量PCR检测的扩增曲:左边为照射14 d后的样本,右边为照射31 d后的样本:从上至下依次为CYP7A1+ β-actin、PPARα+ β-actin、FXR+ β-actin、PXR+ β-actin、LXRα+ β-actin、HNF4α+ β -actinFig.4 Amplification curves of genes in liver assayed with RT-qPCR after radiated for 14 d and 31 d, respectively.Samples radiated for 14 d on the left side and samples radiated for 31 d on the right side. From up to down are CYP7A1+ β-actin, PPARα+ β-actin, FXR+ β-actin,PXR+ β-actin, LXRα+ β-actin, and HNF4α+ β-actin.
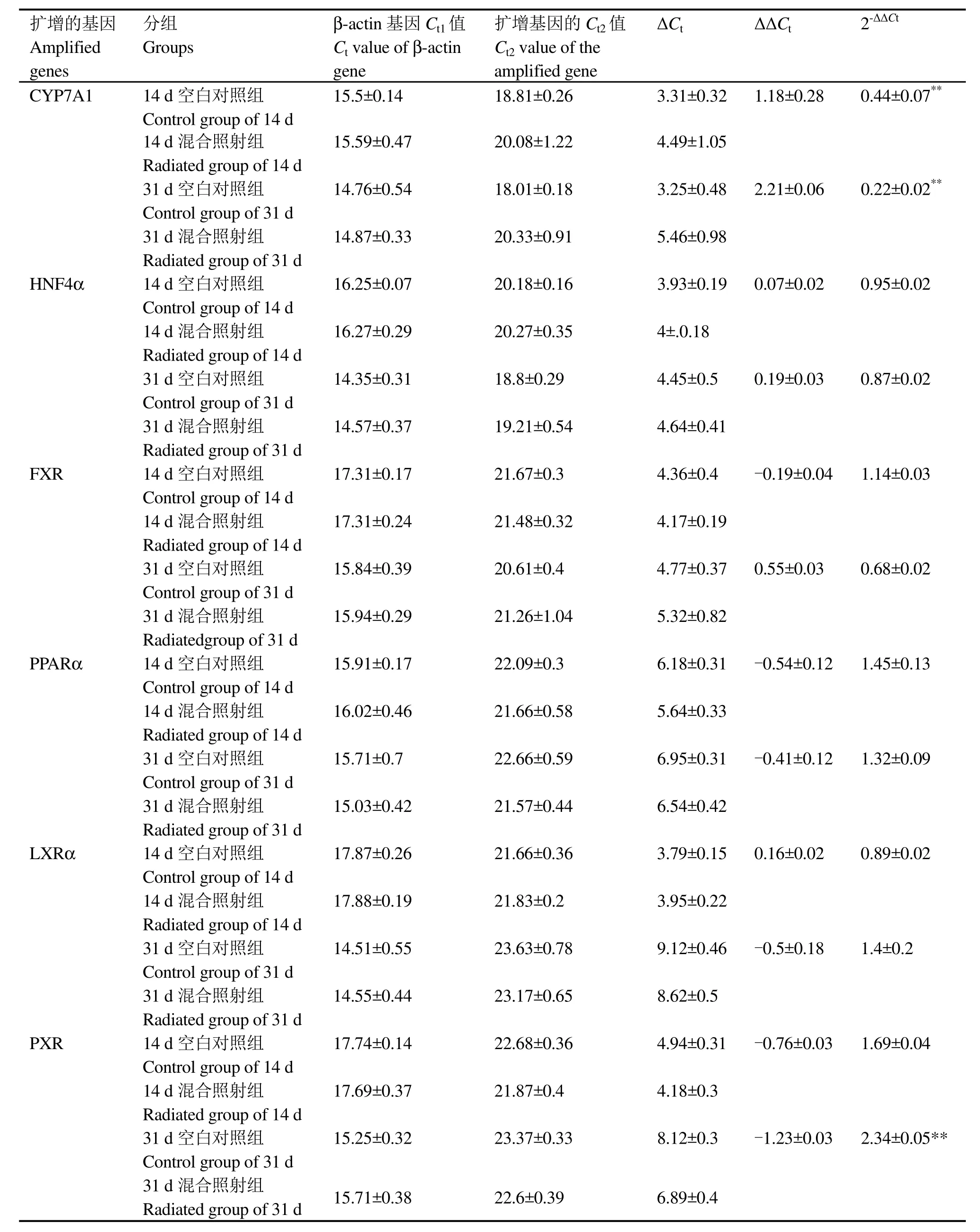
表2 照射后各基因mRNA表达水平Table 2 The mRNA level of the genes after radiated
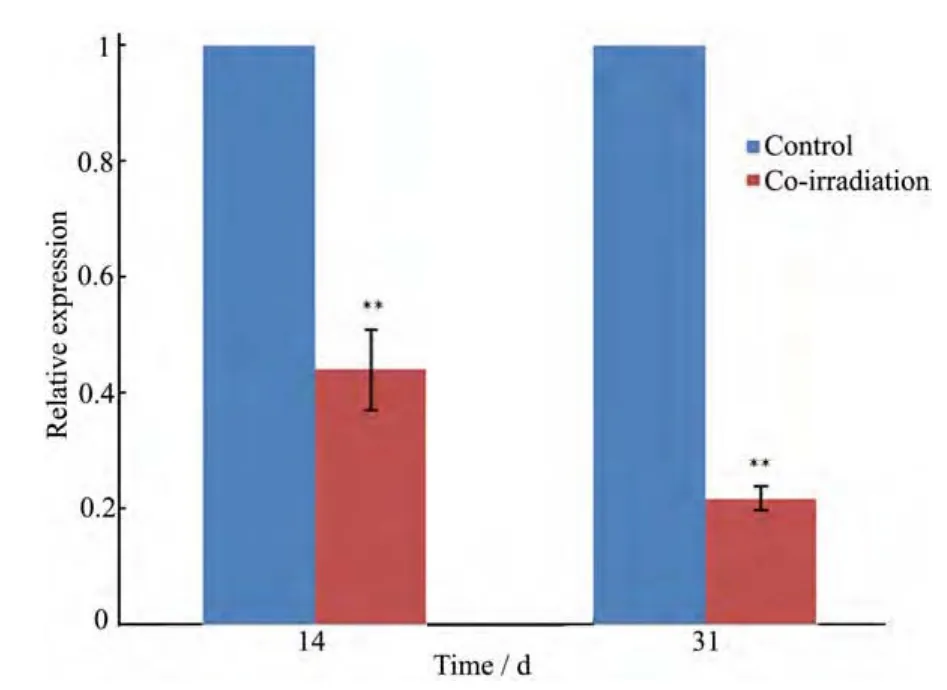
图5 CYP7A1基因mRNA相对于内参β-actin基因mRNA的表达水平,将空白对照组肝细胞CYP7A1基因mRNA表达水平设为1,**, p<0.01Fig.5 CYP7A1 mRNA gene expression in the liver. Results are expressed as a ratio to β-actin mRNA level. The mRNA levels of control rats were arbitrarily set at 1, **, p < 0.01
2.4 低剂量率中子-γ射线混合照射后大鼠肝细胞中调控CYP7A1基因的核受体mRNA表达的变化
如图6所示,在照射14 d (γ射线累积照射剂量为0.4676 Gy、中子累积照射剂量为7.84 mGy)后,PPARα基因mRNA表达上调至空白对照组的1.45倍,FXR基因mRNA表达上调至空白对照组的1.14倍,LXRα基因 mRNA表达下调至空白对照组的89%,HNF4α基因mRNA表达下调至空白对照组的95%,PXR基因 mRNA表达上调至空白对照组的1.69倍。在照射31 d (γ射线累积照射剂量1.0354 Gy、中子累积照射剂量为17.36 mGy)后,与空白对照组比较,PPARα基因 mRNA表达上调至空白对照组的1.32倍;FXR基因mRNA表达下调至空白对照组的68%;LXRα基因mRNA表达分别上调至空白对照组的1.40倍;HNF4α基因mRNA表达下调至空白对照组的87%;PXR基因mRNA表达上调至空白对照组的 2.34倍(p<0.01)。统计分析结合实时定量PCR方法,以相对表达变化2倍以上认为有差异,数据表明,受照14 d和31 d后,与空白对照组比较,LXRα、PPARα、HNF4α及FXR基因mRNA相对表达量无明显变化。但是在受照31 d后,与相应的空白对照组比较,混合照射组大鼠肝细胞PXR基因mRNA表达上调非常显著(p<0.01)。
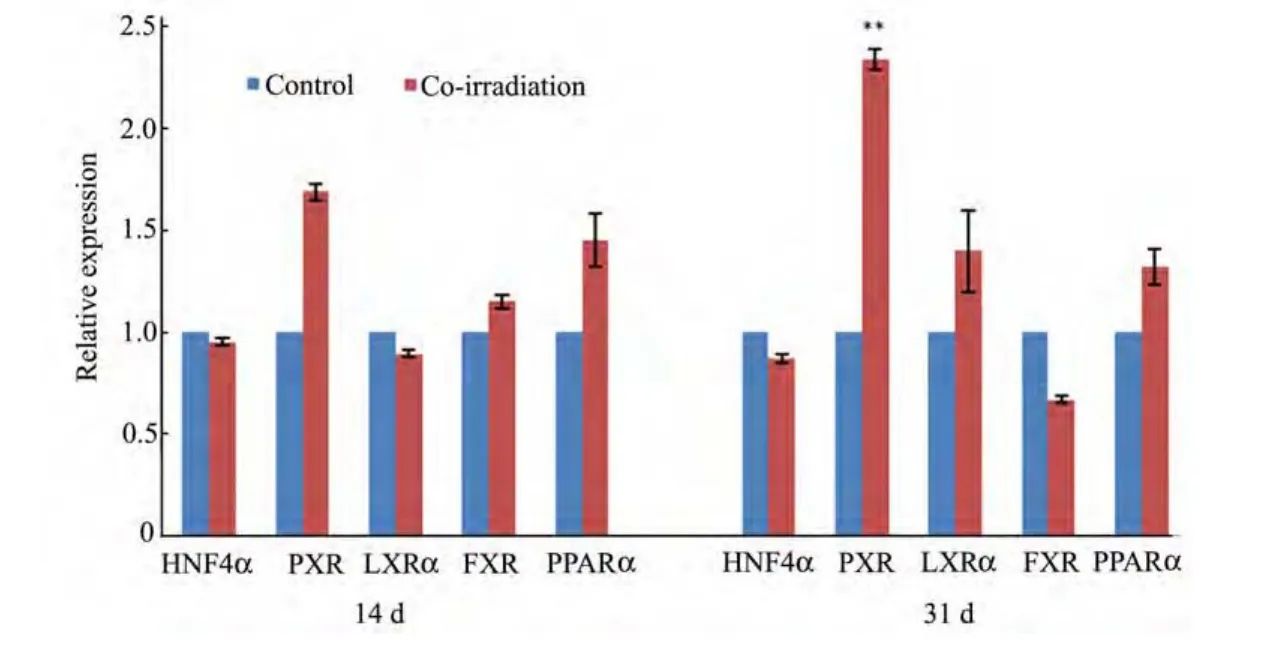
图6 肝脏中调控CYP7A1 基因mRNA 表达的核受体mRNA 相对于内β-actin 参基因mRNA 的表达水平,将空白对照组的各基因mRNA 表达水平设为1, **, p<0.01Fig.6 The mRNA level of the nuclear receptors that could regulate the transcription of CYP7A1 gene in the liver.Results are expressed as a ratio to β-actin mRNA level. The mRNA levels of control rats were arbitrarily set at 1, **, p < 0.01
3 讨论
小剂量低剂量率电离辐射所致的人体效应越来越受到人们的关注。胆固醇代谢作为健康的一部分,它的异常将会导致疾病的发生,比如胆石病[8]。对于小剂量电离辐射对胆固醇代谢造成的影响,国内外进行的研究相对较少,尤其是低剂量率中子-γ射线混合照射研究。本文主要研究了在低剂量率中子-γ射线混合照射下肝脏胆固醇转化为胆汁酸的主要限速酶CYP7A1基因mRNA表达的变化。研究发现:在照射14 d (γ射线累积照射剂量为0.4676 Gy、中子累积照射剂量为7.84 mGy)和31 d (γ射线累积照射剂量为1.0354 Gy、中子累积剂量为17.36 mGy)后,混合照射组大鼠肝细胞 CYP7A1基因 mRNA表达分别下调至空白对照组的44% (p<0.01)和22%(p<0.01)。说明低剂量率γ和中子混合照射在照射一段时期内对大鼠肝细胞 CYP7A1 mRNA相对表达水平有着显著的影响。
肝脏胆固醇 7α-羟化酶(CYP7A1)基因 mRNA的表达受各种核受体和转录因子的调控。肝X受体α(LXRα)、过氧化物酶体增值物激活受体α(PPARα)、肝细胞核因子 4α(HNF4 α)都能够刺激上调 CYP7A1基因的转录表达,而法尼醇 X受体(FXR)、孕烷受体(PXR)能够抑制CYP7A1基因的转录表达。肝 X 受体(LXRα)能被配体氧化型固醇激活,并且它能够和维甲酸受体α (RXRα)结合后形成异源二聚体,异源二聚体 LXRα-RXRα将与CYP7A1基因启动子区的siteI位点结合,进而调控CYP7A1基因的转录[9]。Zhang等[10]给野生型和LXRα基因敲除的 C57BL/6J老鼠喂食 LXRα激活剂,发现野生型老鼠CYP7A1基因mRNA表达显著增加,但LXRα基因敲除老鼠观察不到明显变化。研究表明HNF4α是CYP7A1基因的重要调控因子,它能够与位于CYP7A1基因启动子区胆汁酸响应元件II(BAREII)的DR-1序列结合,进而促进CYP7A1基因的转录。另外,如果HNF4α结合位点发生突变,CYP7A1基因启动子活性将会显著下降,表明HNF4α对于 CYP7A1基因转录的基本水平至关重要[11]。Cheema等研究发现,PPARα被配体激活后,能够与 RXRα结合形成 PPARα-RXRα二聚体,PPARα-RXRα能够与CYP7A1启动子区siteI位点结合,进而调控CYP7A1基因的转录[12]。石如玲等[13]通过邻苯二甲酸二异辛酯激活大鼠PPARα的表达,发现肝脏中CYP7A1基因表达加强。Cao等[14]研究发现黄连生物碱提取物能够通过上调CYP7A1基因正向调控因子PPAR α表达,而使CYP7A1基因表达上调,最终导致高脂质膳食的大鼠肝脏中胆固醇浓度降低。FXR能够通过 FXR-SHP、FXR-FGF15途径来抑制 CYP7A1基因的转录。肝同系物受体1(LRH-1) 是促进 LXRα激活 CYP7A1基因转录的辅助因子[15]。在肝脏中,胆汁酸能够激活FXR,而后 FXR调控异源二聚体小分子伴侣(small heterodimer partner,SHP)转录,SHP会和LRH-1结合成异源二聚体,导致CYP7A1基因启动子募集的辅助激活因子减少,CYP7A1基因转录下降。另外,FXR被激活后,大鼠纤维母细胞生长因子FGF15的分泌和表达将增加,而FGF15将与FGFR4结合,从而激活JNK途径,使CYP7A1基因的转录表达受到抑制[16]。与正常小鼠相比,PXR基因敲除的小鼠CYP7A1基因的表达减少近2倍。另外,对小鼠喂食 PCN后,发现它能够显著抑制 CYP7A1基因mRNA的水平[17]。但是PXR基因敲除的小鼠,PCN对其CYP7A1基因表达的抑制作用将失效。故PXR能够通过减少其基础表达和抑制其表达两方面使CYP7A1基因表达失调[18]。Jonker等[19]研究发现PXR能够抑制CYP7A1基因的转录,使PXR能够成为治疗胆固醇代谢异常疾病的靶标。
为了研究实验对照组 CYP7A1 mRNA变化可能机制,我们同样运用了实时定量 PCR法检测了LXRα、PPARα、HNF4α、FXR、PXR基因mRNA的相对表达水平,通过数据分析发现混合照射组LXRα、PPARα、HNF4 α、FXR 基因 mRNA 的表达水平相对于空白对照组无明显变化。但是在照射14 d后,混合照射组大鼠肝细胞PXR基因mRNA表达上调至相应空白对照组的1.69倍。在照射31 d后,混合照射组大鼠肝细胞PXR基因mRNA表达上调至相应空白对照组的 2.34倍(p<0.01),有非常显著差异。故CYP7A1 mRNA表达下调可能机制是混合照射在一段时期内上调了其负调控基因 PXR mRNA的表达。
另外,除了各种核受体和转录因子的调控,CYP7A1 mRNA表达水平还受到其它因素的影响。Park等[20]发现对C57BL/6鼠注射胰岛素后,肝细胞SHP基因mRNA表达上升,且胰岛素诱导级联信号通路使胰岛素β细胞转录因子(FOXO1)失活,进而使CYP7A1基因的表达受到抑制。Kim等[21]研究发现在正常和受压状态下,抑癌因子P53都能通过增加SHP量来降低 CYP7A1水平。Henkel等研究发现持续喂食FVB/NJ小鼠胆固醇膳食12周能够诱导肝细胞肿瘤坏死因子α (TNF α)和白介素 1β(IL-1β)表达,而该 2种因子能够通过各自的途径对CYP7A1的表达进行负向调控[22]。对于小剂量的低剂量率中子-γ射线混合照射对CYP7A1基因mRNA表达造成的影响可能是多因素共同作用的,为了更加深入、全面的解释其机制还需进一步研究。
总之,本研究发现低剂量率中子-γ射线混合照射一段时期后,大鼠肝细胞 CYP7A1基因 mRNA表达显著下调,而它的负调控基因PXR基因mRNA表达明显上升。故一定时期内低剂量率中子-γ射线混合照射可能通过显著上调大鼠肝细胞 PXR基因mRNA表达而使肝细胞CYP7A1基因mRNA表达下降。但是肝细胞CYP7A1基因mRNA表达显著下降可能不是单一因素造成的,还有其他因素的共同作用,这一点尚需进一步研究。
1 Wong F L, Yamada M, Sasaki H, et al. Effects of radiation on the longitudinal trends of total serum cholesterol levels in the atomic bomb survivors [J].Radiation Research, 1999, 151(6): 736-746.
2 Shao B, Tang C, Sinha A, et al. Humans with atherosclerosis have impaired ABCA1 cholesterol efflux and enhanced HDL oxidation by myeloperoxidase [J].Circulation Research, 2014, 114: 303-454.
3 Pierrot N, Octave J N. Cholesterol, neuronal activity and Alzheimer disease [J]. Medecine Sciences, 2014, 30(3):244-246.
4 Kosters A, Jirsa M, Groen A K. Genetic background of cholesterol gallstone disease [J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2003,1637(1): 1-19.
5 Rutherford A E, PrattD S. Cholestasis and cholestatic syndromes [J]. Current Opinion in Gastroenterology,2007, 23(3): 232-236.
6 Clayton P T. Disorders of bile acid synthesis [J]. Journal of Inherited Metabolic Disease, 2011, 34(3): 593-604.
7 Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtMethod [J]. Methods, 2001, 25(4): 402-408.
8 Di Ciaula A, Wang D Q H, Bonfrate L, et al. Current views on genetics and epigenetics of cholesterol gallstone disease [J]. Cholesterol, 2013(3): 1-11.
9 Gupta S, Pandak W M, Hylemon P B. LXRα is the dominant regulator of CYP7A1 transcription [J].Biochemical and Biophysical Research Communications,2002, 293(1): 338-343.
10 Zhang Y, Breevoort S R, Angdisen J, et al. Liver LXRα expression is crucial for whole body cholesterol homeostasis and reverse cholesterol transport in mice [J].The Journal of Clinical Investigation, 2012, 122(5): 1688.
11 Stroup D, Chiang J Y L. HNF4 and COUP-TFII interact to modulate transcription of the cholesterol 7α-hydroxylase gene (CYP7A1) [J]. Journal of Lipid Research, 2000, 41(1): 1-11.
12 Cheema S K, Agellon L B. The murine and human cholesterol 7α-hydroxylase gene promoters are differentially responsive to regulation by fatty acids mediated via peroxisome proliferator-activated receptor α[J]. Journal of Biological Chemistry, 2000, 275(17):12530-12536.
13 石如玲, 姜玲玲. 过氧化物酶体增殖剂激活受体α对大鼠胆汁酸合成代谢的影响 [J]. 河北医科大学学报,2005, 26(3): 161-163.SHI Ruling, JIANG Lingling. Effects of peroxisome proliferator-activated receptor α on bile acid biosynthesis in rats [J]. Journal of Hebei Medical University, 2005,26(3): 161-163.
14 Cao Y, Bei W, Hu Y, et al. Hypocholesterolemia of Rhizoma Coptidis alkaloids is related to the bile acid by up-regulated CYP7A1 in hyperlipidemic rats [J].Phytomedicine, 2012, 19(8): 686-692.
15 Oosterveer M H, Mataki C, Yamamoto H, et al.LRH-1–dependent glucose sensing determines intermediary metabolism in liver [J]. The Journal of Clinical Investigation, 2012, 122(8): 2817.
16 Matsubara T, Li F, Gonzalez F J. FXR signaling in the enterohepatic system [J]. Molecular and Cellular Endocrinology, 2013, 368(1): 17-29.
17 Li Y C, Wang D P, Chiang J Y. Regulation of cholesterol 7 alpha-hydroxylase in the liver. Cloning, sequencing, and regulation of cholesterol 7 alpha-hydroxylase mRNA[J].The Journal of Biological Chemistry, 1990, 265: 12012-12019.
18 Kliewer S A, Willson T M. Regulation of xenobiotic and bile acid metabolism by the nuclear pregnane X receptor[J]. The Journal of Lipid Research, 2000, 43: 359-364.
19 Jonker J W, Liddle C, Downes M. FXR and PXR:potential therapeutic targets in cholestasis [J]. The Journal of Steroid Biochemistry and Molecular Biology, 2012,130(3): 147-158.
20 Park W H, Pak Y K. Insulin-dependent suppression of cholesterol 7α-hydroxlase is a possible link between glucose and cholesterol metabolisms [J]. Experimental &Molecular Medicine, 2011, 43(10): 571-579.
21 Kim D H, Lee J W. Tumor suppressor p53 regulates bile acid homeostasis via small heterodimer partner [J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(30): 12266-12270.
22 Henkel A S, Anderson K A, Dewey A M, et al. A chronic high-cholesterol diet paradoxically suppresses hepatic CYP7A1 expression in FVB/NJ mice [J]. Journal of Lipid Research, 2011, 52(2): 289-298.

