烟夜蛾幼虫血淋巴凝集素的理化特性研究
荆 譞, 张利芬, 王雄雅, 白素芬, 李 欣
(河南农业大学植物保护学院, 河南 郑州 450002)
烟夜蛾幼虫血淋巴凝集素的理化特性研究
荆 譞, 张利芬, 王雄雅, 白素芬, 李 欣
(河南农业大学植物保护学院, 河南 郑州 450002)
为了明确烟夜蛾Helicoverpaassulta幼虫血淋巴凝集素的理化性质,采用糖抑制试验和血凝法检测,分别测定了凝集素与不同糖类的结合特性和不同因素对其凝集活性的影响.糖抑制试验结果表明,在选用13种糖类中,不同糖类对凝集素凝集活性的抑制作用不同,其中乳糖、D-半乳糖和L-鼠李糖具有完全抑制作用,说明烟夜蛾幼虫血淋巴凝集素与这3种糖类有专一结合特性.血凝法检测结果表明,不同因素对凝集活性的影响不同,其中烟夜蛾血淋巴凝集素凝集活性依赖于Ca2+,属C型凝集素;反复冻融对凝集素的活性没有影响;但随处理温度的升高或持续时间的延长,其凝集活性下降,在60 ℃处理15 min后凝集活性完全丧失;凝集素在pH 7.17时活性最高;凝集素对经胰蛋白酶修饰后的鸭血红细胞的凝集活性明显增强;血淋巴中酚氧化酶引起的黑化未对其凝集活性产生影响,说明同为体液免疫因子的凝集素与酶氧化酶在昆虫免疫防御中的协同性.
凝集素;理化特性;烟夜蛾
细胞免疫和体液免疫是昆虫拥有的高效免疫防御系统,用以防止微生物或寄生物的入侵.而作为非特异性体液免疫因子的凝集素,是进行“异己”识别,实施免疫监视,启动防御机能,防止异物入侵的首道屏障,在调节细胞与体液免疫及酚氧化酶原激活中发挥重要作用[1].已有研究表明,昆虫凝集素是一类具有特异糖结合活性的蛋白,具有一个或多个可以与单糖或寡糖特异可逆结合的非催化结构域,其生物活性主要通过对糖的专一性识别表现出来,但不同昆虫凝集素专一性结合的糖类不同,生物活性也有差别[2],如黏虫Mythimnaseparata幼虫血淋巴凝集素专一性结合的糖基及其衍生物为乳糖、岩藻糖和神经氨酸,棉铃虫Helicoverpaarmigera和亚洲玉米螟Ostriniafurnacalis均为半乳糖,而家蚕Bombyxmori却不与乳糖或半乳糖结合[3;4].烟夜蛾Helicoverpaassulta是重要的农业害虫,研究发现,其蛹凝集素与近缘种棉铃虫蛹的糖结合特性也不完全相同,且在个体发育的不同阶段表现出不同的活性,以幼虫期活性最高,估计与幼虫期取食有关,因防御食物中可能存在的病原物、毒素或次生代谢物质等的需要,使得幼虫期比其他发育阶段保持有较高的凝集素水平[5].深入研究烟夜蛾幼虫血淋巴凝集素的糖结合特性、凝集素类型及其理化特性等,对于揭示烟夜蛾免疫防御机理和实施有效防控等具有重要意义.因此,本研究采用糖抑制试验和血凝反应,对烟夜蛾幼虫血淋巴凝集素的理化特性进行了广泛研究,以期为该类凝集素的分离、纯化及丰富昆虫凝集素资源,深入探讨昆虫免疫系统的进化等奠定基础.
1 材料与方法
1.1昆虫饲养
在郑州郊区烟田采集烟夜蛾卵,带回室内接种于人工饲料上.放置在(27±1)℃,光周期16L:8D,相对湿度60%~80%的人工气候培养箱中,饲养至3龄幼虫初期后单头分开饲养至5龄.
1.2凝集活性测定
取烟夜蛾5龄幼虫收集血淋巴液,加入预先滴有少量苯基硫脲的冰浴离心管中,在4 ℃,12 000 r·min-1离心10 min,取上清液即血浆于-20 ℃保存.采集新鲜的鸭血放入加有抗凝剂的离心管内,用PBS冲洗3次,用PBS稀释沉淀物并调至体积分数为0.5%,4 ℃保存.参照OLUSOLA等[6]的方法,在96孔V型板上进行血凝反应.以使红细胞凝集活力的最大稀释倍数为该凝集素样品的凝集活力,记为2n(n为倍比稀释的次数),以PBS作空白对照.
1.3血凝糖抑制试验
选用D-半乳糖、D-葡萄糖、D-果糖、N-乙酰葡萄糖胺、L-岩藻糖、L-阿拉伯糖、L-鼠李糖、L-山梨糖和甘露糖9种单糖,蔗糖、乳糖、麦芽糖和海藻糖4种双糖,分别用PBS磷酸缓冲溶液配制0.3 mol·L-1的糖溶液,参照朱呈智等[3]的方法进行糖抑制试验.
1.4不同因素对凝集活性的影响
1.4.1 EDTA和金属离子影响的测定 将制备的15 μL烟夜蛾血浆倍比稀释后,分别加入15 μL用PBS配制的10 mmol·L-1EDTA溶液,受EDTA抑制的血浆分别加入30 μL的0.1 mol·L-1的CaCl2,FeCl3·6H2O,KCl,MgCl2·6H2O溶液,测定凝集活性.
1.4.2 冻融循环影响的测定 将血浆样品放入离心管中,在-20 ℃下保存30 min,然后将样品移入15 ℃的水浴中处理15 min,使其融解.在同样的条件下进行2,4,8,10,12,16,18,20,24个重复的冻融循环,随后加入体积分数0.5%的鸭血红细胞悬浮液测定活性.
1.4.3 热稳定性测定 将血浆分别于25,37,60 ℃下处理15,60,120 min,以新鲜制备的血浆样品为对照,测定各样品的凝集活性.
1.4.4 pH值影响的测定 用磷酸氢二钠-柠檬酸、磷酸氢二钠-磷酸二氢钾、磷酸氢二钠-氢氧化钠3种缓冲溶液,将血浆样品的pH值调至2.2,3.0,4.0,4.92,6.24,7.17,8.34,8.67, 10.0,在4 ℃密封容器中放置2 h,然后将溶液的pH值调至7.4,测定其凝集活性.
1.4.5 胰蛋白酶影响的测定 取胰蛋白酶(3 U·mg-1)(Sigma公司产品),用0.01 mol·L-1PBS磷酸缓冲液配制成质量分数0.25%的胰蛋白酶工作液.然后用该酶液修饰鸭血红细胞,即在37 ℃温育15 min,在2 500 r·min-1下离心10 min,弃上清液,用0.01 mol·L-1PBS磷酸缓冲液洗涤3次,以未经胰蛋白酶修饰的鸭血红细胞作为对照,分别测定样品的凝集活性.
1.4.6 酚氧化酶影响的测定 取烟夜蛾5龄幼虫的血淋巴,在冰浴条件下分别放入有或无少量苯基硫脲的离心管中,分别测定凝集活性.
2 结果与分析
2.1糖专一结合特性
通过糖抑制试验比对供试糖类对烟夜蛾幼虫血淋巴凝集素凝集活性的抑制作用,得到表1结果.从表1可以看出,D-半乳糖、L-鼠李糖和乳糖对烟夜蛾幼虫血淋巴凝集素的凝集活性有完全抑制作用,L-阿拉伯糖、D-果糖、蔗糖、麦芽糖和山梨糖的抑制程度依次降低,而D-葡萄糖、N-乙酰葡萄糖胺、L-岩藻糖、甘露糖和海藻糖则完全没有抑制作用.说明烟夜蛾幼虫血淋巴凝集素具有与半乳糖、乳糖和鼠李糖专一结合的特性.

表1 13种糖对烟夜蛾幼虫凝集素凝集活性的抑制作用Table 1 Inhibition effects of thirteen carbohydrates onthe hemagglutinating activity of the larval lectinsfrom H. assulta
注:“-”无凝集活性.下同。
Note: “-” means no hemagglutinating activity. The same as below.
2.2凝集素类型
烟夜蛾血淋巴凝集素对鸭血红细胞的凝集活性很大程度受到EDTA的抑制.加入EDTA后,EDTA能够螯合金属离子,从而抑制依赖于金属离子的凝集素的凝集活性,使得其凝集作用减弱(图1).其中Ca2+,Fe3+和Mg2+都能使烟夜蛾血淋巴凝集素的凝集活力恢复,而K+,Na+没有恢复能力,说明烟夜蛾血淋巴凝集素产生凝集作用时需要Ca2+,或Fe3+和Mg2+的参与,而不需要K+和Na+.烟夜蛾血淋巴凝集素凝集活性依赖Ca2+,表明其属C型凝集素.
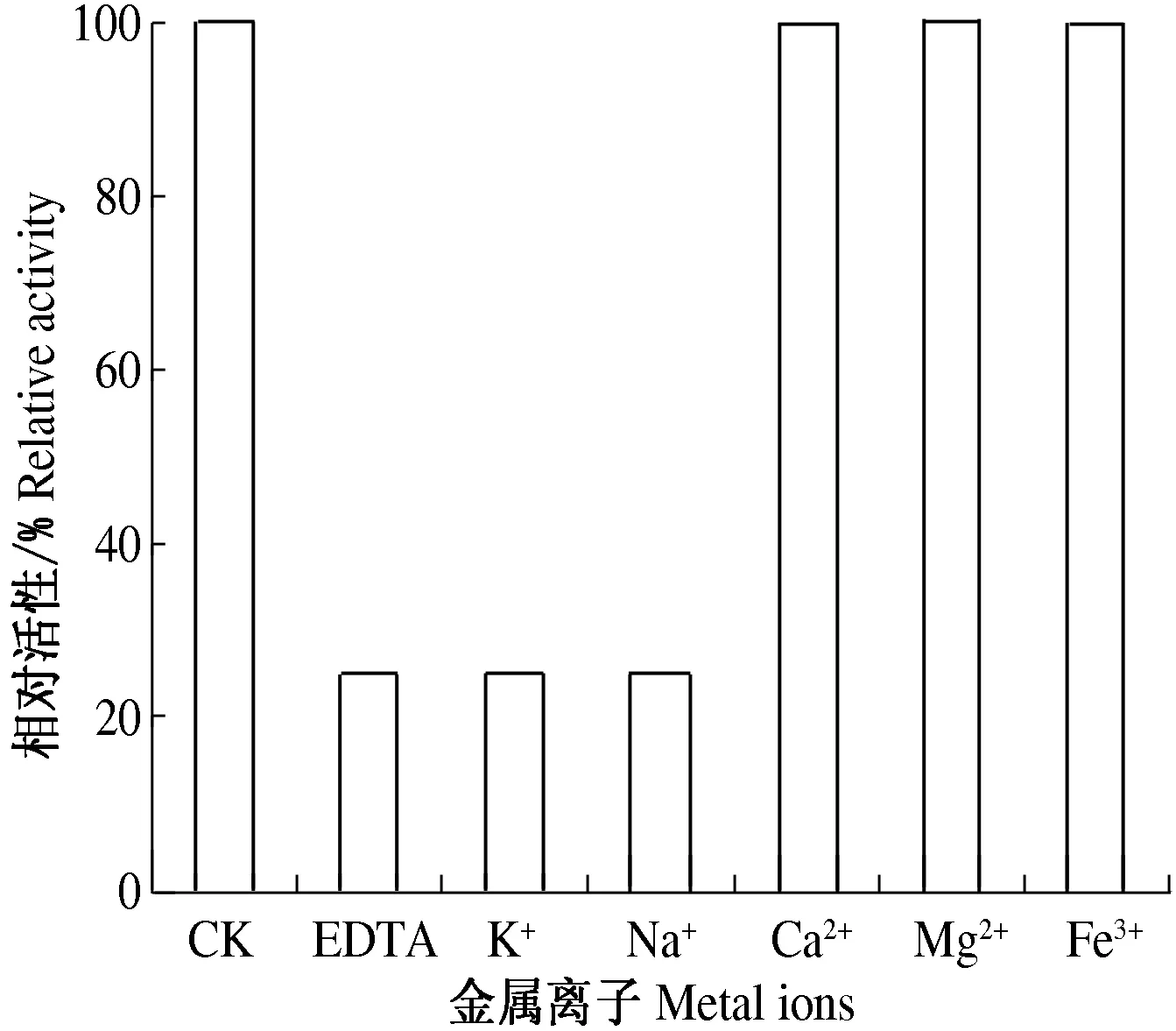
图1 金属离子对烟夜蛾凝集素凝集活性的影响Fig.1 Effects of metal ions on the hemagglutinatingactivity of H. assulta lectins
2.3反复冻融对凝集素活性的影响
依次经过2,4,8,10,12,16,18,20和24个冻融循环处理的烟夜蛾血淋巴与未经冻融处理的血淋巴样品均能引起鸭血红细胞发生凝集,并且凝集活力相当,均为24,说明经过反复冻融循环后,烟夜蛾血淋巴凝集素的凝集活性保持稳定.
2.4温度对烟夜蛾血淋巴凝集素凝集活性的影响
不同温度处理和持续时间对烟夜蛾凝集素凝集活性的影响见表2.从表2可以看出,血淋巴样品随温度的升高和处理时间的延长,其凝素素的凝集活性呈下降趋势.在常温25 ℃下,分别处理15,60,120 min后,其凝集活性相对稳定.37 ℃处理15,60 min后其凝集活性亦无变化,而随着处理时间的延长,达120 min时其凝集活性下降,仅为对照的50%.随着处理温度的升高,血淋巴样经60 ℃处理仅15 min凝集活性便完全丧失,说明烟夜蛾血淋巴凝集素的热稳定性较差.
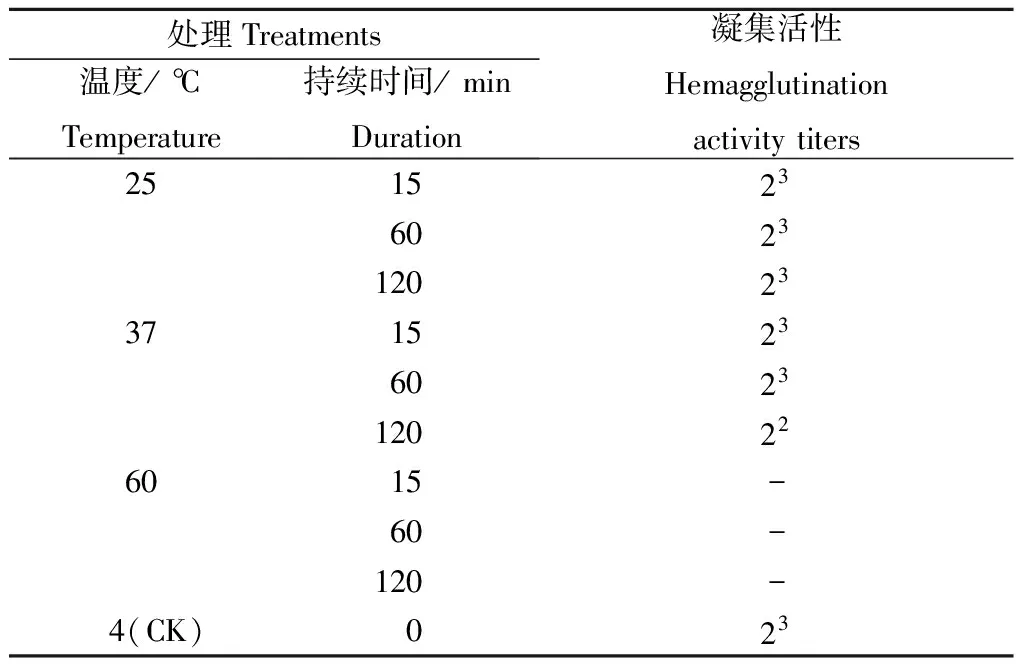
表2 温度对烟夜蛾血淋巴凝集素凝集活性的影响Table 2 Effects of temperature on the hemagglutinatingactivity of lectins
2.5pH值对烟夜蛾凝集素凝集活性的影响
不同pH值对烟夜蛾幼虫血淋巴凝集素活性的影响见表3.从表3可以看出,酸性极高环境使烟夜蛾血淋巴凝集素活性完全丧失.较酸或较碱的环境下凝集素活性均有不同程度的降低.而在中性条件下,保持最强的活性.相比而言,碱性环境对烟夜蛾幼虫血淋巴凝集素活性的影响较酸性环境小.
2.6胰蛋白酶修饰鸭血红细胞后对烟夜蛾凝集素活性的影响
烟夜蛾幼虫血淋巴凝集素对经胰蛋白酶修饰后的鸭血红细胞的凝集作用显著增强(表4),凝集活性提高了15倍.显然,正常鸭血红细胞表面的凝集素受体因受到细胞膜外周蛋白或者糖肽的遮掩,一定程度上抑制了该受体与烟夜蛾血淋巴凝集素的结合,而当这些糖蛋白被胰蛋白酶水解后,被覆盖的糖基受体暴露出来,与相应的凝集素结合,引起细胞凝集.因此,鸭血红细胞经胰蛋白酶修饰后使与烟夜蛾凝集素的凝集作用显著提高.
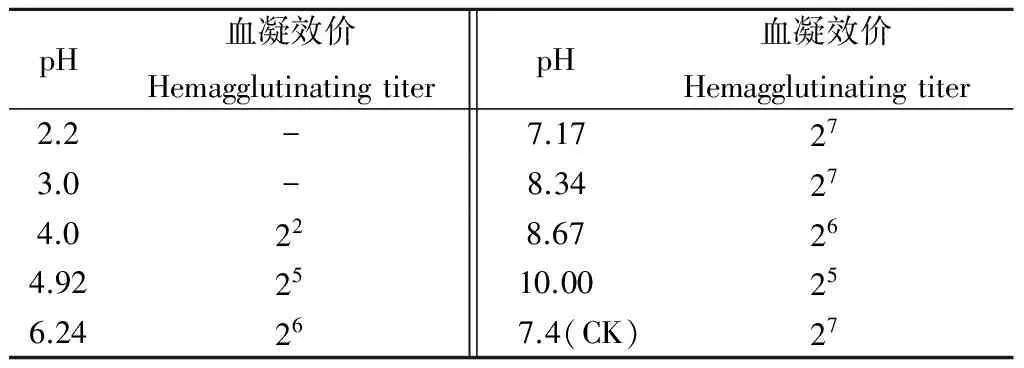
表3 不同pH值对烟夜蛾凝集素凝集活性的影响Table 3 Hemagglutinating activities ofH. assulta at different pH

表4 胰蛋白酶修饰鸭血红细胞后对凝集素活性的影响Table 4 The hemagglutination activity titers of H. assultalectins to duck erythrocyte treated with trypsin
2.7血淋巴酚氧化酶的影响
冰浴条件下,未加入苯基硫脲的烟夜蛾血淋巴样品因酚氧化酶的作用很快发生黑化,而预先加入苯基硫脲的血淋巴样品的黑化则受到抑制,2种情形下均能引起鸭血红细胞发生凝集反应,且凝集效价均为27.由此说明,血淋巴中酚氧化酶的存在并不影响烟夜蛾血淋巴凝集素的凝集活性.
3 结论与讨论
3.1烟夜蛾幼虫血淋巴凝集素糖专一结合特性
明确凝集素的糖专一结合特性,是研究凝集素特性的重要内容.作为一种糖结合蛋白,不同凝集素结构域中结合不同糖链的特性,使其能够识别糖蛋白或糖脂,特别在识别和结合外源微生物的细胞壁或细胞膜中复杂碳水化合物中发挥重要作用.已有的研究表明,棉铃虫血细胞凝集素Halectin拥有2个串联排列的不同碳水化合物识别结构域CRD1和CRD2,其中CRD1因含有EPD模体能结合甘露糖、半乳糖和脂多糖3种糖,CRD2因含有EPN模体具有比CRD1更宽的碳水化合物结合谱,能结合10种糖,包括木糖、甘露糖、半乳糖和麦芽糖等[7].家蝇Muscadomestica幼虫和蛹的凝集素相对分子量分别为38 kD和80 kD,均能特异性结合D-半乳糖,同属于S型凝集素,对兔红细胞均具有明显凝集作用[8; 9].烟草天蛾Manducasexta幼虫凝集素IML-2具有2个糖识别结构域,通过C-末端的识别域进行免疫应答[10].本研究表明,烟夜蛾幼虫血淋巴凝集素具有结合乳糖、半乳糖和鼠李糖的特性,这与大多数已报道的鳞翅目昆虫凝集素具有结合乳糖或半乳糖的特性相一致,表明作为模式识别受体的凝集素在该类群中具有对异物相同的结合位点.
3.2烟夜蛾幼虫血淋巴凝集素是C型凝集素
根据蛋白三维结构以及一级序列的分析结果,将动物凝集素分为4类:钙离子依赖型的C型凝集素、半乳糖结合凝集素、P型凝集素和正五角蛋白凝集素[11],而将巯基依赖型的S型凝集素归为半乳糖结合的凝集素.鳞翅目昆虫的凝集素主要是C型凝集素,目前已从烟草天蛾幼虫中分离纯化出4种凝集素,均为C型凝集素.其中,IML-1参与酚氧化酶原激活,以增强包囊反应,Ca2+在其中起着重要作用[10].棉铃虫C型凝集素在识别微生物表面的糖分子后,通过激活体内免疫系统来清除入侵的微生物[7].本研究得出的烟夜蛾幼虫血淋巴凝集素同属C型凝集素,其具体功能有待进一步研究.
3.3不同因素对烟夜蛾凝集素凝集活性的影响
不同昆虫种类凝集素的理化性质存在很大差异.已报道的谷实夜蛾Heliothiszea凝集素在冻融循环处理后凝集素活性降低,8个冻融循环后凝集素活性降低50%[6].昆虫凝集素作为一种糖蛋白或糖结合蛋白,其蛋白质的活性不仅和它的一级结构有关,更和它的空间构象相关,而在反复的冻融过程中,必定会引起维持蛋白质空间结构的氢键、疏水键的强弱变化,从而引起蛋白质空间构象的变化,而构象一旦变化,可能会对其凝集活性产生影响.而烟夜蛾幼虫血淋巴凝集素经过24个反复的冻融循环后,凝集素活性并未受到影响,这可能是它的空间构象相对稳定所致.昆虫为变温动物,其体内凝集素生理活性的保持与温度变化有密切关系,但不同来源凝集素的热稳定性也不尽相同.本研究测定的烟夜蛾凝集素在60 ℃便丧失了其凝集活性,说明该凝集素的热稳定性差.而亚洲玉米螟幼虫血淋巴经50 ℃处理30 min活性即明显下降,70 ℃仅处理15 min活性完全丧失;家蝇凝集素有一定的热稳定性,经65℃处理其凝集活性保持不变.一般认为,凝集素热稳定性的高低与凝集素的活性位点有关,若活性位点存在于对热敏感的蛋白部分,则热稳定性差;反之,若凝集素的活性位点存在于比较耐高温的糖分子上,则热稳定性就强[12].此外,凝集素在热稳定性方面的差异与凝集素分子的蛋白质与糖的比例和空间分布也有一定关系[13].此外,凝集素活性还受pH值的影响,烟夜蛾凝集素在pH 4~10时均保持有凝集活性,而家蝇凝集素仅在pH 4~8范围内活性稳定,山蝉Cicadaflammata凝集素可在pH 2~13的范围内保持高的凝集活性.详细研究不同昆虫凝集素的理化性质,将有助于凝集素的分离、纯化,为其生理功能的揭示奠定基础.
昆虫依赖凝集素参与异物识别和实施防御机能,而酚氧化酶作为昆虫体内重要的免疫蛋白,在昆虫的体液免疫和细胞免疫中均发挥着极其重要的作用.酚氧化酶与凝集素同为昆虫重要的免疫因子,本研究表明,血淋巴凝集素活性不受酚氧化酶黑化反应的影响,这与黏虫的结果相一致[3],说明二者的存在均不影响彼此功能的发挥,这对于昆虫保持防卫能力具有重要意义.2种免疫因子都可由血细胞合成,凝集素具有激活酚氧化酶原级联反应的作用,酚氧化酶参与黑化反应,是黑色素形成的关键酶,因此,同作为昆虫免疫防御因子,二者功能的互补和协同就显得极其重要.
[1] LING E J, YU X Q. Cellular encapsulation and melanization are enhanced by immulectins, pattern recognition receptors from the tobacco hornworm Manduca sexta [J]. Developmental and Comparative Immunology, 2006, 30: 289-299.
[2] 王长法,张士璀,王昌留. 水生无脊椎动物凝集素研究概述[J]. 海洋科学, 2005, 29(4): 63-68.
[3] 朱呈智, 孙 勇, 程振衡. 粘虫幼虫血淋巴中的凝集素[J]. 昆虫学报, 1992, 35(4): 399-404.
[4] 范金水, 罗志良, 戴开甲. 棉铃虫血淋巴凝集素的性质研究[J]. 武汉大学学报:自然科学版, 1997, 43(6): 781-784.
[5] 张利芬,白素芬,李 欣. 烟夜蛾血淋巴凝集素活性的研究[J], 河南农业大学学报, 2013, 47(3): 313-317.
[6] OLUSOLA A A, CHENG J Q. Distribution, stability and binding specificity of a hemagglutinin in the corn earworm,Helicoverpazea(Lepidoptera: Noctuidae) [J]. European Journal of Entomology, 1997, 94: 167-176.
[7] TIAN Y Y, LIU Y, ZHAO X F, et al. Characterization of a C-type lectin from the cotton bollworm, Helicoverpa armigera [J]. Developmental and Comparative Immunology, 2009, 33: 772-779.
[8] 周明慧, 王春玲, 赵旭荣, 等. 家蝇蛹凝集素的纯化及对巨噬细胞免疫活性的影响[J]. 天津科技大学学报, 2010, 25(3): 5-8.
[9] 曹小红, 霍 哲, 王春玲, 等. 家蝇幼虫凝集素的分离纯化及其抑制MCF-7细胞活性的研究[J]. 天津科技大学学报, 2009, 24(2): 1-4.
[10] YU X Q, KANOST M R. Immulectin-2, a pattern recognition receptor that stimulates hemocyte encapsulation and melanization in the tobacco hornworm,Manducasexta[J]. Developmental and Comparative Immunology, 2004, 28(9): 891-900.
[11] 李春华, 魏晓锋, 李祥瑞. 半乳糖结合凝集素的结构与功能 [J].动物医学进展, 2003, 24(4): 19-21.
[12] 胡新平, 李智恩, 徐祖洪. 海藻凝集素研究进展[J]. 海洋科学, 2000 , 24(8): 34-37.
[13] 许高云, 林 静, 陈寅山, 等. 蚶形无齿蚌(Anodontaarcaeformis)血清、肌肉和生殖腺凝 集素的初步研究[J]. 天然产物研究与开发, 2008, 20(增刊): 43-47.
(责任编辑:蒋国良)
Studyonphysico-chemicalpropertiesofhemolymphlectinsinHelicoverpaassultalarvae
JING Xuan, ZHANG Li-fen, WANG Xiong-Ya, BAI Su-fen, LI Xin
(College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, China)
The physico-chemical properties ofHelicoverpaassultalarval lectins were investigated by comparing the inhibitory activity of thirteen sugars on the hemagglutination of the duck erythrocytes and hemagglutination reaction. The results indicated thatH.assultalectins could bind galactose, lactose, and rhamnose. The effects of different factors The effectson the hemagglutinating activity ofH.assultalectins were different. TheH.assultalectins were found to belong to the C-type (calcium-dependent) lectin family. The hemagglutinating activity was not influenced after repeated cycles of freezing and thawing, but it declined with increasing temperature and duration. All activity was lost at 60 ℃ for 15 min. The lectins had high hemagglutinating activity at pH 7.17. The agglutinin ability increased when duck erythrocytes were treated with trypsin. The hemagglutinating activity of lectins was not affected by the phenoloxidase-induced melanization reaction in the hemolymph. This suggested that lectins and phenoloxidase played synergistic effects in the humoral immune mechanisms of insects.
lectin; physico-chemical property;Helicoverpaassulta
1000-2340(2014)06-0721-05
Q96
:A
2014-03-25
河南省教育厅科学技术研究重点项目(14B210034)
荆 譞,1988年生,男,河南郑州人,硕士研究生,从事昆虫生理生化方面的研究.
白素芬,1968年生,女,山西平遥人,副教授,博士.

