不同分布区山桐子ISSR遗传差异性分析
王艳梅,李 非,蔡齐飞,代 莉,黄 帅,马天晓,刘 震
(1.河南农业大学林学院, 河南 郑州 450002; 2.黄河科技学院, 河南 郑州 450000)
不同分布区山桐子ISSR遗传差异性分析
王艳梅1,李 非1,蔡齐飞1,代 莉1,黄 帅1,马天晓2,刘 震1
(1.河南农业大学林学院, 河南 郑州 450002; 2.黄河科技学院, 河南 郑州 450000)
以江西赣州、南昌、九江,贵州贵阳、遵义,湖南张家界,浙江临安,湖北宜昌,四川成都、广元、重庆,河南洛阳12个分布区的山桐子叶片为材料,对山桐子的遗传差异进行分析.结果表明:(1)用选出的10个引物对12个分布区共110个DNA样品进行PCR扩增,共扩增出92条重复性高、清晰的条带,扩增片段相对分子质量为200~2 500,平均每个引物扩增位点为9.2个,各引物扩增出的条带数为6~11条,其中多态性位点85个,多态性比率为87.5%~100%,平均多态性比率为92.91%;(2)12个分布区山桐子的遗传多样性存在一定差异.其中Nei基因多样性指数(H)和Shannon指数(I)所表现的山桐子12个分布区种群遗传多样性规律一致,其顺序依次为:广元>重庆>赣州>成都>张家界>宜昌>遵义>九江>洛阳>贵阳>临安>南昌;(3)山桐子分布区间与分布区内都产生了显著的遗传分化(P<0.001),且主要在分布区内,占变异成分的78.01%,基因流Nm为0.8521,Nm<1;(4)不同分布区之间的遗传一致度为0.723 6~0.980 6,UPGMA聚类显示,当相似系数为0.868时,可聚为3类,九江为1类,赣州为1类,其余10个分布区为1类,进行遗传距离与地理距离相关性分析,显著水平P>0.05.
山桐子;遗传差异;ISSR
山桐子含油率高,其油既可以食用,也可以制造生物质柴油,是重要的生物质能源,被誉为“美丽的树上油库”,具有较高的绿化、美化、观赏性及重要的经济价值,且具有广阔的应用前景,开发应用潜力巨大.近年来,山桐子作为重要生物质能源树种越来越引起人们的重视.刘震等[1]研究了不同种源山桐子的休眠特性,把树木冬休眠类型重新划分为北方系冬休眠类型、南方系冬休眠类型以及红润类型;祝志勇等[2, 3]研究了山桐子种子发芽率及果实含油率和脂肪酸组分的变化.钱学射等[4,5]研究发现,取果浸于碱水法发芽率最高达到20%,也对毛叶山桐子种子、果实含油量及油脂成分进行了测定与分析.梁珍海等[6]研究了日本山桐子引种育苗及苗期生长规律.杨幼林等[7]研究了毛叶山桐子果实不同发育期的含油率;吴志文等[8]对山桐子的研究进展及应用前景进行了分析;岁立云等[9]对山桐子果实性状的自然变异及类型划分进行了研究.但山桐子多为野生,人为干扰严重,导致宝贵的野生资源正在流失.ISSR标记(inter-simple sequence repeat)是ZIETKEIWITCZ等[10]在SSR技术基础上改进并提出了一种用来检测简单重复序列间的多态性分子标记技术,即简单重复序列间扩增(inter-simple sequence repeat).ISSR标记是一种多态性和信息量丰富的分子标记技术,为显性标记,呈孟德尔遗传规律,而且PCR扩增的稳定性及多态性都很好,是一种非常理想的分子标记.ISSR标记由于引物较长,退火温度较高,增强了试验的可靠性和可重复性,不需要预先知道被分析基因组DNA的序列信息,简化了引物设计的过程,ISSR 可以提供更多的多态性信息.与RFLP,AFLP相比,ISSR 的DNA用量较少、安全性高、更快捷、更稳定而且成本较低;与RAPD相比,ISSR更可靠,重复性好,能产生更高的多态性,同时更简便易操作;与SSR相比,ISSR引物可在不同物种间通用;近年来,该技术已经广泛的应用到遗传图谱构建、品种鉴定、基因定位、植物基因组作图、遗传多样性分析等研究[11~14].本研究利用ISSR标记分析不同分布区山桐子的遗传变异,对进一步开展山桐子种质资源的收集、保存、分析评价及良种选育研究工作具有重要意义.
1 材料和方法
1.1试验材料
本研究以赣州、贵阳、遵义、南昌、张家界、九江、临安、宜昌、成都、广元、重庆、洛阳12个分布区(表1)自然分布的山桐子幼嫩叶片为材料(由于在自然分布状况下山桐子的繁殖率低,很少出现大片的山桐子林,所以采样按尽可能多的数目来采集).用高压灭菌的去离子水将样品冲洗干净后,电子天平秤其质量,每1 g放入标记好的自封袋里,置于-80 ℃的冰箱里保存备用.
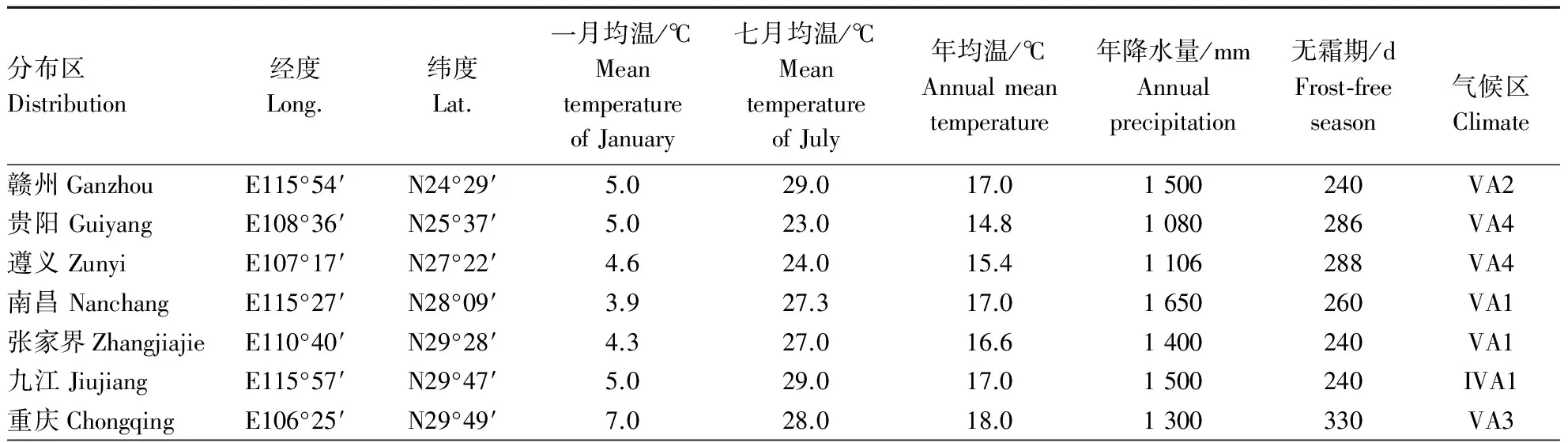
表1 不同分布区位置与气候条件Table 1 The position and climate of different distribution
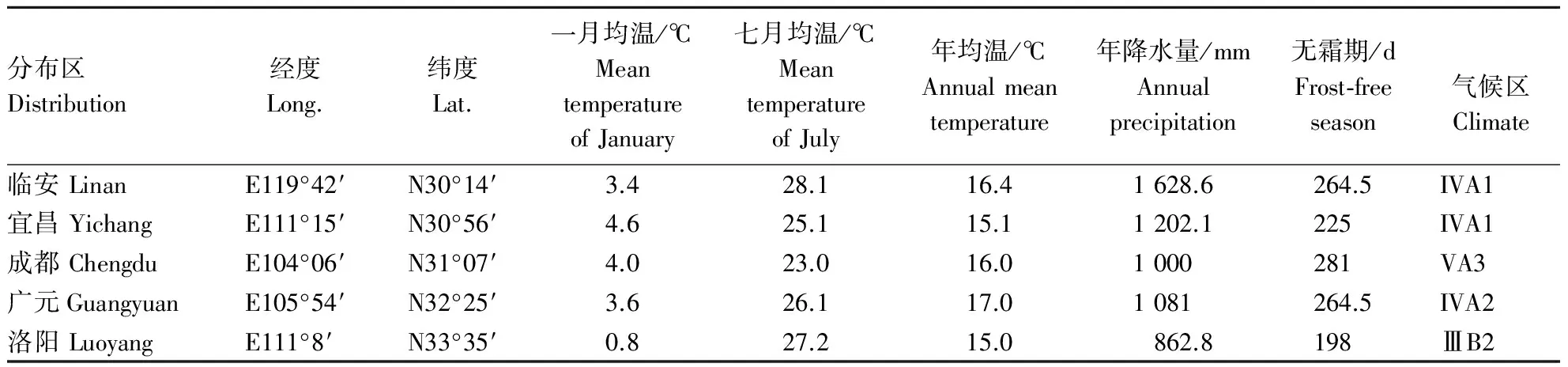
续表1 continuing table
注:VA2:瓯江、闽江、南岭区; VA4:贵州区; VA1:江南区; IVA1:江北区; VA3:四川区; IVA2:秦巴区; ⅢB2:鲁淮区.
Note: VA2:Oujiang、Minjiang、Nanling AREA; VA4:Guizhou AREA; VA1:Jiangnan AREA; IVA1:Jiangbei AREA; VA3:Sichuan AREA; IVA2:Qinba AREA;ⅢB2:Luhuai AREA.
1.2ISSR分析体系
1.2.1 DNA 提取与检测 采用CTAB 法提取高质量的山桐子基因组DNA[15].1%琼脂糖凝胶电泳(北京六一仪器厂, DYCP-31DN) 检测DNA 的完整性, 用紫外分光光度计( Eppendorf Biophotometer 6131) 测定DNA 的质量浓度和纯度.
1.2.2 引物合成及来源 ISSR引物主要由哥伦比亚大学(UBC)公布的引物以及黄文俊等[16,17]发表的引物进行筛选,共10条,由上海生工生物工程技术服务有限公司合成.
1.2.3 ISSR-PCR反应体系及程序 本试验使用已经优化的ISSR-PCR反应体系,25 μL反应体系为:14.8 μL ddH2O, 2.5 μL Buffer, 1.5 μL Mg2+, 0.5 μL dNTP,0.5 μL引物 ,0.2 μL Tap酶, 5 μL DNA模板(以上药品均来源于上海生工生物工程技术服务公司).PCR扩增反应程序:94 ℃预变性3 min,94 ℃变性30 s,58 ℃ 退火45 s,72 ℃延伸45 s,44个循环,72 ℃终延伸8 min,然后在4 ℃下保存.
1.2.4 扩增产物琼脂糖电泳检测 用1%琼脂糖凝胶电泳进行检测,在凝胶成像系统观察并记录谱带.
1.2.5 数据分析 用WD-9413A凝胶成像系统进行拍照,并统计条带,采用人工读带法,根据条带的迁移率和有无记录二元数据,有带记为1,无带记为0,排除模糊不清的带和无法准确标志的带,而后排列成矩阵.利用NTSYS 2.10软件进行数据分析,采用POPGENE 32计算种群遗传多样性和遗传分化等指数,采用AMOVA 1.55软件进行种群遗传变异分析.
2 结果与分析
2.1ISSR-PCR扩增结果
10条引物对12个分布区共110个DNA样品进行PCR扩增,共扩增出92条重复性高、清晰的条带,扩增片段相对分子质量为150~2 500,平均每个引物扩增位点为9.2个,各引物扩增出的条带数为6~11条,其中多态性位点85个,多态性比率为87.5%~100%,平均多态性比率为92.91%(表2).图1-图4为部分引物扩增的ISSR 标记琼脂糖凝胶电泳图.
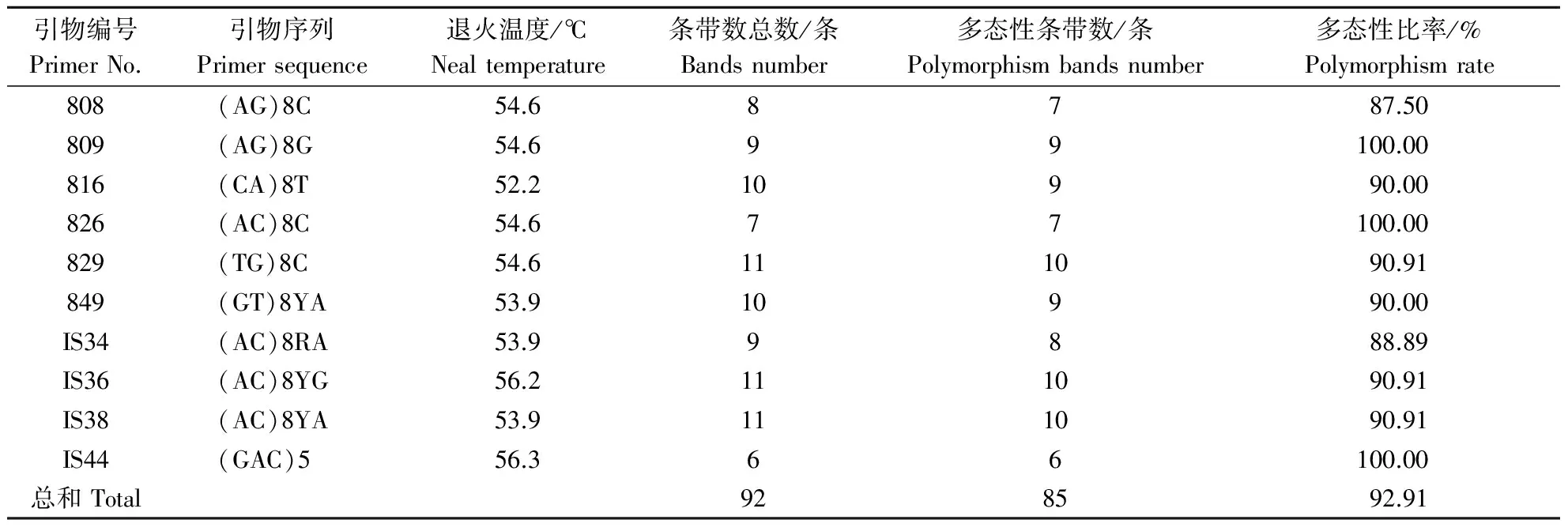
表2 10个ISSR引物扩增条带数与多态性比率Table 2 Amplified bands number and polymorphism rate of the 10 ISSR primers
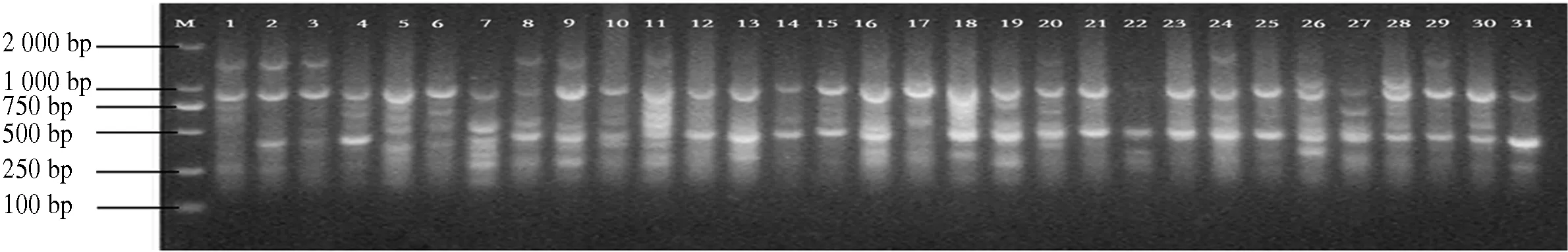
图1 引物829 1-31电泳通道的扩增结果Fig.1 The ISSR-PCR pattem using primer 829 1-31
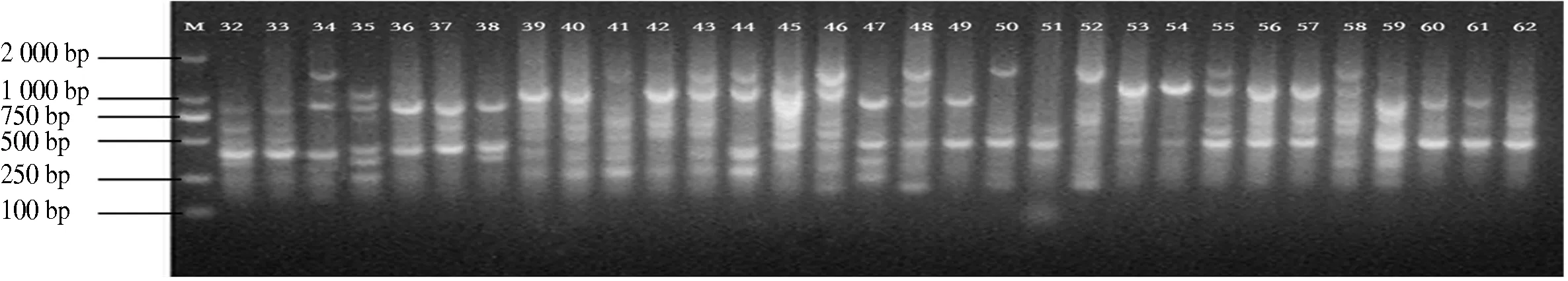
图2 引物829 32-62电泳通道的扩增结果Fig.2 The ISSR-PCR pattem using primer 829 32-62
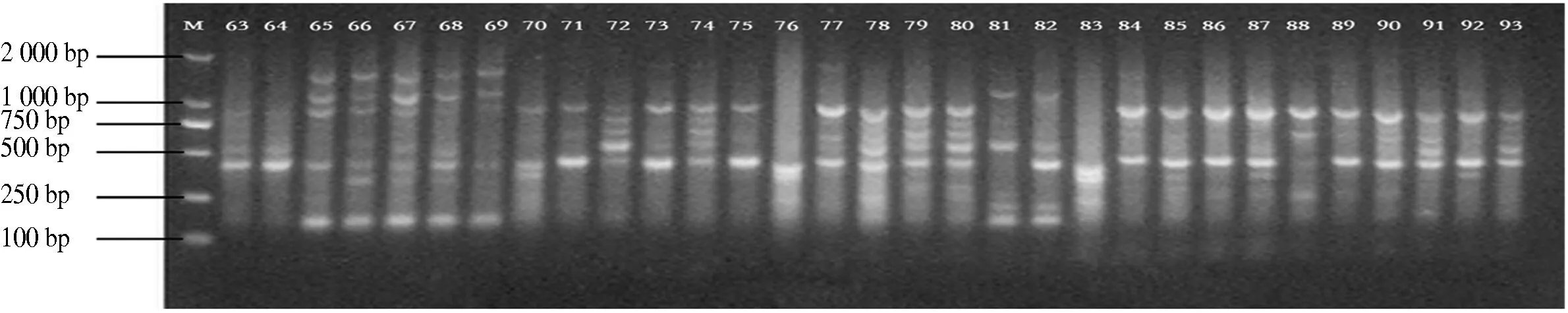
图3 引物829 63-93电泳通道的扩增结果Fig.3 The ISSR-PCR pattem using primer 829 63-93
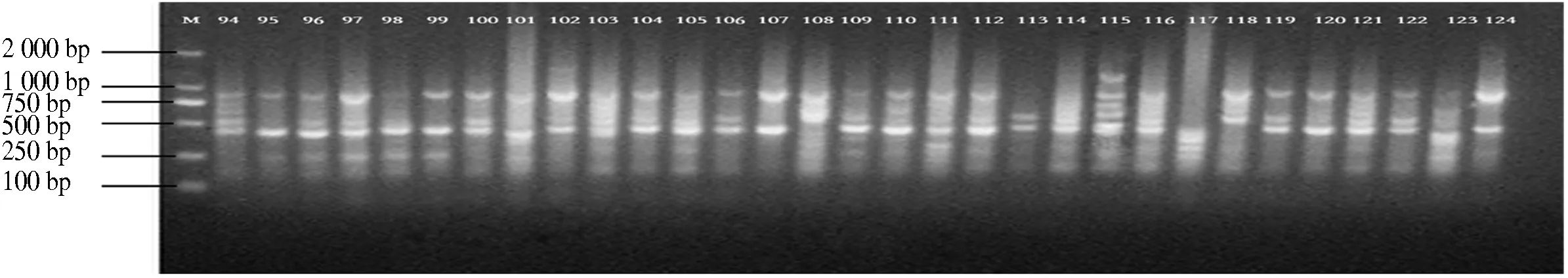
图4 引物829 94-124电泳通道的扩增结果
2.2不同分布区山桐子遗传多样性
用Popgene 32对12个分布区山桐子的遗传多样性进行分析(表3),结果表明,12个分布区山桐子种群间存在一定差异.其中Nei基因多样性指数(H)和Shannon指数(I)所表现的山桐子12个分布区种群遗传多样性规律一致,其顺序依次为:广元>重庆>赣州>成都>张家界>宜昌>遵义>九江>洛阳>贵阳>临安>南昌,与有效等位基因数Ne的结果略有不同,多态位点百分率(P)和等位基因数(Na)的评价结果为:广元>重庆>张家界>成都>宜昌>赣州>遵义>洛阳>九江>临安>贵阳>南昌.但总体来看,位于山桐子分布中心区的广元、重庆、张家界、成都、宜昌有较高的遗传多样性,而位于分布区边缘的赣州、遵义、洛阳、九江、贵阳、临安南昌种群遗传多样性偏低.但没有随纬度的变化而呈现出有规律的变化.
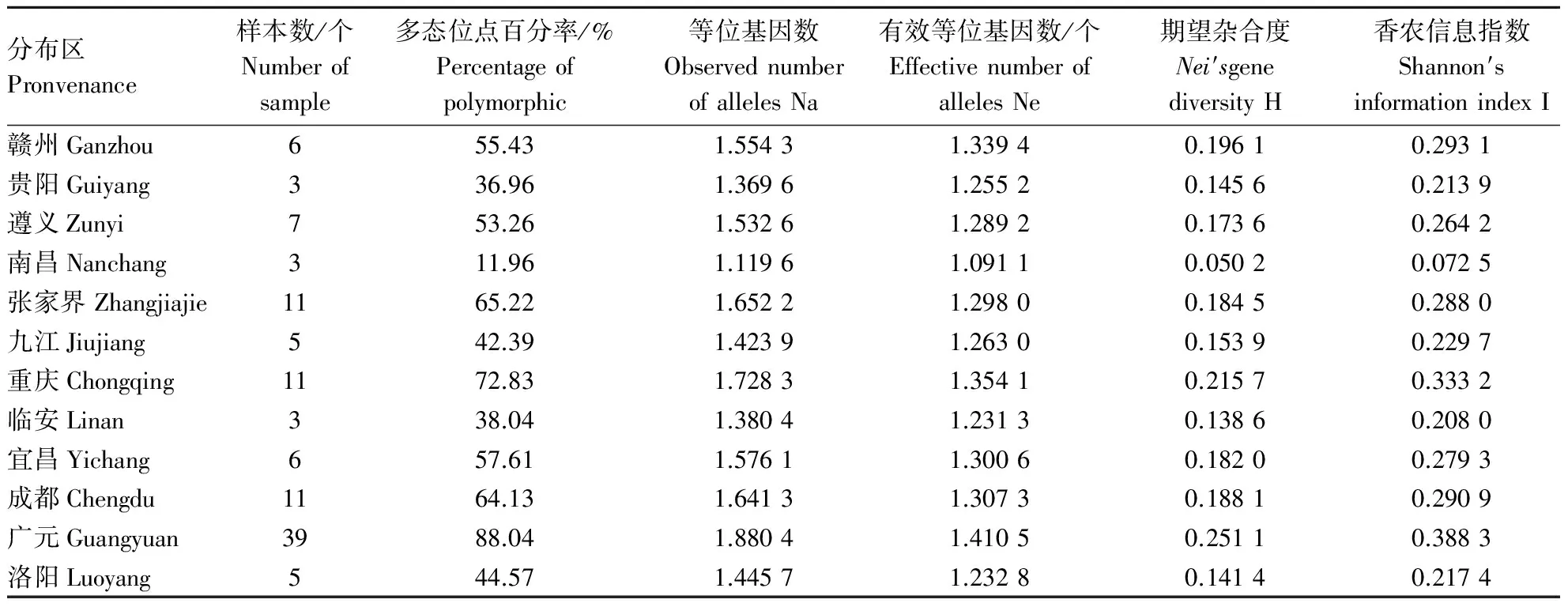
表3 不同分布区山桐子遗传多样性Table 3 Genetic diversity in Idesia polycarpa from different provenances
2.3不同分布区山桐子种群遗传分化
用Popgene 32计算出总遗传多样性Ht值为0.002 1~0.499 8,平均值为0.267 2,群体内遗传多样性Hs值为0.000 0~0.371 1,平均值为0.168 4,群体间遗传多样性Dst(Dst=Ht-Hs)为0.098 8,基因分化系Gst的变动范围较大,平均值为0.369 8,基因流Nm为0.852 1(表4),WRIGHT[18]认为:当Nm>1时,基因流可以防止由遗传漂变而引起的群体间的遗传分化,在本试验中Nm<1,说明种群间基因流动很少.
用AMOVA软件对不同分布区山桐子进行群体遗传变异分析(表5),结果表明,山桐子分布区间与分布区内都产生了显著的遗传分化(P<0.001),山桐子的遗传多样性主要在分布区内,占变异成分的78.01%,只有21.99%的变异存在于不同种群间.说明山桐子的变异主要存在分布区内,分布区间的遗传分化较小.

表4 不同分布区山桐子遗传分化及基因流Table 4 Genetic differentiation and gene flow of Idesia polycarpa from different provenances
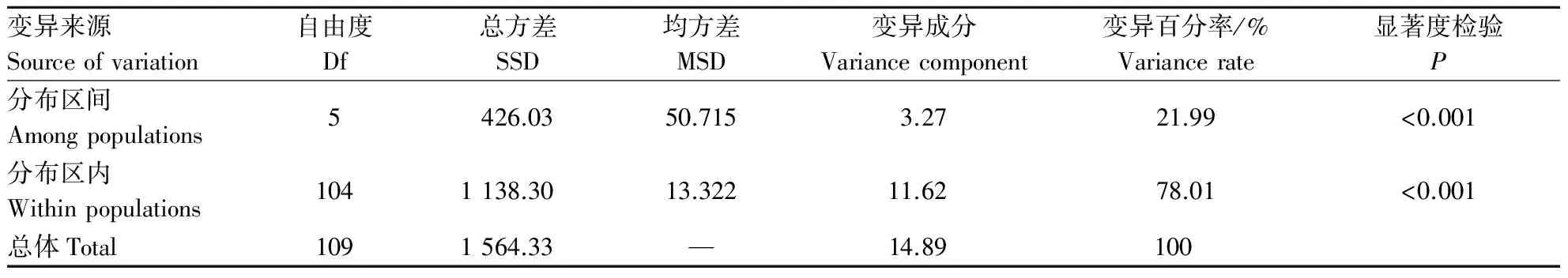
表5 不同分布区山桐子AMOVA分析Table 5 AMOVA analysis of Idesia polycarpa from different provenances
2.4不同分布区山桐子遗传距离与地理距离的相关性
遗传距离和遗传相似度是衡量种群间遗传分化程度最重要的指标.由表6知,不同分布区之间的遗传一致度为0.723 6~0.980 6,说明不同分布区山桐子群体间的相似程度较高.其中重庆和张家界2个分布区的遗传距离最小,为0.019 6,其中南昌和九江2个分布区的遗传距离最大,为0.323 5.山桐子分布区间的遗传距离并没随纬度变化而呈现明显的变化规律.将遗传距离与地理距离做相关性分析,显著水平P>0.05,说明山桐子不同分布区间遗传距离与地理距离没有相关性.
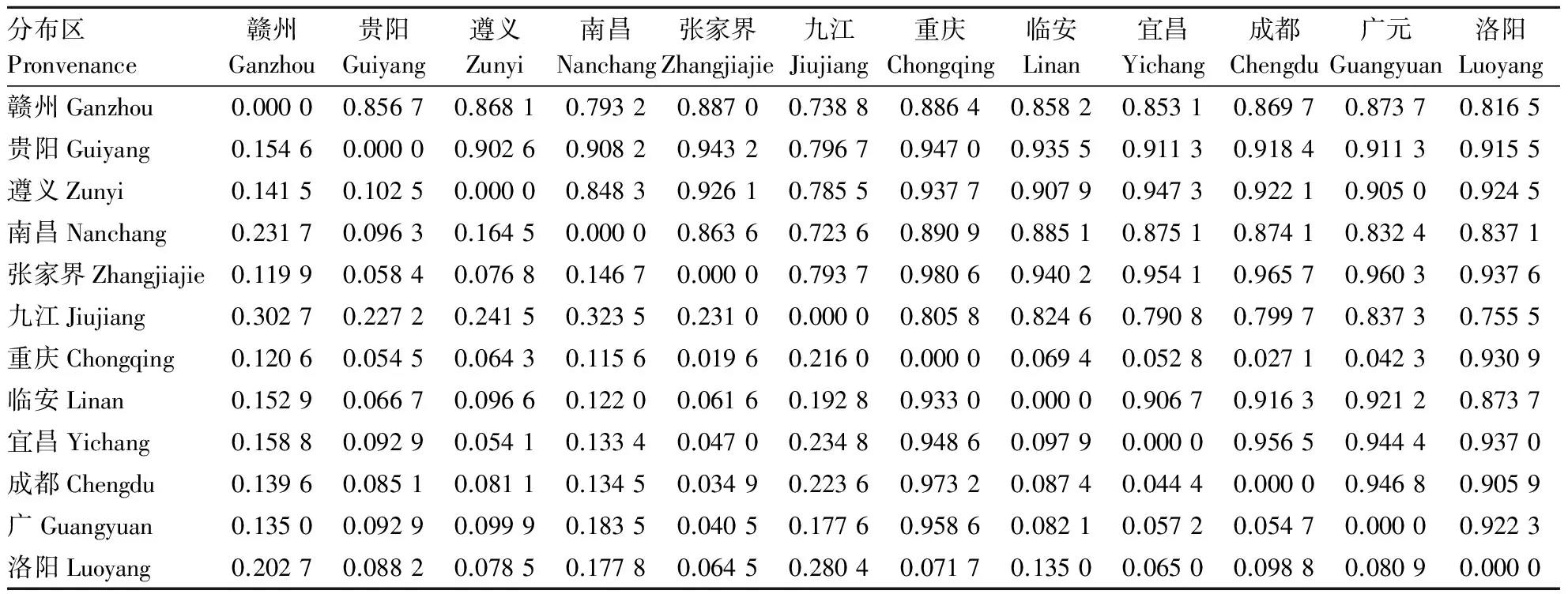
表6 不同分布区山桐子种群Nei遗传距离和遗传一致度Tab.6 Nei′s unbiased measures of genetic identity and genetic distance in Idesia polycarpa from different provenances
注:遗传相似度在右上角,遗传距离在左下角.
Note:Nei′sgenetic identity (above diagonal) and genetic distance (below diagonal).
2.5不同分布区山桐子聚类分析
利用NTSYS软件计算不同分布区山桐子ISSR扩增结果的相似系数,进行UPGMA聚类分析(图5),为山桐子种质资源的保护和品种选育等提供参考与依据.结果表明,当相似系数为0.868时,可聚为3类,九江为1类,赣州为1类,其余10个分布区为1类.
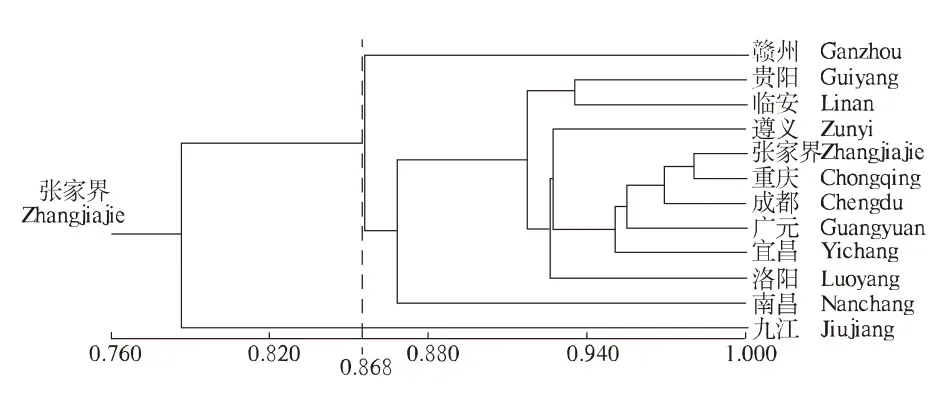
图5 不同分布区山桐子聚类分析 Fig.5 Cluster analysis in Idesia polycarpa from different provenances
3 结论与讨论
10条引物对12个分布区,共110个DNA样品进行了PCR扩增,共扩增出92条重复性高、清晰的条带,扩增片段相对分子量为150~2 500,平均每个引物扩增位点为9.2个,各引物扩增处的条带数为6~11条,其中多态性位点85个,平均多态性比率为92.91 %,有研究发现,双子叶植物多态位点百分率 (P) 平均值为44.8%,长命多年生木本植物多态位点百分率 (P) 值为64.7%,相比而言,山桐子具有较高的遗传多样性水平. 庞广昌等[19]认为,不同种群间遗传变异大小,可以在某种程度上说明该物种对不同环境适应的广泛程度,一般种群间变异越大,该物种适应环境的能力就越强.本研究采用AMOVA对山桐子遗传变异的分布格局进行了分析,结果表明,山桐子在不同分布区间具有显著的遗传分化,说明山桐子具有较强的环境适应能力,同时有良好的产生新突变、适应新环境的基因基础和进化遗传潜力,对山桐子的长期生存与应用推广是有利的.
对12个分布区山桐子的遗传多样性进行分析,结果表明,12个分布区的山桐子种群间存在一定差异.其中Nei基因多样性指数(H)与Shannon指数(I)所表现的山桐子不同分布区遗传多样性规律一致,其顺序依次为:广元>重庆>赣州>成都> 张家界>宜昌>遵义>九江>洛阳>贵阳>临安>南昌,与有效等位基因数(Ne)的结果略有不同,多态位点百分率(P)和等位基因数(Na)的评价结果为:广元>重庆>张家界>成都>宜昌>赣州>遵义>洛阳>九江>临安>贵阳>南昌.但总体来看,位于山桐子分布中心区的广元、重庆、张家界、成都、宜昌有较高的遗传多样性,而位于分布区边缘的赣州、遵义、洛阳、九江、贵阳、临安南昌种群遗传多样性偏低.但是没有随着纬度的变化而呈现出有规律的变化.
用AMOVA软件对不同分布区山桐子进行群体遗传变异分析,结果表明,山桐子分布区间与分布区内都产生了显著的遗传分化(P<0.001),山桐子的遗传多样性主要存在于种群内,种群内的变异占变异成分的78.01%,只有21.99%的变异存在于不同种群之间.说明山桐子的变异主要存在分布区内,分布区间的遗传分化较小.总遗传多样性Ht值为0.002 1~0.499 8,平均值为0.267 2,群体内遗传多样性Hs值为0.000 0~0.371 1,平均值为0.168 4,群体间遗传多样性Dst(Dst=Ht-Hs)为0.098 8,基因分化系数Gst的变动范围较大,平均值为0.369 8,基因流Nm为0.852 1,WRIGHT[18]认为:当Nm>1时,基因流可以防止由遗传漂变而引起的群体间的遗传分化,在本研究中Nm<1,说明种群间基因流动很少.
遗传距离和遗传相似度是衡量种群间遗传分化程度最重要的指标.本研究结果表明,不同分布区之间的遗传一致度为0.723 6~0.980 6,说明不同分布区山桐子群体间的相似程度较高.其中重庆和张家界两个分布区的遗传距离最小,为0.019 6,南昌和九江两个分布区的遗传距离最大,为0.323 5.山桐子分布区间的遗传距离并没随纬度变化而呈现明显的规律变化.将遗传距离与地理距离做相关性分析,显著水平P>0.05,说明山桐子不同分布区间遗传距离与地理距离没有相关性.这与李晓东等[20]对水杉、穆立蔷等[21]对紫椴的研究结果显示遗传距离与地理距离间不存在显著相关性的研究结果相一致;但也与有的学者研究结论不同,如李群等[22]对延龄草的遗传距离和地理距离进行相关性分析,结果表明2者具有一定的相关性.同时也有一些学者研究认为2者相关,李珊等[23]对金钱槭和云南金钱械居群的研究表明,认为2者在大尺度上遗传距离与地理距离相关而在小范围内则没有相关关系.
本研究结果表明山桐子保持着较高的遗传多样性水平,遗传变异丰富.近年来,山桐子作为生物质能源的重要材料,对其人为干扰,使生境遭到破坏,导致宝贵野生资源正在流失.LANDE[24]认为物种濒危的机制主要是栖息地的破坏、环境污染、生境退化和生物资源过度利用,而遗传多样性丧失,更可能是受到干扰的症状而非原因.同时,生长立地条件的破坏和生境退化等造成种群隔离和个体数量减少,从长远来看会减少物种遗传多样性,而种群遗传多样性减少易使种群趋于灭亡[25].因此,对山桐子的保护主要是进行就地保护,保护其现有栖息地,减少人为干扰对其生境的破坏,更好地保护群体的遗传特异性.
[1] 刘 震,王 玲.不同种源山桐子冬芽休眠的温度特性[J].河南农业大学学报,2000,34(3):252-254.
[2] 祝志勇.山桐子生态学特性及繁殖技术研究[D].南京:南京林业大学,2004.
[3] 祝志勇,王 强,阮 晓,等.不同地理居群山桐子的果实含油率与脂肪酸含量[J].林业科学,2010,46(5):176-180.
[4] 钱学射,张卫明,顾龚平,等.燃料油植物山桐子的利用与栽培[J].中国野生植物资源,2008,27(1):16-18.
[5] 钱学射,张卫明,顾龚平,等.燃料油植物毛叶山桐子的利用与栽培[J].中国野生植物资源,2009,28(1):9-11,23.
[6] 梁珍海,蒋泽平,李淑琴,等.日本山桐子引种育苗及苗期生长规律研究初报[J].江苏林业科技,2006,33(4):9-11.
[7] 杨幼林,何立莹.毛叶山桐子果实不同发育期含油率测定简报[J].四川林业科技,1987,10(4):74-75.
[8] 吴志文,谢双喜,刘 青,等.山桐子的研究进展及应用前景[J].贵州农业科学,2010,38(1):161-164.
[9] 岁立云,刘晓敏,李周岐,等.山桐子果实性状的自然变异及类型划分[J].西北农林科技大学学报:自然科学版,2009,(8):115-120.
[10] ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[11] 雷一东,钟 扬.大花红景天的ISSR遗传多样性与精油化学成分多样性研究[D].上海:复旦大学,2004.
[12] 杨 旻.基于ISSR和SRAP的半夏种质资源遗传多样性研究[D].武汉:湖北中医院大学,2010.
[13] 王国霞.古银杏雄株遗传多样性的ISSR分析及花粉用优良单株初步选育研究[D].南京:南京林业大学,2007.
[14] 王佳慧.表型无球少球悬铃木优良单株遗传变异的ISSR及SSR分析[D].郑州:河南农业大学,2013.
[15] 王艳梅,程丽莉,翟明普,等.中国榛属植物DNA提取与SSR初步分析[J].河南师范大学学报:自然科学版,2007,35(2):129-132.
[16] 黄文俊.农杆菌介导不育基因转化悬铃木及长期继代培养植株的遗传稳定性分析的研究[D].武汉:华中农业大学,2007.
[17] 代 莉,蔡齐飞,王艳梅,等,山桐子ISSR-PCR反应体系的建立与引物筛选[J].河南农业大学学报,2013,47(5),548-551.
[18] WRIGHT S.Evolution in Mendelian populations [J]. Genetics,1931,16(2):97-159.
[19] 庞广昌,王 琳,王 宏,等.胡杨群体遗传结构及其与自然环境关系的研究[J].西北植物学报,1992,12(4):295-302.
[20] 李晓东,黄宏文,李建强.孑遗植物水杉的遗传多样性研究[J].生物多样性,2003,11(2):100-108.
[21] 穆立蔷,刘赢男.不同地理分布区紫椴种群的遗传多样性变化[J].植物生态学报,2007,31(6):1190-1198.
[22] 李 群,肖 猛,郭 亮,等.四川省珍稀濒危植物延龄草遗传多样性分析[J].北京林业大学学报,2006,27(4):1-6.
[23] 李 珊,钱增强,蔡宇良,等.金钱槭和云南金钱槭遗传多样性比较研究[J].植物生态学报,2005,29(5):785-792.
[24] LANDE R.Genetics and demography in biological conservation[J].Science(Washington),1988,241(4872):1455-1460.
[25] 张大勇,姜新华.遗传多样性与濒危植物保护生物学研究进展[J].生物多样性,1999,7(1):31-37.
(责任编辑:梁保松)
TheISSRinheritancedifferenceanalysisofIdesiaPolycarpaindifferentdistributionareas
WANG Yan-mei1, LI Fei1, CAI Qi-fei1, DAI Li1, HUANG Shuai1, MA Tian-xiao2, LIU Zhen1
(1.College of Forestry, Henan Agricultural University, Zhengzhou 450002, China; 2.Huanghe Science and Technology College, Zhengzhou 450000, China)
The preliminary inheritance difference analysis was conducted with theIdesiapolycarpaleaves from 12 different distribution areas like Ganzhou, Nanchang, Jiujiang, Guiyang, Zunyi, Zhangjiajie, Lin’an, Yichang, Chengdu, Guangyuan, Luoyang. The main research results are as follows : (1)PCR amplification was conducted with 110 DNA samples from 12 distribution and 10 selected primers. We obtain 92 high repeatable and clear band whose length was between 200 and 2 500. Each primer amplification locus is 9.2 averagely. Each primer gets 6~11 band. There are 85 polymorphic site. The polymorphic percentage was 87.5%~100%.The average polymorphic percentage was 92.91%. (2)Certain difference existed in the genetic diversity of 12 distribution areas. The genetic diversity rule expressed byNeigenetic diversity index(H) and Shannon index(I) was accordant. And the sequence was Guangyuan>Chongqing>Ganzhou>Chengdu>Zhangjiajie>Yichang>Zunyi>Jiujiang>Luoyang>Guiyang>Lin’an>Nanchang ; (3)The prominent genetic differentiation (P<0.001) was produced in distribution interval and distribution areas, but mainly in distribution areas (78.01% of the total.) .The gene flowNmwas 0.8521<1;(4)The genetic consistency was 0.723 6~0.980 6. By UPGMA clustering when the similarity coefficient was 0.868 we could classify the 12 distribution areas into three classes: Jiujiang, one class, Ganzhou, another class, and the remaining 10 the third class. The correlation analysis between the genetic distance and the geographical distance was conducted, with significance level atP>0.05.
Idesiapolycarpa; genetic difference; ISSR
1000-2340(2014)06-0706-07
S792
:A
2014-06-12
林业行业专项项目(201204806)
王艳梅,1978年生,女,河南信阳人,副教授,博士,从事树木生理生态方面的研究.
刘 震,1964年生,男,河南沈丘人,教授,博士.

