探讨酶学参考方法在室间质评中的应用*
李 云,黄宪章,郑松柏,韩丽乔,曹永坚,徐建华,林 莉,李有强,庄俊华,王建兵
(广州中医药大学第二临床医学院检验科,广州510120)
临床检验中心室间质评的目的是实现不同实验室间的检测结果一致和准确,但其室间质评的靶值采用所有实验室测量结果去除离群值后的均值,允许范围要求也较宽泛;而参考方法具有较小的不确定度,可以直接溯源至国际单位[1]。本实验以参考方法作为参比系统,与其他常规系统同时检测临床检验中心2012年第1次室间质评样本和患者血清,其他常规系统都与参考方法比对,探讨酶学参考方法在常规化学室间质评应用中的可行性,现报道如下。
1 材料与方法
1.1 仪器与试剂 (1)仪器:HITACHI U-3310紫外可见分光光度计;HAMILTON ML530B稀释配液仪;Fluke点式温度计;Eppendorf Research型移液器;JULABO-ED19型恒温水浴箱;Sartorius CP225D十万分之一分析天平;Sartorius DOCU-PH 计;IKA RH-KT/C 加 热 磁 力 搅 拌 器;Millipore Simplicity UA型超纯水机;各种高精度玻璃器皿。(2)试剂:参照IFCC公布的肌酸激酶(CK)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、α-淀粉酶(AMY)参考测量程序[2-8],所有试剂均购于北京阿匹斯公司,且均为分析纯。(3)参考物质:CK、LDH、ALP、ALT、AST、GGT、AMY参考物质均购于欧共体参考物质测量研究所(IRMM)。
1.2 临床常规检测系统 广东省中医院4家临床实验室的5个检测系统组成,见表1。
1.3 样本
1.3.1 质评样本 2012年临床检验中心第1次室间质评样本:201211、201212、201213、201214、201215,检 测 前 按 要 求复溶。
1.3.2 新鲜血清样本 收集本院患者新鲜血清:CK、LDH、ALP、ALT、AST、GGT、AMY各5个浓度水平(高、中、低浓度),肉眼可见溶血和脂血标本排除在外。每支0.5mL分装,密封保存于-80℃冻存。与质评样本于同一天检测。

表1 临床常规检测系统组成
1.4 方法
1.4.1 参考方法建立 参照IFCC参考测量程序分别建立CK、LDH、ALP、ALT、AST、GGT、AMY 的参考方法,其中ALT、AST参考方法为加和不加磷酸吡哆醛方法。各参考方法的性能验证(ALT、AST参考方法为加磷酸吡哆醛方法)为:分别连续检测参考物质 (ERM-AD)3~5次,计算均值,比较其结果是否在给出的靶值±不确定度内;每日测量国际参考实验室比对样本(RELA)2011A、2011B各5次,连续测量3d,本实验室复现性要求为变异系数(CV)≤1.5%。参考测量程序的正确性和复现性符合要求后测量收集的血清样本,每份样本测量(ALT、AST参考方法为蒸溜水代替磷酸吡哆醛方法)2次。RELA2011A、2011B作为质控品,于实验开始和结束时检测。
1.4.2 临床常规检测系统 于同一天分发待检样本到各实验室,在保证当日室内质控在控的前提下,按照本实验室标准操作规程测量样本,每份样本重复测量3次,记录测量结果,计算均值。
1.4.3 数据分析 首先将参考方法检测结果(X1)和卫生部靶值(X2)比较,计算X1与X2的百分差异;然后分别将各项目临床常规系统检测结果(Y)与参考方法检测结果(X1)和卫生部靶值(X2)比较,计算相对偏倚[(Y-X)/X×100%],以卫生部临检中心常规化学(酶学)室间比对的允许偏倚为标准分别判断临床常规系统质评检测是否通过。
2 结 果
2.1 参考方法性能评价 参考方法测量精密度、正确度均符合实验室要求,结果见表2。
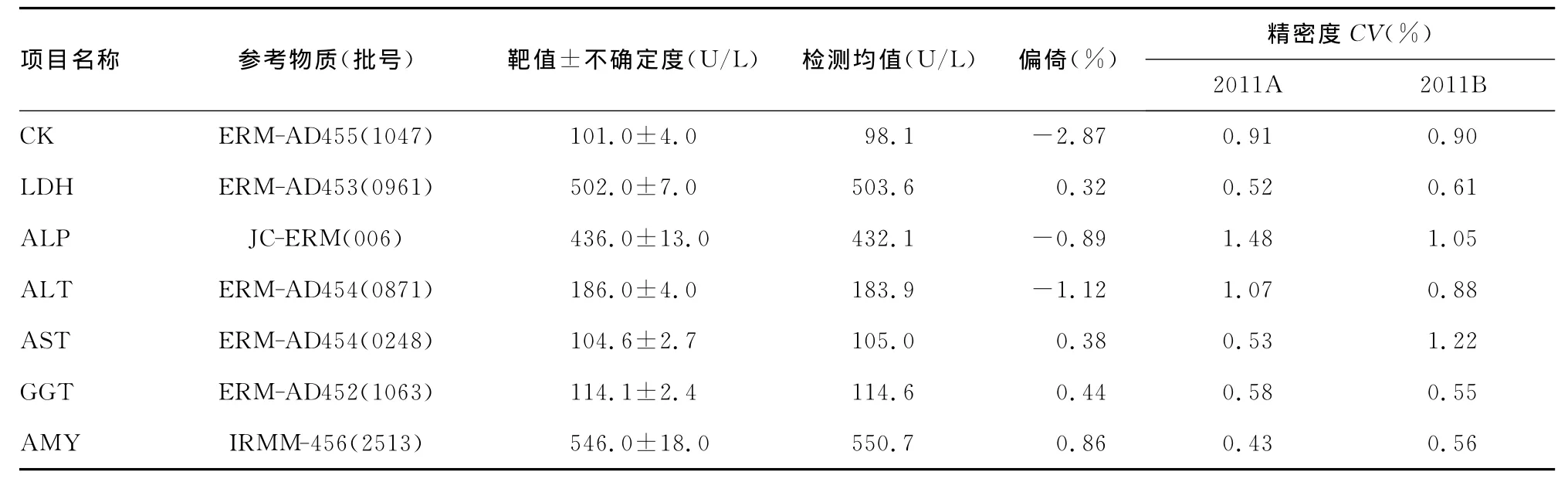
表2 参考方法的性能评价结果
2.2 常规检测系统与参考方法检测患者血清样本结果的偏倚分析 以参考方法为目标比对系统,各常规检测系统检测患者血清样本结果与参考方法测量结果的相对偏倚,见表3。
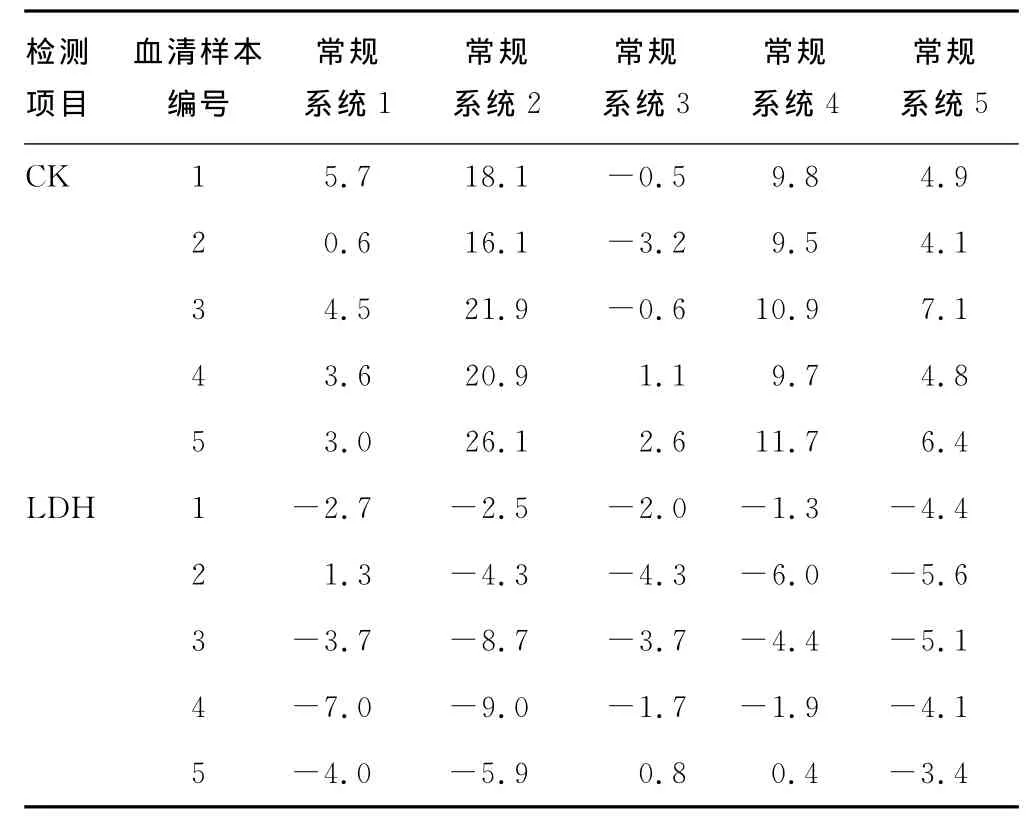
表3 常规检测系统与参考方法检测患者血清样本结果的相对偏倚(%)
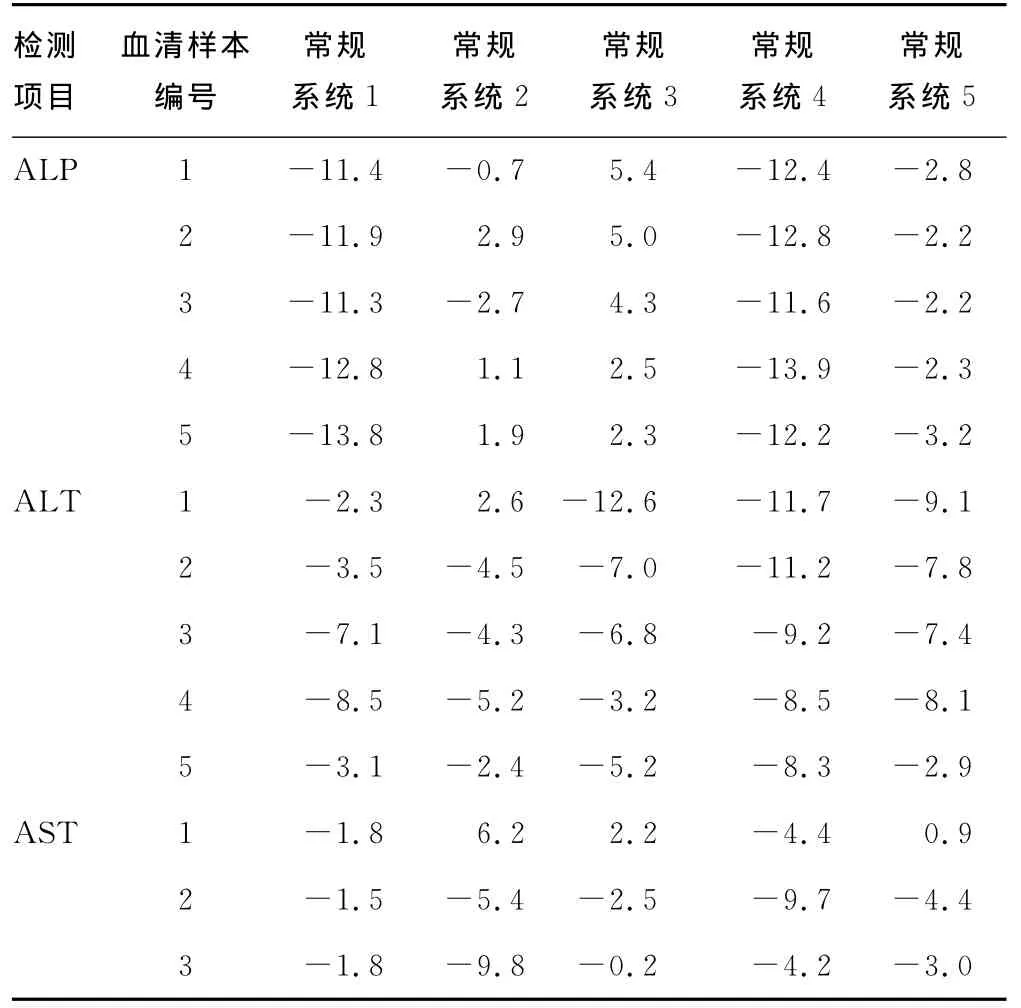
续表3 常规检测系统与参考方法检测患者血清样本结果的相对偏倚(%)

续表3 常规检测系统与参考方法检测患者血清样本结果的相对偏倚(%)
2.3 常规检测系统与参考方法检测临床检验中心室间质评样本结果的偏倚分析 以参考方法为目标比对系统,各常规检测系统测量结果、临床检验中心靶值与参考方法测量结果的相对偏倚,见表4。
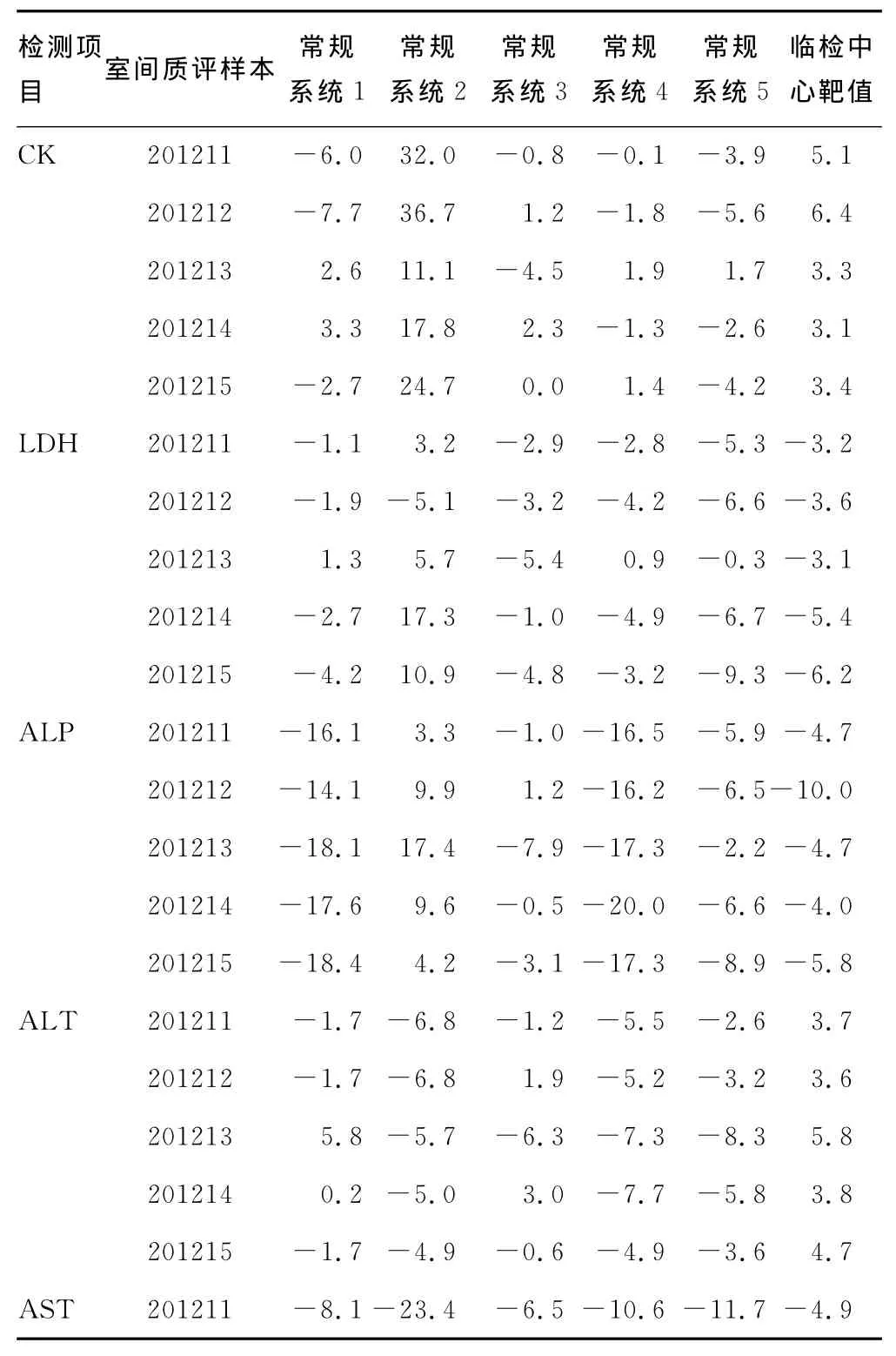
表4 常规检测系统与参考方法检测临床检验中心室间质评样本的偏倚(%)
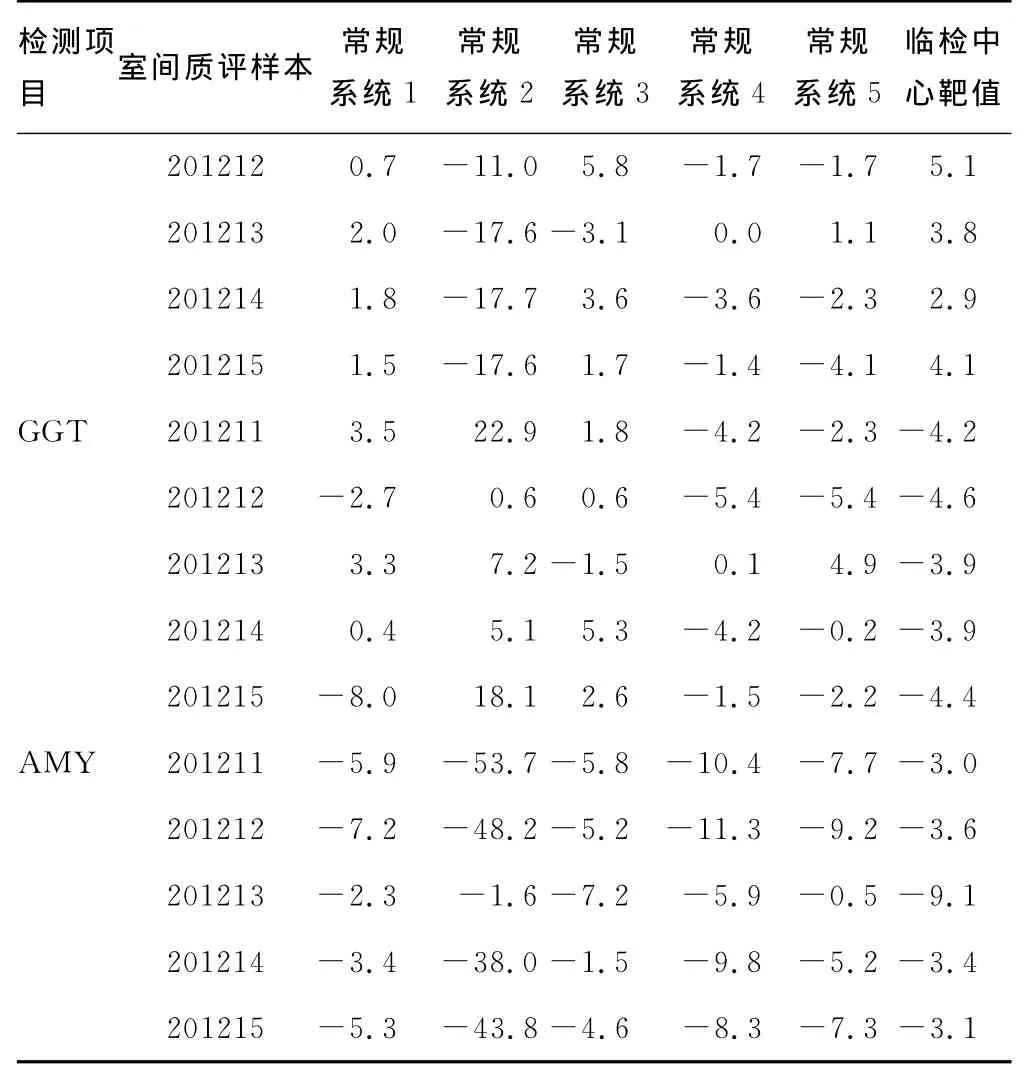
续表4 常规检测系统与参考方法检测临床检验中心室间质评样本的偏倚(%)
3 讨 论
酶在人体内虽然微量却发挥着极为重要的作用,其活性的变化是人体健康的指示灯,但酶活性的检测结果与反应条件密切相关,而目前临床酶学的检测系统多种多样,各实验室根据自己的需要选用不同的仪器、试剂和校准品,给实验室之间结果的互认造成很大的困难。不同检测系统测定结果的一致性研究已成为关注的焦点[9]。
本研究发现,本室建立的参考方法的正确度结果均在参考物质不确定度范围内;测量2011年国际参考实验室比对样本复现性CV≤1.5%,均满足实验室要求,各检测项目的参考方法已在实验室建立,可以作为目标参比系统。
本研究还发现,临床检验中心每个项目的5个靶值与参考方法测量结果的偏倚趋势基本一致,变化范围在-10.0%~6.4%。湿化学系统Y1、Y3、Y4、Y5检测质评样本的结果,若用临床检验中心的允许总误差作为判断标准,不管是以参考方法检测结果或临检中心靶值为目标,其所有测量结果均合格。当实验用临床检验中心酶学正确度验证的标准(CK:靶值±5.5%;LDH:靶值±4.0%;ALP:靶值±10.0%;ALT:靶值±6.0%;AST:靶值±5.0%;GGT:靶值±5.5%;AMY:靶值±7.5%)来评判室间质评结果是否通过,以参考方法检测结果和临检中心靶值为目标,湿化学系统所有测量结果合格率分别为72.9%和63.6%,参考方法检测结果为目标的合格率提高9.0%。如果采用参考方法定值作为标准,可以减少当多家实验室出现方向一致的偏倚时所导致靶值出现的偏倚,使本来测量准确的实验室可能就会不合格,在一定程度上提高正确性。同时本实验结果表明,以参考方法检测结果为目标,用临床检验中心酶学正确度验证的标准,室间质评样本与患者血清的合格率分别为72.9%、67.1%。室间质评样本是否具有基质效应,有待进一步探讨。
常规检测系统Y2为干化学法,用临床检验中心的允许总误差作为判断标准,以参考方法检测结果为目标,其合格率为77.1%,以临检中心干化学靶值为目标,其合格率为94.3%,而同时测量的患者血清仅AST测试不合格,占2.9%。从表2、3可以看出,系统Y2的CK、AMY项目与参考方法相比出现了一个较大的偏倚,对CK、AMY进行基质效应评价表明,5个CK质评样本中仅高值表现有基质效应,而5个AMY质评样本中仅低值没有显示基质效应。本研究也发现,淀粉酶浓度较低时,其与参考方法的偏倚较小,随着浓度增高,其偏倚增大。CK不论室间质评还是患者血清检测结果均发生了较大的正偏倚。值得注意的是,LDH测量方法本实验将反应方向由“P→L”的反应系数按照与罗氏比对结果进行了调整,以参考方法检测结果为目标,测量室间质评和患者血清均在允许误差范围内,其中患者血清结果的偏倚小于1/3允许误差,即其与参考方法相关性满足临床需要,所以当方法不一致时可以通过调整系数达到与参考方法检测结果一致进而与常规化学检测结果统一的目的。
综上所述,参考方法具有较高的正确性,较小的不确定度,将其作为参比方法,应用于室间质评,有利于不同实验室不同系统不同方法之间结果的一致和可比,能够促进不同实验室之间结果的互认。
[1]Jansen R,Schumann G,Baadenhuijsen H,et al.Trueness verification and traceability assessment of results from commercial systems for measurement of six enzyme activities in serum:an international study in the EC4framework of the calibration 2000project[J].Clin Chim Acta,2006,368(1/2):160-167.
[2]Schumann G,Bonora R,Criotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part 2.Reference procedure for the measurement of catalytic concentration of creatine kinase[J].Clin Chem Lab Med,2002,40(6):635-642.
[3]Schumann G,Bonora R,Criotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part 3.Reference procedure for the measurement of catalytic concentration of lactate dehydrogenase[J].Clin Chem Lab Med,2002,40(6):643-648.
[4]Schumann G,Klauke R,Canalias F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37 ℃.Part 9:Reference procedure for the measurement of catalytic concentration of alkaline phosphatase[J].Clin Chem Lab Med,2006,44(9):1146-1155.
[5]Schumann G,Bonora R,Criotti F,et al..IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part4.Reference procedure for the measurement of catalytic concentration of alanine aminotransferase[J].Clin Chem Lab Med,2011,49(9):1439-1446.
[6]Schumann G,Bonora R,Criotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part5.Reference procedure for the measurement of catalytic concentration of aspartate aminotransferase[J].Clin Chem Lab Med,2002,40(7):725-733.
[7]Schumann G,Bonora R,Criotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part6.Reference procedure for the measurement of catalytic concentration ofγ-Glutamyltransferase[J].Clin Chem Lab Med,2002,40(7):734-738.
[8]Schumann G,Aoki R,Ferrero CA,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37℃.Part 8.Reference procedure for the measurement of catalytic concentration ofα-amylase[J].Clin Chem Lab Med,2006,44(9):1146-1155.
[9]阳苹,张莉萍,肖勤,等.实验室内不同检测系统比对周期及比对方案探讨[J].重庆医学,2011,40(3):253-255.

