腺病毒介导miRNA-138抑制人胃癌BGC-823细胞增殖的机制研究*
范亚川,梁光萍,陈先华,胡春燕,邹利全,李学成,陈 陵△
(1.中国人民解放军三二四医院消化内科,重庆400020;2.第三军医大学西南医院烧伤研究所,重庆400038;3.第三军医大学新桥医院肿瘤生物治疗中心,重庆400037)
胃癌是全球肿瘤中发病率、致死率最高的肿瘤之一,传统手术、化疗及放疗疗效欠佳[1],5年生存率不到30%[2],因此需要深入研究胃癌发病机制并开发新的治疗模式[3]。随着miRNA(miR)的功能的揭示,miRNA 在肿瘤早期诊断[4]及治疗[5]中的作用日益受到重视。笔者在前期研究中发现,miR-138在胃癌进展过程中呈逐步下降趋势,且其表达与hTERT呈负相关[6],而hTERT 可促进胃癌发生、发展[7-8]。国外有研究亦发现,miR-138可通过抑制甲状腺癌内hTERT蛋白表达而抑制甲状腺癌细胞生长[9]。在成功包装负载miR-138的腺病毒[10]基础上,本研究拟进一步探讨miR-138过表达对人胃癌BGC-823细胞增殖及侵袭能力的影响及可能的作用机制,现报道如下。
1 资料与方法
1.1 一般资料 人胃癌BGC-823细胞株(中科院上海生科院细胞资源中心),DMEM高糖培养基、胎牛血清(FBS)及胰蛋白酶(HyClone),负载有miR-138表达序列的复制缺陷型腺病毒(Ad-miR138),由本室构建并保存[10];负载有β-半乳糖苷酶(β-gal)基因LacZ的复制缺陷型腺病毒,由西南医院心内科唐兵博士惠赠。mirVanaTMmiRNA提取试剂盒(Ambion),逆转录试剂盒、SYBR Premix Ex Taq试剂盒(TaKaRa);ABI7500荧光定量PCR仪(ABI);CCK-8检测试剂盒(碧云天);Transwell小室(Corning)。
1.2 方法
1.2.1 BGC-823细胞培养 采用含10%FBS的高糖DMEM培养液,置37℃、5%CO2培养箱中培养。
1.2.2 Ad-miR138感染人胃癌细胞BGC-823 取对数生长期的BGC-823细胞接种于6孔细胞培养板中,以PBS代替腺病毒作为空白对照(BGC-823组);感染 Ad-LacZ的阴性对照(BGC823-AdLacZ组);感染 Ad-miR138的BGC823-AdmiR138组。腺病毒感染步骤参照文献[10]进行。感染后48h收集各组细胞用于后续实验。
1.2.3 实时定量-聚合酶链反应(RT-PCR)检测miR-138表达提取细胞miRNA,逆转录cDNA,配好RT-PCR反应体系后,于ABI7500荧光定量PCR仪上进行PCR反应,退火温度为60℃。相对定量采用2-△△CT进行计算,引物序列见表1。
1.2.4 CCK-8方法检测胃癌细胞增殖 感染腺病毒48h后收集各组细胞,以每孔2.5×103个细胞,接种于96孔板中,共检测6次,每天1次,每个时间点设置3个复孔。检测前每孔分别加入20μL CCK-8试剂,避光37℃孵育2h,轻轻振荡后,酶标仪测定450nm波长处吸光度(A)值,并比较各组细胞的A值,观察miR-138对胃癌细胞增殖的影响并计算抑瘤率。抑瘤率=(1-实验组A值/对照组A值)×100%。
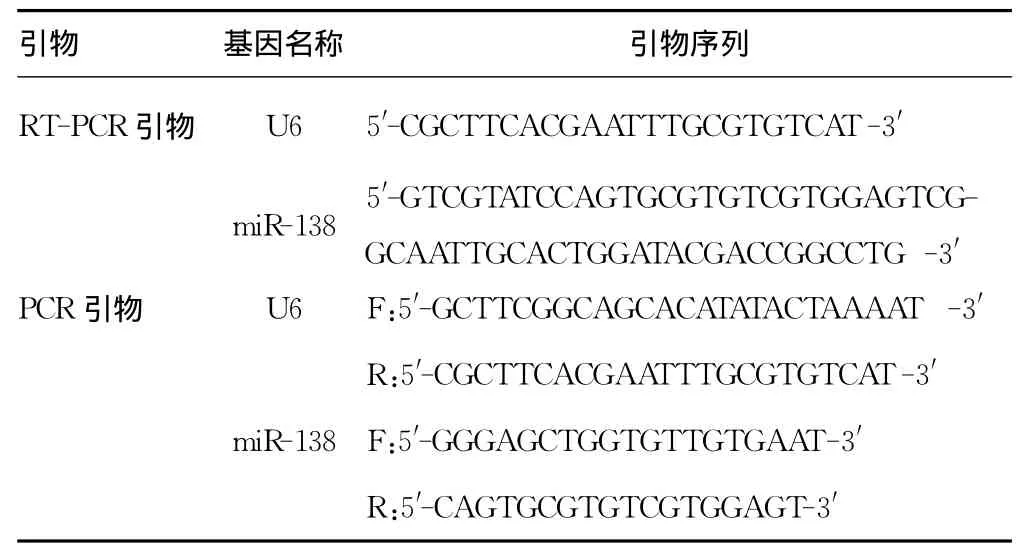
表1 RT-PCR及PCR引物列表
1.2.5 Transwell小室检测胃癌细胞侵袭能力 感染腺病毒48h后收集各组细胞,用无血清的DMEM培养液悬浮细胞,稀释成1×105mL-1的细胞密度,加入200μL细胞悬液至Transwell上室,下室加入800μL的含10%血清的DMEM培养液,37℃孵育24h后,乙醇棉球拭去上室未迁移细胞,经95%乙醇固定后,1%结晶紫染色3min。采用显微镜观察细胞迁移情况,实验重复3次。随机取5个200倍视野,计数侵袭的细胞,取平均值。
1.3 统计学处理 采用SPSS 13.0统计软件,计量资料以±s表示,组间比较采用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR 检测 Ad-miR138感染 BGC-823细胞后 miR-138的表达 与BGC823-AdLacZ组相比,BGC823-AdmiR138组细胞内miR-138表达丰度显著上调(1.07±0.07 vs.4.89±0.45),差异有统计学意义(P<0.05)。
2.2 CCK-8检测细胞生长曲线 采用CCK-8检测细胞生长曲线。与对照组相比,BGC823-AdmiR138组细胞增殖受到明显抑制。在第5、6天,BGC823-AdmiR138组A值显著低于对照组(5d:0.41±0.04 vs.0.65±0.08;6d:0.52±0.06 vs.0.77±0.06),第5、6天抑瘤率分别为36.9%、32.5%。
2.3 Ad-miR138感染对胃癌BGC-823细胞侵袭能力的影响与BGC823-AdLacZ组相比,Ad-miR138实验组细胞侵袭能力显著下降(56±12 vs.32±11),差异有统计学意义(P<0.05),见图2。

图1 CCK-8检测BGC-823细胞生长曲线

图2 Transwell小室检测胃癌细胞侵袭能力
3 讨 论
新近研究发现,miR-138是一重要的抑癌miRNA,可通过靶向多个癌基因抑制肿瘤生长,例如在肝癌细胞株内miR-138功能模拟物可抑制靶基因CCND3而在体外及小鼠体内抑制肝细胞癌的生长与转移[11]。miR-138还可通过 BCR-ABL/GATA1/miR-138环路,抑制慢性髓样白血病细胞株增殖,促进其凋亡[12]。还有研究发现,在肾透明细胞癌细胞株786-0内,miR-138可抑制靶基因HIF-1α表达而促进肾癌细胞凋亡并抑制其侵袭能力[13];并且,miR-138还可通过抑制其靶基因P-糖蛋白,Bcl-2以及多种耐药基因-1,逆转白血病细胞株 HL-60的耐药性[14]。这些结果表明,miR-138是一个重要的抑癌miRNA。笔者前期研究亦发现,转染 miR-138功能模拟物RNA后,人胃腺癌细胞株SGC-7901增殖能力显著抑制[15]。由于miR-138功能模拟物RNA易降解,作用时间短。
本研究采用Ad-miR138感染人胃癌BGC-823细胞株,发现Ad-miR138可明显上调细胞内miR-138表达丰度,并显著抑制BGC-823细胞的增殖及侵袭能力。因此,以抑癌miR-138作为胃癌治疗靶标的策略是可行的。并且,由于miR-138可通过多种机制抑制肿瘤生长与增殖,并可逆转肿瘤细胞对化疗药物的耐药性[14],因此极可能成为优良的抗肿瘤治疗靶标。
[1]张立贵.影响胃癌根治术后预后相关因素分析[J].海南医学院学报,2013,19(10):1438-1440,1444.
[2]Shi Y,Zhou Y.The role of surgery in the treatment of gastric cancer[J].J Surg Oncol,2010,101(8):687-692.
[3]孙杰,潘赛英,陈倩琪,等.曲妥珠单抗联合FOLFIRI治疗HER2阳性晚期胃癌的疗效观察[J].南方医科大学学报,2011,31(8):1458-1460.
[4]赵苏瑛,吴倩,高峰,等.血清miR-155水平检测在乳腺肿瘤患者早期诊断中的研究[J].国际检验医学杂志,2012,33(13):1569-1571.
[5]孔飞飞,邱欣欣,陈光辉,等.靶向YB-1的 microRNA表达载体的构建及其对 MB-MDA-231细胞增殖的影响[J].激光杂志,2011,32(4):67-69.
[6]李学成,王宗华,梁光萍,等.miR-138在胃黏膜癌变过程中的表达及意义[J].临床检验杂志,2011,29(7):520-522.
[7]陈陵,陈婷,蔡永国,等.胃黏膜癌变过程中hTERT和相关基因表达的变化及其临床意义[J].胃肠病学和肝病学杂志,2006,15(5):443-447.
[8]Yu ST,Chen L,Wang HJ,et al.hTERT promotes the invasion of telomerase-negative tumor cells in vitro[J].Int J Oncol,2009,35(2):329-336.
[9]Mitomo S,Maesawa C,Ogasawara S,et al.Downregulation of miR-138is associated with overexpression of human telomerase reverse transcriptase protein in human anaplastic thyroid carcinoma cell lines[J].Cancer Sci,2008,99(2):280-286.
[10]熊晓峰,陈陵,范亚川,等.负载hTERT调控相关miR-138复制缺陷型腺病毒的包装及鉴定[J].重庆医学,2011,40(9):896-898.
[11]Wang W,Zhao LJ,Tan YX,et al.MiR-138induces cell cycle arrest by targeting cyclin D3in hepatocellular carcinoma[J].Carcinogenesis,2012,33(5):1113-1120.
[12]Xu C,Fu H,Gao L,et al.BCR-ABL/GATA1/miR-138 mini circuitry contributes to the leukemogenesis of chronic myeloid leukemia[J].Oncogene,2012,2012:557.
[13]Song T,Zhang X,Wang C,et al.MiR-138suppresses expression of hypoxia-inducible factor 1alpha(HIF-1alpha)in clear cell renal cell carcinoma 786-0cells[J].Asian Pac J Cancer Prev,2011,12(5):1307-1311.
[14]Zhao X,Yang L,Hu J,et al.miR-138might reverse multidrug resistance of leukemia cells[J].Leuk Res,2010,34(8):1078-1082.
[15]陈陵,梁光萍,邹利全,等.miR-138对人胃腺癌细胞SGC-7901增殖的影响[J].中国肿瘤临床,2011,38(13):755-758.

