阿拉伯茶染色体核型分析
赵振军 (长江大学园艺园林学院,湖北 荆州434025;南京农业大学园艺学院,江苏 南京 210095)
黎星辉 (南京农业大学园艺学院,江苏 南京 210095)
阿拉伯茶 (Catha eduli)是卫茅科的一种植物,起源于非洲东部的埃塞俄比亚[1],后来逐步推广栽培到也门、肯尼亚、乌干达、坦桑尼亚、阿拉伯半岛、赞比亚以及南非等地[2]。阿拉伯茶在不同区域、不同民族流行许多不同的名字,如埃塞俄比亚先民称它Abyssinian tea(阿比西尼亚茶),非洲人管它叫African salad(非洲色拉)、African tea(非洲茶),阿拉伯民族许多人把它当作一种日常嚼食、冲泡用的饮料植物,命名为Arabian tea(阿拉伯茶)。
阿拉伯茶因其气味芬芳、提神醒脑等特点而适应于咀嚼,在非洲和阿拉伯世界有较大的消费市场。在东非和阿拉伯半岛等国的土著居民中,阿拉伯茶的嚼食类似于东方国家的上午茶和西方国家的下午茶活动,已经成了一种日常的不可或缺的生活习惯[3-5]。
染色体是遗传物质的载体,生物染色体的重组常常导致新种的出现,有的学者甚至认为进化就是自然选择与染色体变化互相作用的结果。染色体在一定程度上能反映生物的本质、反映生物在系统中的位置 (物种间的亲缘关系)的观点已经为许多学者所认可[6]。因而,核型分析的方法被用作确定植物间分类差别的常见手段。
由于阿拉伯茶是一种除非洲大陆和阿拉伯半岛之外受管制的经济作物,且原产地非洲大陆相对贫困落后,人们对它的研究非常不够,到目前为止,有据可查的仅有对其形态、繁殖和培管的描述以及与欧洲人合作的对其生化成分的药用价值的研究报告[7-9],而未见任何细胞学领域的研究。为此,本研究对2个不同品种阿拉伯茶染色体形态与核型进行了分析,旨在为阿拉伯茶遗传多样性寻找细胞学证据。
1 材料与方法
1.1 供试材料
供试材料采用原产于埃塞俄比亚的绿叶、紫叶阿拉伯茶和安徽农业大学校园绿化自繁的冬青卫茅(Euonymus japonicas)。
1.2 试验方法
1.2.1 制片
在室温达到15℃以上时,于上午8:00~10:00截取生长旺盛的阿拉伯茶幼嫩芽尖。染色体制片参照陈瑞阳等的去壁低渗法[10-11],将剪取的芽尖浸入蒸馏水中,1~4℃低温处理24h,预处理后,在室温下,将预处理过的材料洗净 (约冲洗5min),置于0.075mol/LKCl溶液中处理约20~30min进行前低渗处理,将低渗处理过的材料置于解离液中处理,解离液含2.5%果胶酶+2.5%纤维素酶,pH为5.0~5.5,在25~30℃恒温下酶解至芽尖分生组织接近脱落为度 (约2~3h)。倒去酶液,用蒸馏水轻轻冲洗3~5次,并在其中浸泡20min左右。采用压片法制作染色体标本,在显微镜观察并拍照。
1.2.2 染色体核型分析
经镜检,每个种选出50个具有中期分裂相、分散良好的染色体进行拍照,从中选出染色体形态比较完整、清晰的分裂相各5个进行核型分析[12]。分别计算各染色体的相对长度、臂比、着丝点指数、核型不对称系数,按照Levan等[13]和Kuo等[14]的分类标准划分染色体类型,根据Stebbins等[15]关于核型分类的标准划分核型类型。具体分类标准详见表1~3。

表1 Levan染色体分类系统

表2 Kuo染色体分类标准

表3 Stebbins的核型分类表
2 结果与分析
2.1 染色体数目
对试验材料的细胞观察计数并分析,选择阿拉伯茶绿芽种的芽尖分生组织细胞分裂相中染色体分散较好的细胞50个,观察并统计,结果显示:阿拉伯茶绿芽种染色体数目在28~34之间,多数为32占93.7%,为30的占3.5%,为28的占1.6%,为34的占1.2%。
阿拉伯茶紫芽种中有43个细胞染色体数目为32条,占计数总数的86%,4个细胞染色体数目为30条,占计数总数的8%,3个细胞染色体数目为28条,占计数总数的6%。
冬青卫茅中有46个细胞染色体数目为32条,占计数总数的92%,4个细胞染色体数目为26条,占计数总数的8%。
李懋学等[12]认为,85%以上的细胞具有的染色体数即为该植物的染色体数目。因此,根据上述分析可以确定阿拉伯茶绿芽种、紫芽种及冬青卫矛的染色体数为2n=32。
2.2 染色体核型分析结果
对染色体分散良好的5个细胞进行核型分析表明,按照Leven等[13]对染色体的分类标准,计算染色体的相对长度、臂比、染色体的类型等,将按照长短顺序进行编号,列于表4,并据此作出核型模式图1~3。
2.2.1 阿拉伯茶绿芽种染色体核型
绿芽阿拉伯茶的核型、核型模式图及染色体参数分别见表4及图1所示。结果显示:绿芽阿拉伯茶的16对染色体,具中部着丝点的为第3、6、7、8、9、10、11、12、13、15、16对染色体,具近中部着丝点的为第1、2、4、5、14对染色体,带有随体的为第2对染色体。故核型公式为K(2n)=2x=32=11m(2SAT)+5sm。
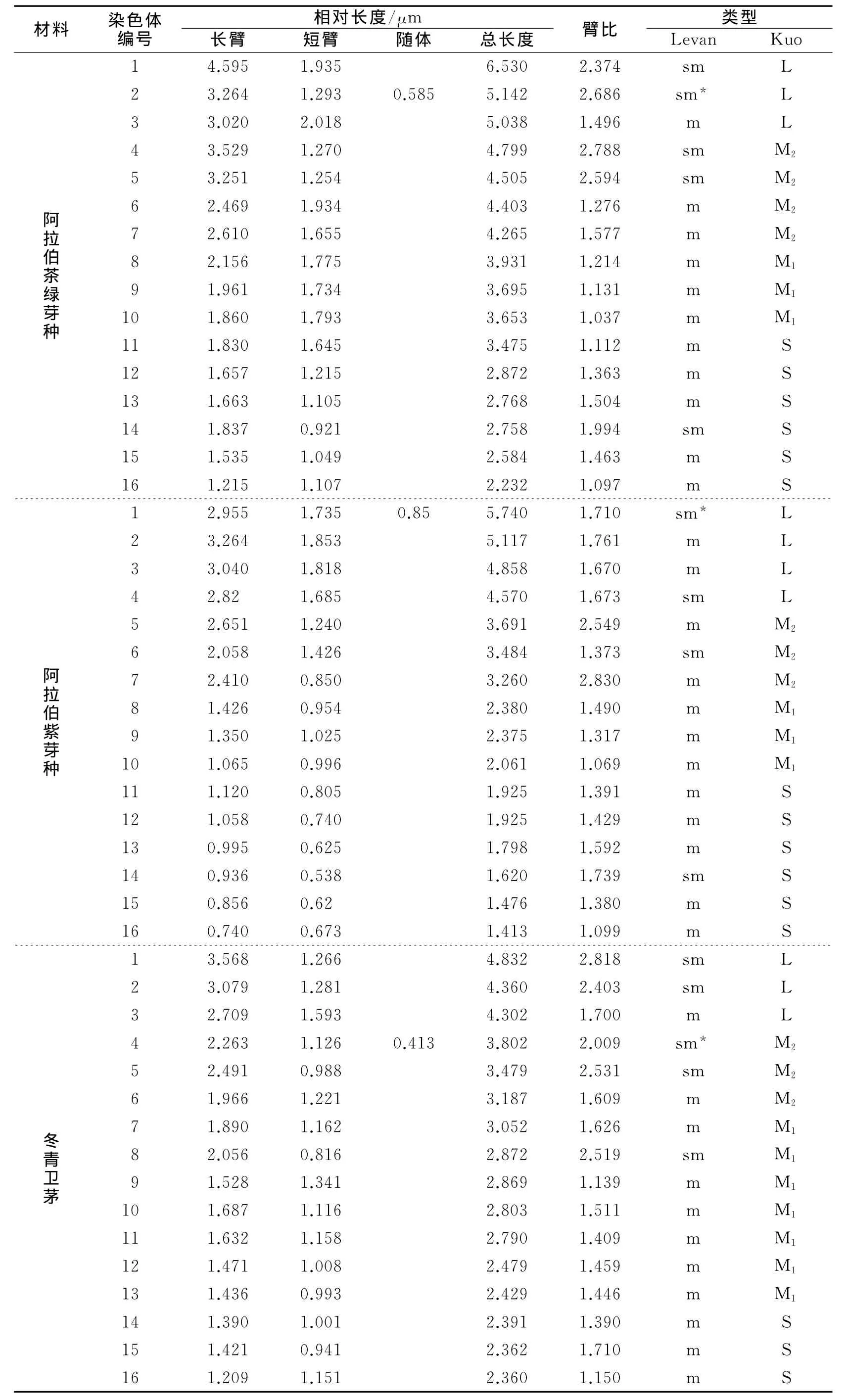
表4 阿拉伯茶绿芽种、紫芽种与冬青卫茅染色体核型参数
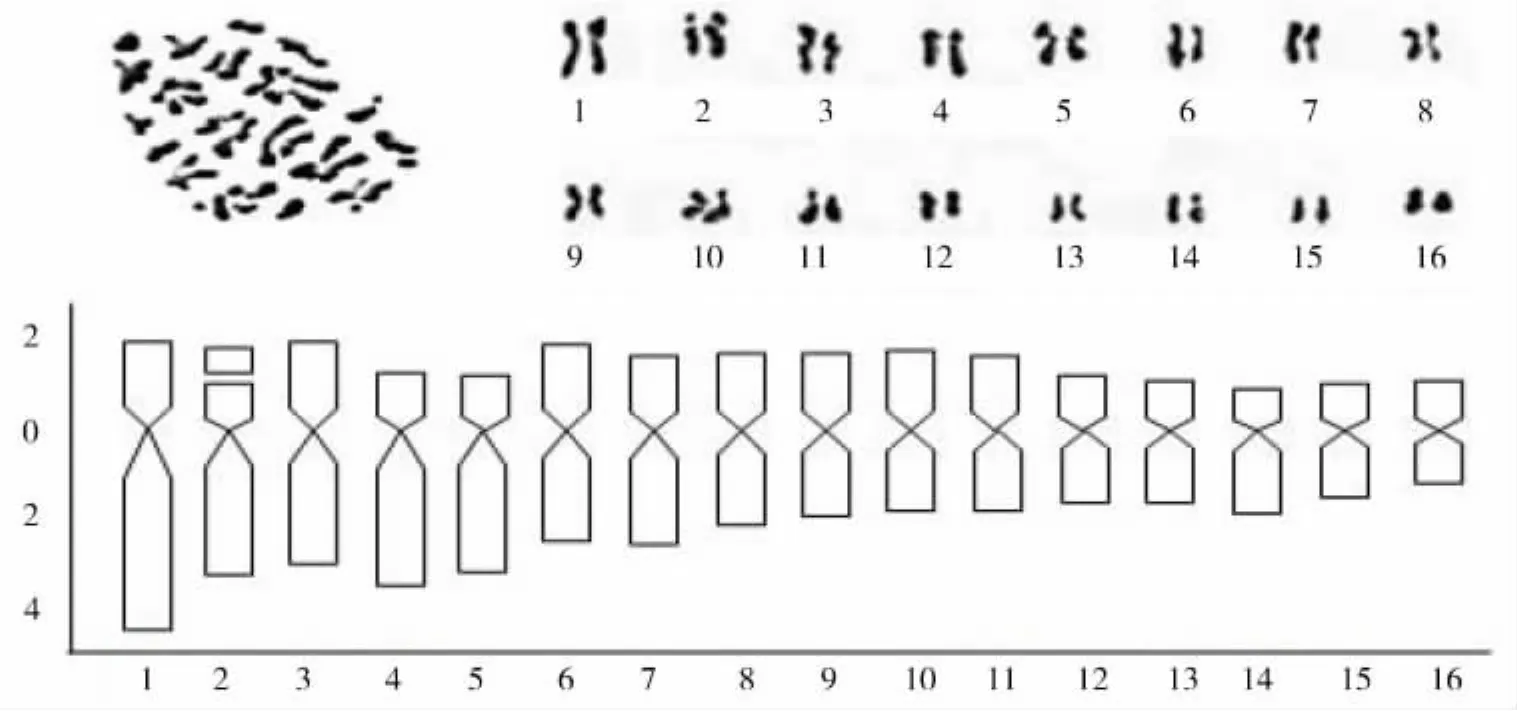
图1 阿拉伯茶绿芽种中期相染色体形态与核型模式图
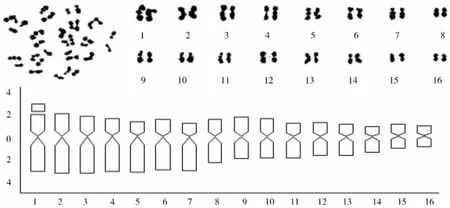
图2 阿拉伯茶紫芽种中期相染色体形态与核型模式图
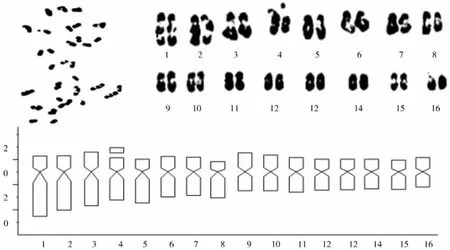
图3 冬青卫茅中期相染色体形态与核型模式图
2.2.2 阿拉伯茶紫芽种染色体核型
阿拉伯茶紫芽种的核型、核型模式图及染色体参数分别见表4及图2所示。紫芽种的16对染色体,具中部着丝点的为第3、4、6、8、9、10、11、12、13、15、16对染色体,具近中部着丝点的是第1、2、5、7、14对染色体,带有随体的是第1对染色体。故核型公式为K (2n)=2x=32=11m (1SAT)+5sm。
2.2.3 冬青卫矛染色体核型
冬青卫茅的核型、核型模式图及染色体参数分别见表4与图3所示。冬青卫茅的16对染色体,具中部着丝点的为第3、6、7、8、9、10、11、12、13、15、16对染色体,具近中部着丝点的为第1、2、4、5、14对染色体,带有随体的为第4对染色体。故核型公式为K (2n)=2x=32=11m (4SAT)+5sm。
3 讨论与小结
细胞的核型特征,如染色体的数目、相对长度、着丝点位置、核型不对称系数和随体的有无等,一般是稳定的,都可能作为分类指标而被利用。但细胞核染色体的特点,如同形态学的指标一样,其分类学意义也是相对的。有时分类上不同的类型,却保持近似的染色体核型。反之,在分类上相近的类型,其染色体核型却很不相同。究其原因,可能前者是涉及到基因改变,后者虽有染色体形态改变,但未涉及到基因变化[16]。
从核型分析结果来看,阿拉伯茶属的阿拉伯茶和卫茅属的冬青卫茅核型均属于对称核型,染色体结构和相对长度组成都具有很大的相似性,按Stebbins的分类法,属最原始的植物进化类型。2属间植物染色体进化速率相对缓慢,核型变异很小,说明2属植物都是相当稳定的原始木本类群。木本类群与草本类群相比,进化速度要慢得多[17]。
洪德元等[18]研究认为卫茅属Euonymus染色体基数是x=8,仅E.echinatus为2n=16,其余均为四倍体和八倍体。本研究结果表明,卫茅属的冬青卫茅和阿拉伯茶属的阿拉伯茶2n也为16,通过染色体配对显示,冬青卫茅和阿拉伯茶均是二倍体植株,所以,冬青卫茅是卫茅属中除E.echinatus外的又一种二倍体植物。因为对阿拉伯茶属核型研究较少,本研究只能证实阿拉伯茶2n为16,还没有足够的证据证实阿拉伯茶属植物的染色体基数,但是可以推测基数大致为8或者16。
本研究所研究的紫芽阿拉伯茶、绿芽阿拉伯茶和冬青卫茅芽尖有丝分裂中期细胞都是二倍体体细胞,染色体为32条,其核型公式分别为K (2n)=2x=32=11m (2SAT)+5sm、K (2n)=2x=32=11m (1SAT)+5sm、K (2n)=2x=32=11m (4SAT)+5sm,按Stebbins核型分类标准分类均属于2B型。
[1]Kennedy J G.The Flower of Paradise-The Institutionalized Use of the Drug Qat In North Yemen [M].Dordrecht:D.Reidel Publishing Company,1987:153-154.
[2]Krikorian A D.Kat and its use:an historical perspective[J].Journal of Ethnopharmacology,1984,12:115-178.
[3]Al-Habori M,Al-Mamary M.Long-term feeding effects of Catha edulis leaves on blood constituents in animals [J].Phytomedicine,2004,11:639-644.
[4]Alem A,Shibre T.Khat induced psychosis and its medicolegal implication [J].Ethiopian Medical Journal,1997,35:137-141.
[5]Mckee C M.Medical and social aspects of qat in Yemen [J].Journal of the Royal Society of Madicine,1987,80:762-765.
[6]胡进耀,苏智先,岳宝良,等.植物核型分析方法的研究进展 [J].四川师范学院学报 (自然科学版),2002,23(3):239-243.
[7]Al-hebshi N,Nilsen M,Skaug N.In vitro effects of crude khat extracts on the growth,colonization and glucosyltransferases of Streptococcus mutans[J].Acta Odontol Scand,2005,63:136-142.
[8]Al-Motarreb A,Baker K,Broadley K J.Khat:Pharmacological and medical aspects and its social use in Yemen [J].Phytother Res,2002,16:403-413,
[9]Abdul G N,Eriksson M,Kristiansson B,et al.The influence of khat-chewing on birth-weight in full-term infants [J].Soc Sci Med,1987,24:625-627.
[10]陈瑞阳,宋文芹,李秀兰,等.植物有丝分裂染色体标本制作的新方法 [J].植物学报,1979,21(5):297-298.
[11]李懋学,张赞平.作物染色体及其研究技术 [M].北京:中国农业出版社,1996:28-29.
[12]李懋学,陈瑞阳.关于植物核型分析的标准化问题 [J].武汉植物学研究,1985,3(4):297-302.
[13]Levan A,Fredga K,Sandberg A A.Nomenclature for centromeric position on chromosomes[J].Hereditas Band,1964,52:197-202.
[14]Kuo S R,Wang T T,Huang T C.Karyotype analysis of some Formosan gymnosperms[J].Taiwania,1972,17:66.
[15]Stebbins G L.Chromosome evoluion in higher plants[M].London:Edward Aronld,1971:88.
[16]李贵全.细胞学研究基础 [M].北京:中国林业出版社,2001:20-47.
[17]Levan A,Fredga K,Sandberg A A.Nomenclature for centromeric position on chromosomes[J].Hereditas Band,1964,52:197-202.
[18]洪德元.植物细胞分类学 [M].北京:科学出版社,1990:327.
——致坚守奋斗的你

