睾丸混合性生殖细胞瘤1例并文献分析
余明主,曾小明,郑慧杰,谭公祥,熊海云,杜丽英,朱皓皞
(本文编辑:张仲书)
睾丸混合性生殖细胞瘤(testicular mixed germ cell tumors,TMGCTS)临床较少见,多数症状无特异,早期诊断较困难,为睾丸的恶性肿瘤。现结合1例临床报告,对TMGCTS的诊断、临床病理特点、治疗和预后进行分析如下。
1 病例资料
患者男,39岁,已婚,已生育1子1女,身体健康。因发现左侧睾丸肿块2年余,于2012年12月17日入院。否认有睾丸外伤和隐睾史。查体:神清,一般情况良好,浅表淋巴结无肿大,无女性型乳房增大,心肺正常,腹平软,无压痛、反跳痛,肠鸣音正常,肝脾正常,腹部及腹股沟区未触及肿块,双肾区无叩痛,输尿管行径区无压痛,膀胱区无隆起。外生殖器发育正常,阴囊左侧可触及睾丸约5 cm×4 cm×3 cm大小,质实偏硬,表面光滑,与阴囊无粘连,无触痛,有沉重感,左侧精索无增粗,透光试验阴性。右侧睾丸大小、质地均正常。入院后辅助检查,血常规:WBC 4.7×109/L,Hb 143 g/L,Plt 182 ×109/L,白细胞分类未见异常;大小便常规无异常;肝肾功能无异常;肿瘤标志物:HCG 95.4 m IU/ml(正常值0.1~7.0 m IU/ml),AFP 20.41ng/ml(正常值<7.2 ng/ml)。阴囊彩超检查提示:左侧睾丸明显增大,回声混杂,提示左侧睾丸肿瘤。胸部CT检查示:肺及纵隔未见明显占位性病变。全腹部、盆腔CT检查示:腹膜后及两侧腹股沟未见明显肿大淋巴结。左侧睾丸区见直径约为35 mm的类圆形肿块。临床诊断:左侧睾丸肿瘤。于2012年12月21日在硬膜外麻醉下行左侧睾丸根治性切除术(腹股沟切口)。高位切除左侧精索,睾丸于精索外筋膜内予以完整切除。术后病理报告:已剖开的睾丸为4 cm×3 cm×2.5 cm,切面见肿物灰黄实性质软,并占据大部睾丸切面,仅边缘见少许正常的组织。镜下检查见:送检肿物大片出血坏死,瘤组织形态复杂多样,部分呈片状胞质透明,胞膜清楚;部分呈腺样、乳头样,核大深染,核分裂象易见;另见多量畸胎瘤成分,可见鳞状上皮,软骨等(图1~3)。免疫组化:癌胚抗原(CEA)(-),白细胞分化抗原(CD117)(+),上皮膜抗原(EMA)(+),胎盘型碱性磷酸酶(PLAP)(+),抑癌基因产物(P53)(+)、AFP(+)、细胞角蛋白(CK19)(+),Ki67约50%,胚胎癌CD30少数散在(+),提示肿瘤细胞增殖活性强。诊断:(左侧睾丸)混合性生殖细胞瘤(精原细胞瘤+畸胎瘤+胚胎性癌)。临床分期:Ⅰ期。术后3 d复查肿瘤标志物结果正常。HCG 4.66 m IU/m l,AFP 4.94 ng/ml,均降至正常。术后转肿瘤科放疗,随访6个月,未见复发、转移,性功能正常。
2 讨论
睾丸肿瘤发病率低,在男性肿瘤中约占1% ~1.5%,在泌尿系统肿瘤中约占3% ~9%,多发生在30~50岁的年龄段[1-2],而恶性比例高,95%以上为恶性睾丸生殖细胞瘤,若能早期诊断和综合治疗可明显改善睾丸肿瘤的预后,治愈率可超过90%[3]。睾丸肿瘤的病因尚不清楚,但其发生与睾丸创伤、内分泌障碍、遗传及感染有关。其流行病学危险因素包括:隐睾病史或睾丸发育不全、睾丸肿瘤家族史、对侧睾丸肿瘤及不育等。睾丸肿瘤从病理学角度主要分为3类:生殖细胞瘤(90% ~95%)、性索间质肿瘤和混合性肿瘤。

图1 精原细胞瘤(HE×400)

图2 畸胎瘤(HE×400)
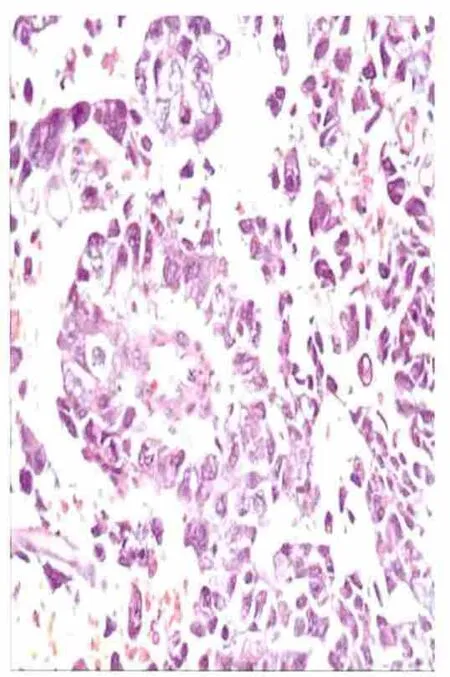
图3 胚胎癌(HE×400)
TMGCTS临床少见,多为个案报道[4-5],其发生率仅次于精原细胞瘤,占成人睾丸生殖细胞瘤的第二位,大多单发,双侧性约占1.1% ~2.7%,生殖器以外部位亦可原发。TMGCTS约占生殖细胞瘤的60%,像本例合并3种成分之多则罕见。TMGCTS与单一生殖细胞瘤均起源于一个不能分类的曲细精管内生殖细胞瘤(intrat-ubular germ cell neoplasia of the unclassified type,IGCNU),又称睾丸生殖细胞瘤前体[6]。IGCNU的遗传学改变是12号染色体短臂出现等臂染色体或其他细胞遗传学改变,有的还有11号染色体短臂的丢失。单纯的精原细胞瘤可分化出非精原细胞瘤的成分,有报道认为TMGCTS的发生,为精原细胞瘤沿着非精原细胞性生殖细胞瘤的方向局限性分化所致。TMGCTS患者血AFP和HCG升高者分别占60%和55%,本例术前均明显异常。病理应注意各种肿瘤类型之间的诊断与鉴别诊断,①精原细胞瘤:常呈弥漫片状排列,瘤细胞透明或轻度嗜酸,界限清楚,核圆形或卵圆形,染色质呈细腻颗粒状,有一个或两个明显的核仁。该肿瘤PLAP阳性而各种淋巴细胞标记阴性,可与淋巴瘤鉴别。②胚胎癌:癌细胞胞浆宽广,核大而不规则且呈泡状,核仁明显,细胞核较拥挤,似有重叠。在诊断时需与间变型精原细胞瘤鉴别,胚胎癌CD30阳性,而精原细胞瘤多为阴性。③卵黄囊瘤:多种排列方式,其中如本例中的微囊型(又叫网状型)最常见。微囊型卵黄囊瘤的特点是细胞排列成蜘蛛网状,细胞内有空泡形成,常有黏液基质,有特征性的卵黄囊小体和糖原染色阳性的透明球出现,免疫组化AFP和CK阳性。病理诊断时应广泛取材切片,避免遗漏。在诊断混合性生殖细胞瘤时亦需要指明肿瘤组织学类型。
TMGCTS的诊断目前主要依靠临床检查、影像学检查、血清肿瘤标记物检查及手术和病理学检查。睾丸肿瘤通常表现为阴囊单侧内的无痛性肿块,约20%的患者表现为阴囊疼痛,约10%的患者容易被误诊为睾丸附睾炎而延误诊断,约7%的患者表现为男子乳房发育,该类患者多为非精原细胞瘤。睾丸彩超和CT检查是临床最常用的影像学检查。超声能明确阴囊肿块与睾丸的关系,尤其在肿块较小难以触及时有重要意义。如睾丸回声正常,轮廓完整,说明肿块位于睾丸外;肿块来源于睾丸时,睾丸有回声改变[7]。本例患者行彩超检查示:“实性肿物,边界清,形态不规整;内呈中低混合回声,可检出较丰富血流信号”,提示恶性可能性大,有很高的诊断价值。而CT检查不仅能显示出睾丸生殖细胞类肿瘤本身特征,也可显示淋巴结及远处转移情况,为肿瘤的分期和临床制定治疗方案提供参考。AFP及HCG对于非精原细胞瘤更有意义,可在肿块、症状出现之前数月即有升高。在卵黄囊瘤及胚胎瘤或以其成分为主的混合细胞瘤中,AFP升高,术前可对肿瘤类型有大体估计,术后动态检测则有利于判断有无残余瘤灶及有无复发[8]。
目前TMGCTS的治疗倾向采用综合治疗的方法。精原细胞瘤伴有非精原细胞瘤称混合性生殖细胞瘤,临床少见。本例3种肿瘤成分共存现象极为罕见,恶性程度较高。根治性睾丸切除术+放疗是治疗Ⅰ期和Ⅱ期TMGCTS的主要手段;Ⅱ期和Ⅲ期公认的治疗方案是Ⅱ期作高位睾丸切除术及高位精索结扎术,然后进行腹膜后淋巴结清扫术,辅以化疗或局部放疗等;Ⅲ期以化疗为主或局部放疗。本例属临床Ⅰ期,行根治性睾丸切除术+放疗。尽管有学者建议患者术后不行放疗仍可获满意效果,并可避免放疗后不育。但大多数学者仍认为对Ⅰ期患者行低剂量、局部区域的放疗是安全和有效的;Ⅱ期肿瘤在睾丸切除和(或)腹膜后淋巴结清扫术后,行辅助性放疗,可明显减少复发,提高长期生存率。对于较大的Ⅱ期肿瘤,可术前先行放疗,待肿瘤缩小后再手术。Ⅲ期患者或术后复发者则先化疗后,再对残留肿块可作放疗或手术综合治疗[9]。
TMGCTS的预后与肿瘤内的组织类型密切相关,生存期多为20~132个月,中位生存期为42个月[10]。如为畸胎瘤合并胚胎性癌或绒毛膜上皮癌,预后较差,合并精原细胞瘤则不影响预后。治疗过程中,要严密随访并监测AFP、HCG和血清乳酸脱氢酶(LDH)等指标,若持续升高或再次增高,往往提示肿瘤有残留、转移或复发,预后不良。本例患者随访6个月,AFP、HCG均正常,无肿瘤复发及转移。
[1]郭应禄.泌尿、男生殖系肿瘤[M].北京:人民卫生出版社,2000:396-407.
[2]叶定伟,方银忠,戴 波,等.睾丸肿瘤腹膜后淋巴结清扫术39例报告[J].中华泌尿外科杂志,2005,26(4):283-285.
[3]余明主,胡翔南,曾小明.睾丸混合性类癌1例报告并文献复习[J]. 东南国防医药,2009,11(5):445-446.
[4]葛文卿,浦金贤,平季根,等.睾丸生殖细胞肿瘤36例早期诊疗体会[J]. 中国误诊学杂志,2010,10(7):1688.
[6]丁全明,梁 伟,王 刚,等.睾丸混合性非精原细胞性生殖细胞癌1例并文献复习[J].中华男科学杂志,2010,16(10):925-927.
[7]徐振群,田保玲,詹运洪,等.1例睾丸未成熟型畸胎瘤伴精原细胞瘤的临床分析[J].中华男科学杂志,2011,17(2):177-178.
[8]Liguori G,Trombetta C,Bucci S,etal.Semen quality before and after orchiectomy in men with testicular cancer[J].Arch Ital Urol Androl,2008,80(3):99-102.
[9]胡礼炳,雷永虹,Makus Hohenfellner.2012年欧洲泌尿外科学会睾丸肿瘤诊疗指南解读[J].昆明医科大学学报,2012,(7):79-83.
[10]Albers P,AlbrechtW,Algaba F,etal.EAU guidelineson testicular cancer:2011 Update[J].Eur Urol,2011,60(2):304-319.

