紫山药低醇发酵饮料中乙醇含量的气相色谱法测定
,,,,,*
(1.天津商业大学生物技术与食品科学学院,天津 300134; 2.北京市农林科学院蔬菜研究中心,北京 100097; 3.北京市农林科学院农业综合发展研究所,北京 100097)
紫山药低醇发酵饮料中乙醇含量的气相色谱法测定
张红雨1,宋曙辉2,周家华3,刘建福1,周连第3,*
(1.天津商业大学生物技术与食品科学学院,天津 300134; 2.北京市农林科学院蔬菜研究中心,北京 100097; 3.北京市农林科学院农业综合发展研究所,北京 100097)
建立了紫山药低醇发酵饮料中乙醇含量的气相色谱检测方法。HP-INNOWAX(30m×0.25mm×25μm)毛细管柱为样品分析柱时,甲醇为样品的稀释剂;正丙醇可作为乙醇定量分析的内标物。甲醇、乙醇、正丙醇的出峰时间分别为2.909、3.110、3.846min,乙醇与正丙醇的分离度大于30。乙醇浓度在0.2~6.0mg/mL范围时,内标法测定的乙醇浓度与乙醇的峰面积的相关系数为0.9996,紫山药样品中乙醇的最低检出限为0.05mg/mL。该测定方法的乙醇回收率在94.4%~107.4%之间,重复性实验的相对标准偏差(RSD)为4.23%,可满足紫山药低醇发酵饮料中乙醇含量的测定要求。
气相色谱,紫山药低醇饮料,乙醇
紫山药(DioscoreaalataL.)是山药中的一个特色品种,因其块根紫色而得名。紫山药块根中含有大量的碳水化合物、蛋白质,还含有丰富的B族维生素、维生素C、粘蛋白、花青素、薯蓣皂等生理活性成分[1-4]。粘蛋白、花青素、薯蓣皂分别具有阻止血脂在血管壁的沉淀、抑制低密度脂蛋白(LDL)氧化、提高体内雌雄激素水平升高等生理功能,因此,经常食用紫山药可以降低心血管疾病发生的风险、延缓衰老、免疫调节、抗氧化等作用[5-6]。低醇发酵饮料是在保留果蔬汁原有营养的同时,运用生物发酵技术赋予其一定的发酵风味,并将乙醇的含量控制在较低水平的果蔬汁饮料[7-8]。紫山药中的淀粉经过糖化、发酵可以转化成酒精,发酵过程中产生浓郁的发酵香气。作者通过控制酒精发酵程度生产了低醇、花青素、薯蓣皂等多种生物活性物质的功能性紫山药饮料。快速、准确测定低醇发酵饮料中乙醇含量是实现低醇饮料可控发酵的关键。乙醇含量的测定方法较多,比重法常用于测定乙醇含量较高的样品如酒等。AOAC推荐采用重铬酸钾氧化法测定乙醇的含量。最近,Jonathan R. Dion报道了超声频率分析方法测定饮料中乙醇的含量[9],但该法需要宽频超能换声器,应用受到限制。气相色谱具有快速、准确、能测定样品中的微量成分等特点,为此,本文研究了低醇发酵饮料中乙醇含量的气相色谱检测方法。
1 材料与方法
1.1材料与仪器
紫山药低醇发酵饮料 自制;乙醇 色谱纯,CAS:64-17-5,西陇化工股份有限公司;甲醇 色谱纯,CAS:67-56-1,北京化工厂;正丙醇 色谱纯,CAS:71-23-8,天津市津科精细化工研究所。
Agilent 7890A气相色谱仪、FID检测器 美国AGILENT公司,Chemstation 化学工作站;7683B自动进样器 美国AGILENT公司;AG-1602型空气泵 北京科普生分析科技有限公司;HG-1803型高纯氢气发生器 北京科普生分析科技有限公司;HZ050R离心机 长沙湘仪离心机仪器有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科贸工有限公司;FB-10T溶剂过滤瓶 杭州汇尔仪器设备有限公司;LP503电子天平 精确至0.001g,常熟市衡器厂。
1.2实验方法
1.2.1 样品处理 将发酵后的样品在6000r/min转速下离心5min,得上清液,再将上清液抽真空过0.45μm微孔滤膜,置冰箱备用。取待测样品10mL于50mL容量瓶中,甲醇定容,再将待测定液在3000r/min下离心10min后过0.45μm有机滤膜,备用。
1.2.2 色谱条件 色谱柱:HP-INNOWAX毛细管柱(30m×0.25mm×25μm);FID检测器温度220℃,氢气流速为40mL/min,空气流速400mL/min,尾吹(N2)流速30mL/min;进样口温度200℃,分流比为20∶1;柱流速为1mL/min;柱温平衡时间0.5min,程序升温60℃(保持1min),以10℃/min升至120℃(保持1min);进样量1μL。
1.2.3 标准溶液配制与曲线绘制 标准储备液:准确称取乙醇10g(精确至0.001g)于100mL容量瓶中,用甲醇定容,得到浓度为100mg/mL储备液,置冰箱保存。外标法标准溶液配制:分别准确量取0.1、0.2、0.4、0.8、1.6、2.0、3.0mL标准储备液于50mL容量瓶中,用甲醇定容,得到一系列标准溶液0.2、0.4、0.8、1.6、3.2、4.0、6.0mg/mL。内标储备液:准确称取正丙醇10g(精确至0.001g)于100mL容量瓶中,用甲醇定容,得到浓度为100mg/mL的内标储备液,置冰箱保存。内标法标准溶液配制:与外标法取相同标准储备液,再分别加内标储备液0.5mL,用甲醇定容,得到相同的标准溶液,其中内标正丙醇的浓度为1mg/mL。将配制好的标准溶液置冰箱保存待用,按照上述色谱条件进行GC测定。
1.2.4 样品分析 在相同的气相色谱条件下,将标准溶液过0.45μm有机滤膜后进行测定。以保留时间定性,外标法和内标法两种方法进行定量,并选取最佳的定量方法来定量样品中乙醇的含量。
2 结果与分析
2.1稀释剂的选择
在样品稀释时,常用高纯水作为稀释剂。实验采用HP-INNOWAX毛细管柱,如果水作为稀释剂,由于水的膨胀系数很大,一般要求进样量在0.5μL以下,且进样口与FID的温度达到200℃以上,否则会造成毛细管柱的固定液的流失,减少柱子的使用寿命。为此选用甲醇作为样品的稀释剂,可以避免对毛细管柱的危害,同时实验发现甲醇与乙醇的分离度大于2,有很好的分离效果(见图1)。
2.2内标物的选择
在分析乙醇含量时,常用的内标物有甲醇、丙醇、丁醇以及乙酸正丁酯等。不同的样品采用不同的内标物,本文采用正丙醇作为乙醇的内标物,主要是考虑到:样品中不含有正丙醇;正丙醇结构与被测组分乙醇相似;不与乙醇发生化学反应;乙醇与正丙醇有很好的分离效果,实验中多次测试(n=8),其分离度均大于30。如图1、图2所示。
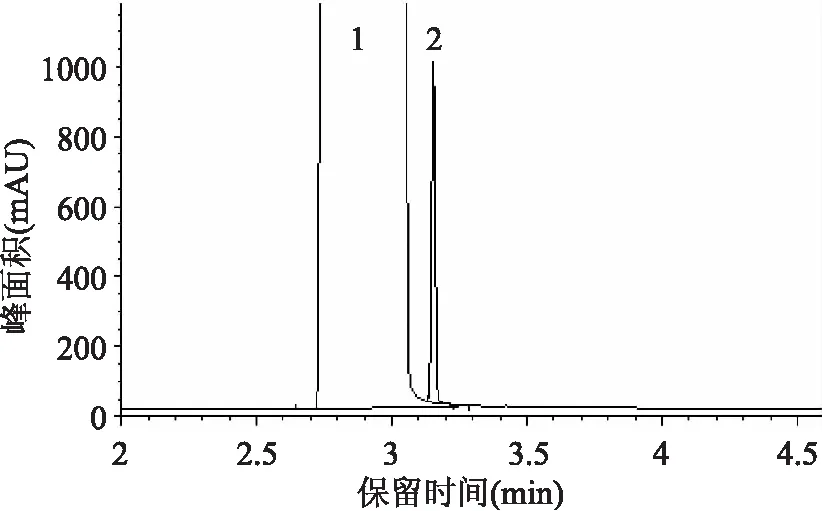
图1 未加内标物的样品图
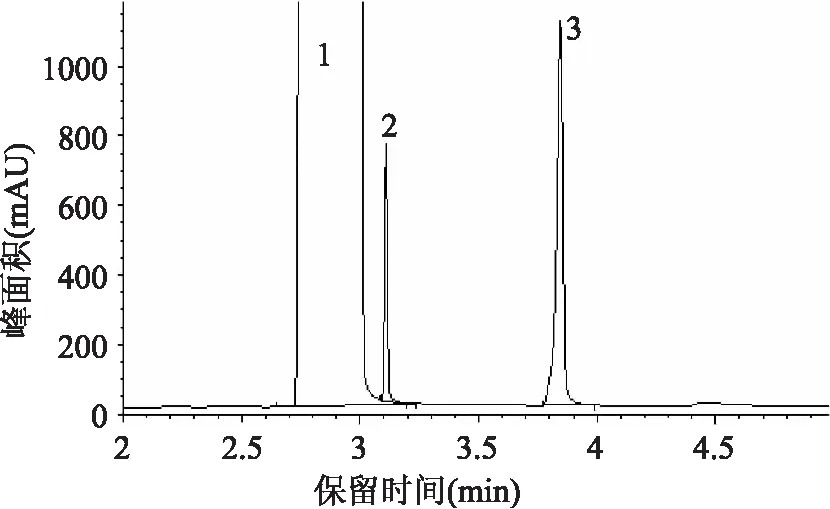
图2 加内标物的样品图
2.3定性分析
采用保留时间法定性,在上述的色谱条件下,进1μL样品所得色谱图,进样后甲醇在2.909min时出峰,乙醇在3.110min时出峰,正丙醇在3.846min出峰,见图3。

表1 精密度实验

表2 重现性实验
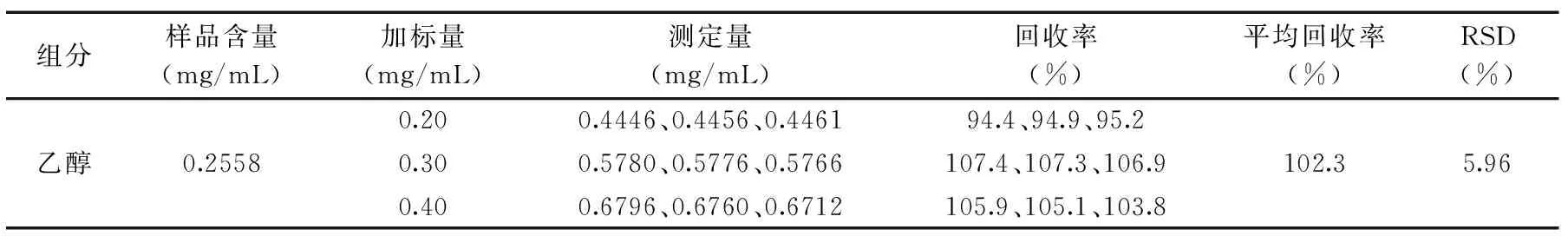
表3 回收率实验

图3 样品色谱图
2.4定量分析
按照上述的色谱条件测定乙醇的标准溶液,分别用外标法和内标法进行定量分析(见图4和图5)。乙醇浓度在0.2~6.0mg/mL范围内,采用外标法定量可得到标准曲线的相关系数R2为0.9828;采用内标法定量可得到标准曲线的相关系数R2在0.999以上,为此样品定量分析选用内标法。同时将紫山药样品经过前处理后测定,以3倍信噪比计算出仪器的检出限为0.01mg/mL。因为样品在检测前被稀释了5倍,所以紫山药样品中乙醇的最低检出限为0.05mg/mL。

图4 外标法标准曲线图
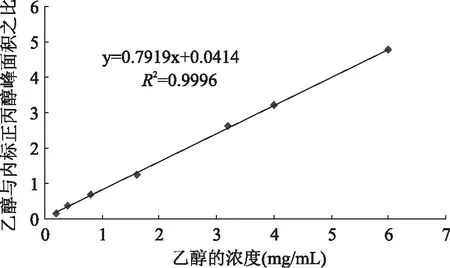
图5 内标法标准曲线图
2.5方法学考察
2.5.1 精密度实验 在确定的色谱条件下,将样品过0.45μm有机滤膜并连续测定6次,进行精密度考察。结果显示,精密度实验的相对标准偏差(RSD)为0.278%,表明该方法具有很好的精密度。
2.5.2 重现性实验 取同一批6份发酵后的样品,进行样品处理作重复性考察。结果显示,重复性实验的相对标准偏差(RSD)为4.23%,这表明此检测方法有较好的重现性。
2.5.3 回收率实验 准备已知浓度的饮料样品,分别加入不同体积的乙醇标准储备液,按照上面的GC方法做加样回收率实验,结果显示该方法的回收率在94.4%~107.4%之间,表明气相色谱法能较好的测定乙醇的含量。
3 结论
采用HP-INNOWAX毛细管柱,选择甲醇作为样品的稀释剂,正丙醇为定量测定乙醇的内标物,三者之间有较好的分离度,从而确定了内标法的定量方法。内标法定量具有良好的线性关系,相关系数在0.999以上。同时得到样品中乙醇的最低检出限为0.05mg/mL,重现性和精密度的相对标准偏差均小于5%,回收率在94.4%~107.4%之间。本方法定性、定量准确,可靠,准确度和回收率较高,可用于低醇发酵饮料中乙醇含量的测定。
[1]Zhongxiang Fang,Dan Wu,Dong Yu,etal. Phenolic compounds in Chinese purple yam and changes during vacuum frying[J]. Food Chemistry,2011,(128):943-948.
[2]于东,林跃伟,陈桂星,等. 紫山药营养成分分析研究[J]. 营养学报,2010,32(2):190-192.
[3]周新勇,宋曙辉,罗晖,等. 反相高效液相色谱法测定紫山药中薯蓣皂苷的含量[J]. 食品工业科技,2011,32(7):420-422.
[4]Liu Ying,Shi Shan-shan,Wang Cai-sheng. Determination of Nutrients and Diosgenin Contents Dioscorea batatas Decne.in zhejiang[J]. Medicinal Plant,2010,1(2):21-23.
[5]Jau-Tien Lin,Deng-Jye Yang. Determination of steroidal saponins in different organs of yam(Dioscorea pseudojaponica Yamamoto)[J]. Food Chemistry,2008(108):1068-1074.
[6]陈少青,蒋旭钢,汪财生,等. 紫山药多糖超声波辅助提取工艺优化及抗氧化性能研究[J]. 江苏农业科学,2009(5):231-234.
[7]谭余良,杨幼慧. 无醇及低醇发酵果汁研究进展[J]. 中国酿造,2006(5):1-3.
[8]Branyik T,Silva D P,Baszczynski M,etal. A review of methods of low alcohol and alcohol-free beer production[J]. Journal of Food Engineering,2012(108):493-506.
[9]Jonathan R Dion,David H Burns. Simultaneous determination of alcohol and carbohydrate content in commercial beverages by ultrasound frequency analysis[J]. Talanta,2011(86):384-392.
Determination of alcohol in purple yam low-alcohol fermented beverage by gas chromatography
ZHANGHong-yu1,SONGShu-hui2,ZHOUJia-hua3,LIUJian-fu1,ZHOULian-di3,*
(1.Institute of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China; 2.Beijing Vegetable Research Center of BAAFS,Beijing 100097,China; 3. Institute of Agricultural Integrated Development of BAAFS,Beijing 100097,China)
A method for gas chromatography determinnation of alcohol content in purple yam low-alcohol femented beverages was reported in this paper. The samples were separated on HP-INNOWAX(30m×0.25mm×25μm)capillary column. Methanol was chosen as the diluent and the n-propanol was used as the standard substance. Results showed that the peak time of methanol,ethanol and n-propanol was 2.909,3.110 and 3.846min,respectively. And the degree of separation for ethanol and n-propanol was more than 30. The linear range was 0.2~6.0mg/mL with a correlation of 0.9996,and the detection limits were 0.05mg/mL for alcohol in purple yam. Recoveries varied from 94.4%~107.4%,and the relative standard deviation(RSD)of the repetitive experimental was 4.23%. This method developed could be used to detect alcohol content in purple yam low-aocohol femented beverages.
gas chromatography;purple yam low-alcohol beverages;alcohol
2013-05-20 *通讯联系人
张红雨(1989-),女,在读硕士研究生,研究方向:发酵工程。
北京市农林科学院科技创新能力建设专项。
TS278
:A
:1002-0306(2014)01-0307-04

