微波辅助萃取-气相色谱法测定农用地膜中的邻苯二甲酸酯类增塑剂
,,,,*
(1.青岛农业大学化学与药学院,山东青岛 266109; 2.青岛农业大学资源与环境学院,山东青岛 266109)
微波辅助萃取-气相色谱法测定农用地膜中的邻苯二甲酸酯类增塑剂
綦敬帅1,宋吉英1,史衍玺2,吕海涛1,*
(1.青岛农业大学化学与药学院,山东青岛 266109; 2.青岛农业大学资源与环境学院,山东青岛 266109)
建立了采用微波辅助萃取-气相色谱法同时测定农用地膜中6种邻苯二甲酸酯类(PAEs)增塑剂含量,消除了常见软化剂棕榈酸对测定的干扰。选择丙酮作为提取溶剂,通过单因素和正交实验对样品的提取条件进行优化。研究表明:在3.0~200.0mg/L线性范围中,方法具有良好的线性关系,其相关系数均大于0.999,检测限0.15~0.60mg·kg-1,平均回收率97.2%~104.8%,相对标准偏差0.51%~2.35%。该方法简单高效,具有良好的重现性和灵敏度,适用于塑料地膜中邻苯二甲酸酯类增塑剂的分析检测。
微波萃取,气相色谱,邻苯二甲酸酯,农用地膜,正交分析
近年来,增塑剂作为食品及食品相关产品安全问题被国内外所关注[1]。因其具有优秀的理化特性和与聚合物的相容性以及低廉的成本[2],作为一种高分子材料助剂被广泛用于增加塑料等制品的柔韧性、降低其加工温度及加工难度,其应用涉及农业食品用棚膜材料、食品包装材料[3]、纺织品、化妆品、塑料玩具[4]等各类材料。近年来,越来越多研究表明,邻苯二甲酸酯(phthalic acid esters,PAEs)存在慢性毒性,如对组织病理学方面、血液和生物化学方面的影响以及其潜在的致突变作用、致癌作用、生殖与发育毒性[5]。但增塑剂的不正当添加,以及将其作为替代品用于其他用途,使增塑剂在日常生活中变得无处不在[6]。许多国家开始限制和规范其应用,并出台相关政策,诸如欧盟2009/48/EC 指令[7]、《美国消费品安全加强法》(CPSIA)[8]等。美国国家环保局(EPA)将邻苯二甲酸二甲酯、邻苯二甲酸二乙酯、邻苯二甲酸二丁酯、邻苯二甲酸二辛酯、邻苯二甲酸二(2-乙基己基)酯和丁基苄基酯6种增塑剂列为优先控制的有毒污染物;我国已将邻苯二甲酸二丁酯、邻苯二甲酸二甲酯和邻苯二甲酸二辛酯3种增塑剂确定为环境优先控制污染物。欧盟永久禁止在玩具和儿童护理用品中使用含量超过 0.1%的邻苯二甲酸二(2-乙基己基)酯、邻苯二甲酸二丁酯和丁基苄基酯3种增塑剂。在我国,农业种植蔬菜、粮食等农作物中,地膜有着广泛的应用,被用于提高土壤温度,保持土壤水分,维持土壤结构。地膜材料中存在的邻苯二甲酸酯类增塑剂,由于与塑料基质间非化学键相连,使其得已保持独立的化学性质而极易直接污染所种植的蔬菜、粮食,或通过对土壤、大气以及水体的迁移对作物造成间接污染[9]。常用荧光光度法[10]、气相色谱法[11]、液相色谱法[12]、气质联用[13-14]、液质联用[15]、胶束电动毛细管色谱[16]等方法检测增塑剂的含量,但目前地膜中增塑剂的检测报道尚不多见。本文探讨了以丙酮作为萃取试剂,采用微波辅助萃取-气相色谱法提取、测定地膜中上述6种邻苯二甲酸脂类增塑剂。该方法简单高效,稳定可靠,可满足对农用地膜中对邻苯二甲酸酯类化合物的检测。

表1 单因素实验
1 材料与方法
1.1材料与仪器
地膜 山东省青岛市城阳区当地农贸市场;邻苯二甲酸二甲酯(99.5%,DMP,CAS:131-11-3)、邻苯二甲酸二乙酯(99.5%,DEP,CAS:84-66-2)、邻苯二甲酸二丁酯(99.5%,DBP,CAS:84-74-2)、邻苯二甲酸丁酯苯甲酯(98%,BBP,CAS:85-68-7)、邻苯二甲酸二(2-乙基己)酯(99%,DEHP,CAS:117-81-7)、邻苯二甲酸二正辛酯(99%,DnOP,CAS:117-84-0) 德国Dr.Ehrenstorfer公司;丙酮、乙酸乙酯、正己烷、三氯甲烷、甲苯、乙醚、甲醇、乙醇、氢氧化钠、碳酸氢钠、碳酸钠 均为分析纯,国药集团化学试剂有限公司;实验过程中所使用的试剂如丙酮、正己烷、乙酸乙酯、乙醇等等均经过二次蒸馏。
岛津GC-2014C色谱仪 日本岛津公司;毛细管色谱柱,HP-5MS,30.0m×0.25mm×0.25μm 美国Agilent科技有限公司;DZX-1 型真空干燥箱 上海福玛实验设备有限公司;SHA-B 水浴恒温摇床仪 江苏省金坛市荣华仪器制造有限公司;RE-52AA 旋转蒸发仪 上海亚荣生化仪器厂;SHB-II 循环水式多用真空泵 郑州长城科工贸有限公司;DF-II 集热式恒温磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;RQ-700DV 超声波萃取仪 昆山市超声仪器有限公司;TDL-50B 微波合成萃取仪 北京祥鹄科技有限公司;AR2140 电子分析天平 上海奥斯豪国际工贸公司。
实验用玻璃仪器在使用前于碱液中浸泡12h,用超纯水洗净,最后分别使用重蒸丙酮与正己烷清洗,烘干。
1.2标准工作液的配制
精确称取6种PAEs增塑剂标准品各500.0mg,溶于乙酸乙酯,定容,配制成1g/L的邻苯二甲酸酯增塑剂混合标准储备液,置于冰箱4℃避光保存。采用二倍稀释,将储备液用乙酸乙酯稀释为3.0~200.0mg/L浓度梯度,供绘制标准曲线用。
1.3样品的前处理
精确称取2.0g地膜样品(0.5cm×1.0cm)于250mL圆底烧瓶内,加入40mL重蒸丙酮,置于微波萃取仪,设定萃取功率1000W,萃取温度56℃,萃取时间6min,萃取1次。过滤,合并滤液,旋转蒸干。溶于正己烷,移入125mL分液漏斗,加入20mL 0.1mol/L NaOH溶液,振荡3min。取上层溶液旋转蒸干,加入2mL乙酸乙酯溶解,使用0.45μm有机滤头过滤后,进行气相色谱测定。
1.4气相色谱(GC)条件
色谱柱:HP-5MS(30m×0.25mm×0.25μm);检测器为氢火焰离子化检测器;进样口温度:300℃;进样方式:不分流;进样量:1μL;检测器温度:300℃;升温程序:起始温度60℃,保持1min;以20℃/min的速度升至210℃,保持2min;再以5℃/min的速度升至300℃,保持2min。
1.5单因素实验
单因素实验条件包括微波萃取时间、微波萃取功率、萃取次数、料液比(m样品:V丙酮)、地膜的破碎程度,实验内容见表1。精确称取2.0g地膜样品,按表1所述条件、前文所述实验步骤进行提取、分析,进行5次平行实验取平均值。
1.6正交实验
在单因素实验的基础上,选取微波萃取次数(A)、萃取时间(B)、地膜破碎程度(C)、料液比(D)、微波萃取功率(E)为考察因素,以实际地膜样品中DBP和DEHP的提取程度为考察指标,设计五因素四水平正交实验,见表2。
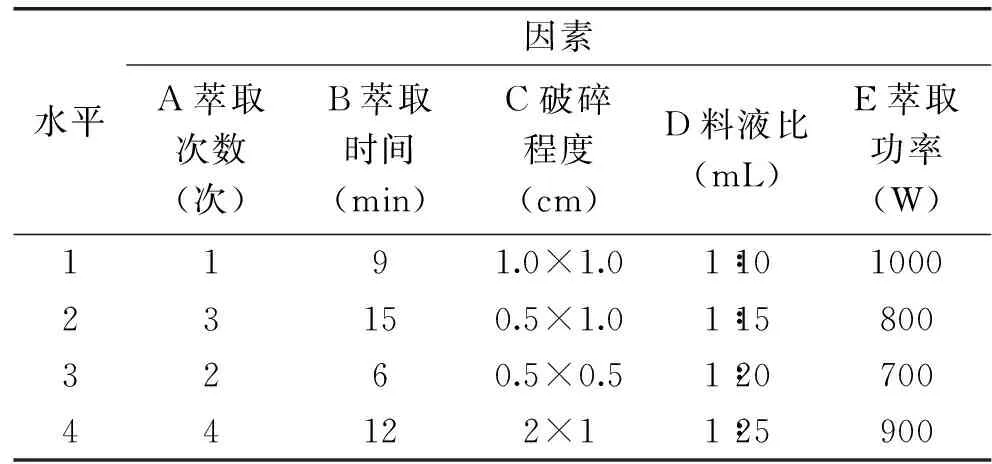
表2 优化PAEs类增塑剂萃取条件因素水平表

表3 6种PAEs类增塑剂的保留时间、线性方程、相关系数及检出限
2 结果与分析
2.1邻苯二甲酸酯类增塑剂的分离测定
对6种邻苯二甲酸酯类化合物进行了测定,图1为混合标准溶液以及实际样品的气相色谱图。由图1可知,实验所检测的6种邻苯二甲酸酯类增塑剂的峰形以及分离效果良好,能够满足分析的要求。
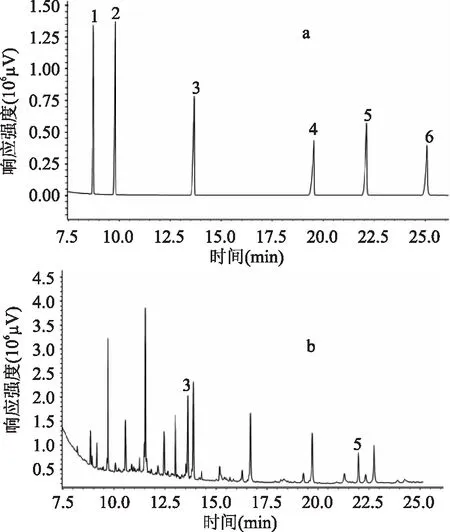
图1 邻苯二甲酸酯类增塑剂气相色谱图
2.2方法的线性关系、相关系数及检出限
配制1~200mg/L浓度梯度的混合标准溶液用来绘制标准曲线,每一梯度平行进样5次,以平均值做线性回归分析。从表3可以看出,在3.0~200.0mg/L线性范围中,6种增塑剂均有着良好的线性关系,相关系数大于0.999,检出限在0.15~0.60 mg·kg-1之间,优于文献检出限[11]。
2.3地膜中软化剂棕榈酸的去除
地膜生产过程中常添加棕榈酸(CAS:57-10-3)作为软化剂。本实验在检测多种地膜样品中,发现有干扰成分与邻苯二甲酸二丁酯(DBP)重合,经GC-MS分析,该干扰杂质为棕榈酸,需提前除去。由于棕榈酸中有羧基存在,可以考虑加入碱性试剂进行中和,使其成盐,通过萃取的方式去除。
通过考察20mL 0.1mol/L的氢氧化钠、饱和碳酸钠、碳酸氢钠等试剂对棕榈酸的去除能力,发现使用NaOH后,经GC-MS分析,棕榈酸已经消除干净。
为确保PAEs类增塑剂不会因为NaOH的添加而发生水解现象,分别考察碱液体积(10、20、30、40mL)、提取次数(1、2、3、4次)的影响,每个水平重复3次取平均值,实验结果见表4和表5,选择使用20mL NaOH溶液对样品溶液萃取1次,待测增塑剂无明显水解,且通过GC-MS谱图分析棕榈酸干扰被去除。
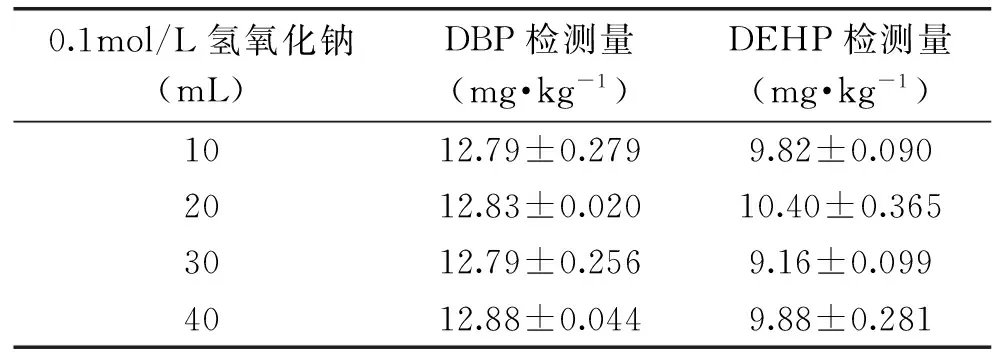
表4 不同体积的碱液对PAEs类增塑剂水解的影响
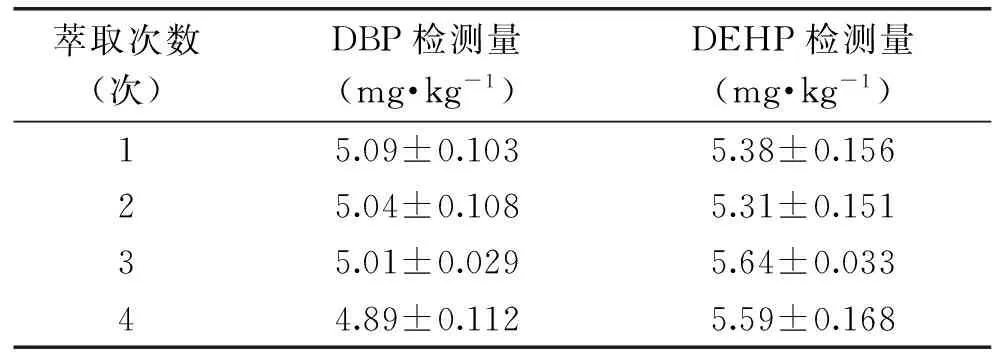
表5 萃取次数对PAEs类增塑剂水解的影响
2.4提取溶剂的选择
考察了丙酮、甲醇、乙醇、乙酸乙酯、氯仿、正己烷、乙醚以及正己烷与丙酮的混合溶液(V/V=1∶1)8种提取试剂对于含有DBP以及DEHP两种增塑剂的实际地膜样品的提取能力,进行5次平行实验取平均值,其结果见图2,可知丙酮对于DBP和DEHP的提取能力最强。因此本实验选用丙酮作为提取试剂。

图2 不同提取试剂对地膜中PAEs类增塑剂提取的影响
2.5提取方法的选择
分别使用了微波萃取法、索氏提取法(150mL丙酮提取试剂,提取时间120min,提取温度80℃)、常温振荡法(40mL丙酮提取试剂,提取120min,摇床转速126转/min)、超声波提取法(40mL丙酮提取试剂,超声30min,室温26℃)和加热回流法(40mL丙酮提取试剂,提取时间120min,提取温度80℃)对实际地膜样品进行了提取测试,实验重复5次取平均值,结果见图3。索氏提取法和微波萃取法对DBP和DEHP提取效果更好,但考虑索氏提取法使提取时间较长,速度较慢,因此本实验选用微波萃取法进行提取。

图3 不同提取方法对地膜中PAEs类增塑剂提取的影响
2.6提取条件的优化
2.6.1 单因素实验结果
2.6.1.1 微波萃取时间对提取效果的影响 由图4可见,3~7min时,DBP与DEHP的提取量随着微波萃取时间的增加而增加,7min时,增塑剂提取量最大,7~20min,DBP与DEHP二者的提取量基本不再变化,趋于稳定。
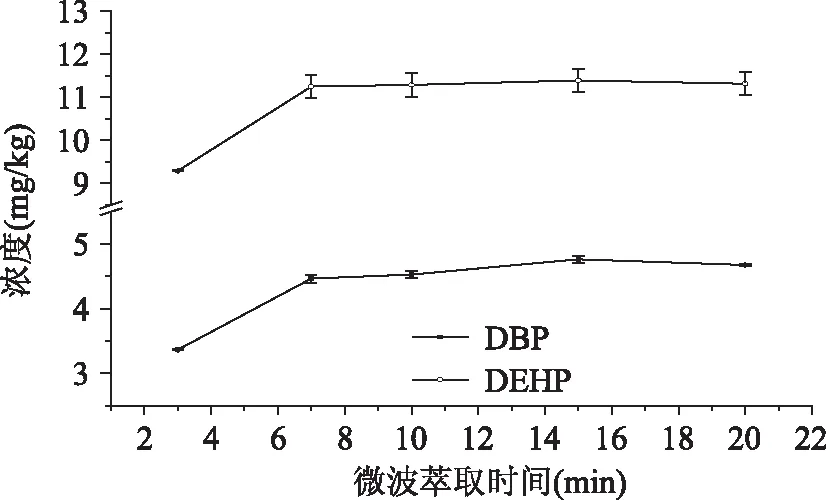
图4 微波萃取时间对提取效果的影响
2.6.1.2 料液比对提取效果的影响 由图5可见,随着丙酮量的增加,DBP与DEHP的变化趋势基本相同,提取量逐渐增加,分别至料液比为1∶20、1∶25时达到最高值,以后趋于平缓。
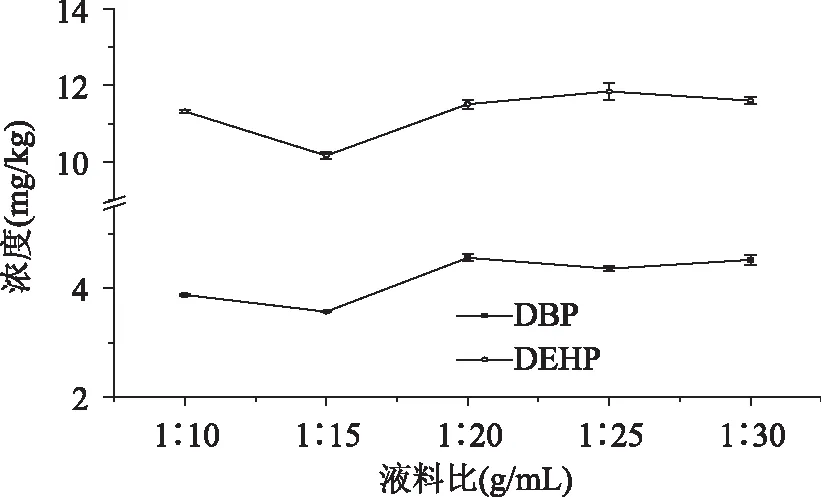
图5 料液比对提取效果的影响
2.6.1.3 地膜破碎程度对提取效果的影响 由图6可见,不同的地膜破碎程度对DBP的提取量影响较小,最高值在破碎程度为1.0cm×0.5cm时出现,而DEHP的提取量波动较大,1.0cm×0.5cm与2.0cm×1.0cm这两种大小明显高于其余几种,最高值在2.0cm×1.0cm出现。

图6 地膜破碎程度对提取效果的影响
2.6.1.4 微波萃取次数对提取效果的影响 由图7可见,微波萃取次数对于地膜样品中DBP与DEHP的提取效果有相同的变化趋势,提取量随着萃取次数的增加而增加,当萃取次数达到2次后,增塑剂的提取量基本稳定。
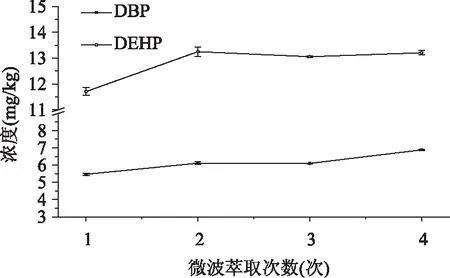
图7 微波萃取次数对提取效果的影响
2.6.1.5 微波萃取功率对提取效果的影响 由图8可见,随着微波萃取功率的增加,DBP和DEHP的提取量有增加的趋势,DEHP随功率增加波动比较大,到700W后趋于平缓。DBP提取量的波动较为平缓,随着功率的增加,提取量基本稳定。

表6 正交实验结果

图8 微波萃取功率对提取效果的影响
2.6.2 增塑剂提取的正交分析 本实验对含有DBP和DEHP的地膜样品进行五因素四水平的正交分析,正交实验结果见表6~表7。

表7 PAEs类增塑剂提取条件优化方差分析表
由表6正交实验直观分析可知,各因素对DBP的提取量影响顺序为:A>B>C>D>E;各因素对DEHP的提取量影响顺序为:A>C>B>D>E。由表7可知,统计学分析五个因素中,微波萃取次数为影响DBP和DEHP提取量显著性因素,综合考虑得出最佳提取条件为:A1B3C2D3E4,即将地膜样品破碎至1cm×0.5cm,丙酮40mL,微波功率900W,萃取6min,萃取1次。依照上述最优条件进行验证实验,重复5次取平均值,得到DBP提取量为(8.46±0.176)mg·kg-1,DEHP提取量为(10.48±0.121)mg·kg-1,实验结果高于正交设计实验的最高提取量,表明提取方法稳定可靠。
2.7加标回收率及相对标准偏差
选取三种浓度对样品进行加标回收率分析,同时对加标地膜样品6次测定计算RSD值,结果见表8。所得6种增塑剂的回收率在97.2%~104.8%之间,相对标准偏差为0.51%~2.35%之间,符合本实验的实验要求。
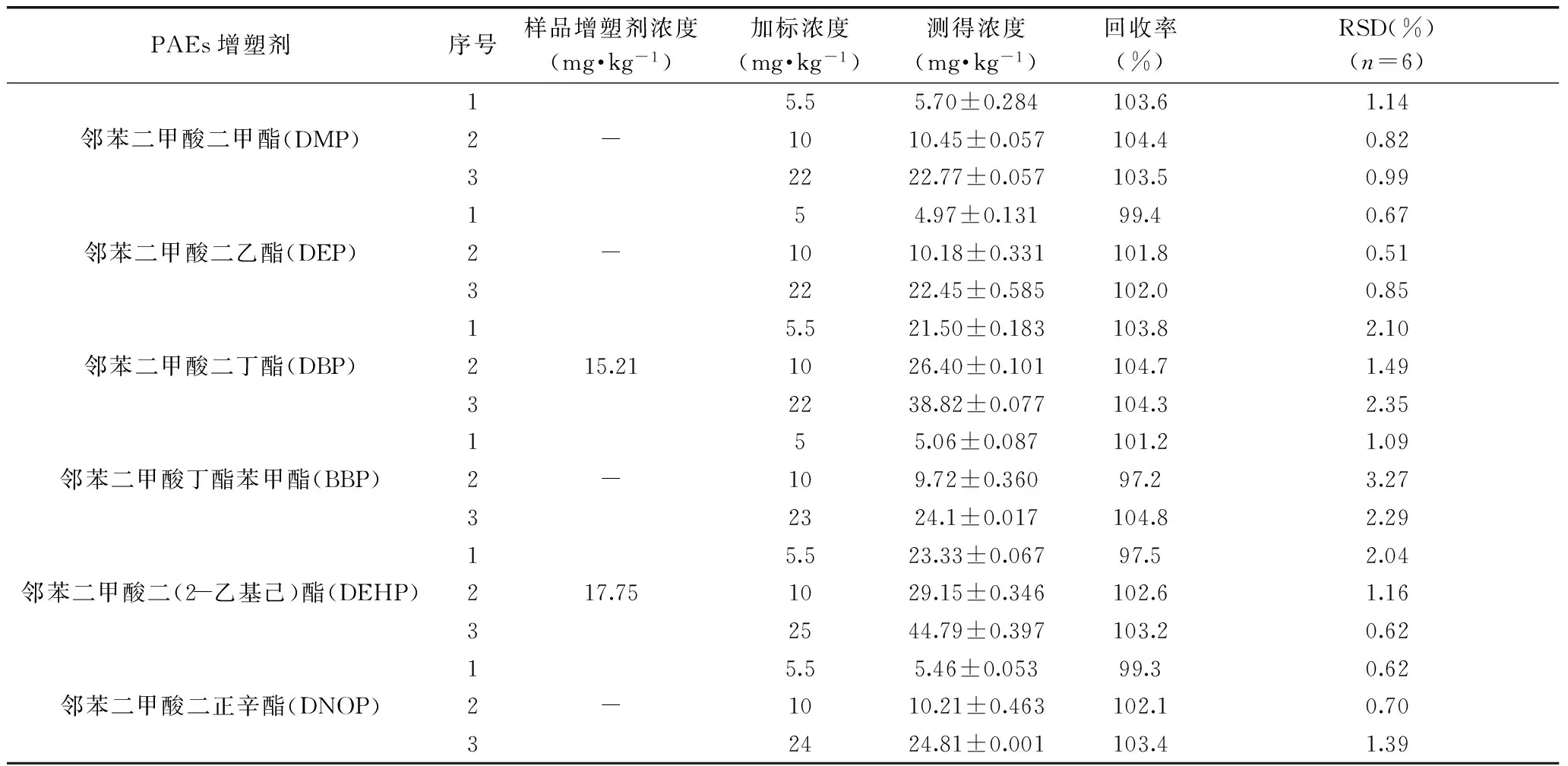
表8 加标回收率、相对标准偏差分析结果
注:“-”:样品中检测不到该种邻苯二甲酸酯类化合物。

表9 实际地膜样品分析
2.8实际地膜样品分析
依照上述实验所建立的方法对市场中购买的地膜样品进行检验,每个样品重复检测5次取平均值,在检验的5种地膜样品中,检出的增塑剂种类主要为DBP及DEHP,含量如表9所示,同时抽样的5个样品中只有1份样品不含所检测的6种PAEs类增塑剂。
3 结论
本实验采用微波辅助萃取-气相色谱法同时测定地膜材料中6种邻苯二甲酸酯类增塑剂,消除了棕榈酸对实验的影响,使用丙酮作为萃取试剂,检测的PAEs增塑剂包括DMP、DEP、DBP、BBP、DEHP、DNOP 6种,检出限0.15~0.6mg·kg-1,回收率97.2%~104.8%,相对标准偏差0.51%~2.35%。该方法高效,且操作简单,在3.0~200.0mg/L线性范围中,具有良好的线性,检测限符合分析要求。
在对实际地膜样品中的邻苯二甲酸酯类化合物进行检测的过程中,发现其普遍含有DBP及DEHP,在农作物种植过程中会造成一定食品安全隐患。
[1]陈惠,汪瑗,朱若华,等. 两种色谱法对塑料食品包装袋中邻苯二甲酸酯类化合物的分析[J]. 分析实验室,2006,25(4):45-49.
[2]López-Jiménez F,Rubio S,Pérez-Bendito D. Determination of phthalate esters in sewage by hemimicelles-based solid-phase extraction and liquid chromatography-mass spectrometry[J]. Analytica Chimica Acta,2005,551(1-2):142-149.
[3]Inoue K,Kawaguchi M,Okada F,etal. Column-switching high-performance liquid chromatography electrospray mass spectrometry coupled with on-line of extraction for the determination of mono-and di-(2-ethylhexyl)phthalate in blood samples[J]. Anal Bioanal Chem,2003,375(4):527-533.
[4]陈珠灵,陈飞,林向成,等. 塑料玩具中邻苯二甲酸酯类环境激素检测方法研究[J]. 环境科学与技术,2010,33(1):116-118.
[5]赵文红,厉曙光,蔡智鸣,等. 酞酸酯类增塑剂毒理研究进展[J]. 环境与职业医学,2003,20(2):135-138.
[6]蒋平平,张书源,祁丹,等. 塑化剂风波与增塑剂行业对策[J]. 塑料助剂,2011(4):1-5.
[7]The European Parliament and of the Council.Directive 2009/48/EC of 18 June 2009 on the safetv of tovs[EB/OL]. Official Journal of the European Union,2009,L170:l-37[2009-6-30].
[8]Consumer Product Safety Improvement Act of 2008,CPSIA 2008)[S].
[9]于立红,于立河,王鹏,等. 地膜中邻苯二甲酸酯类化合物及重金属对土壤-大豆的污染[J]. 干旱地区农业研究,2012,30(1):43-47,60.
[10]李满秀,王华燕. 荧光法测定环境样品中的邻苯二甲酸酯[J]. 分析化学,2005,33(9):1315-1317.
[11]庞世敏,袁敏,赵桂兰,等. 气相色谱法测定邻苯二甲酸酯类增塑剂的研究[J]. 华南师范大学学报(自然科学版),2010,(4):70-74.
[12]陆敏,冯海燕,陨海丽,等. 浊点萃取-高效液相色谱测定一次性塑料袋中邻苯二甲酸酯类化合物[J]. 塑料工业,2013,41(1):79-82.
[13]刘俊,朱然,田延河,等. 气相色谱-质谱法对食品包装材料中邻苯二甲酸酯类与己二酸酯类增塑剂的同时测定[J]. 分析测试学报,2010,31(6):925-929.
[14]何芃. 气相色谱-质谱法同时测定橡塑材料中18种邻苯二甲酸酯类增塑剂[J]. 塑料工业,2010,38(9):60-64.
[15]杨荣静,卫碧文,高欢,等. 高效液相色谱-串联质谱法检测食品接触材料中的17种邻苯二甲酸酯类增塑剂[J]. 环境化学,2012,31(2):95-100.
[16]陈惠,贾蕊,贾丽,等. 胶束电动毛细管色谱测定塑料食品包装袋中邻苯二甲酸酯类化合物的研究[J]. 分析科学学报,2007,23(1):21-24.
Determination of phthalate plasticizers in mulch by microwave assisted extraction-gas chromatography
QIJing-shuai1,SONGJi-ying1,SHIYan-xi2,LVHai-tao1,*
(1.College of Chemistry and Pharmaceutical Sciences,Qingdao Agricultural University,Qingdao 266109,China; 2.College of Resource and Environment,Qingdao Agricultural University,Qingdao 266109,China)
A method was established for the determination of 6 phthalate plasticizers in mulch by microwave extraction-gas chromatography. Palmitic acid was eliminated,which was often used as softener and affected the separation of phthalate plasticizers. Samples were extracted by microwave extraction with acetone as the solvent,and the extraction conditions were optimized by single factor and orthogonal analysis. The results showed that the linear correlation coefficients were over 0.999 in the range of 3.0~200.0mg/L,the recoveries were 97.2%~104.8%,the relative standard deviations were 0.51%~2.35%,and the detection limits were 0.15~0.60mg·kg-1. This method was simple,sensitive and repeatable,which was suitable for the determination of phthalate plasticizers in mulch.
microwave extraction;gas chromatography;phthalates;mulch;orthogonal analysis
2013-06-27 *通讯联系人
綦敬帅(1989-),男,在读硕士研究生,主要从事色谱分析方面的研究。
山东省“黄蓝两区”建设专项资金(2011-黄-19)。
TS207
:A
:1002-0306(2014)01-0289-07

