响应面法优化纤维素酶提取独活蛇床子素工艺的研究
,,,,, ,, ,,*
(1.中国科学院近代物理研究所,甘肃兰州 730000; 2.中国科学院大学,北京 100049;3.兰州军区兰州总医院安宁分院,甘肃兰州 730070; 4.西藏自治区农牧科学院畜兽医研究所,西藏拉萨 850009)
响应面法优化纤维素酶提取独活蛇床子素工艺的研究
赵美荣1,2,李雪虎1,刘耀明3,姚海潮4,陆锡宏1,周翔1,辛志君1,色珠4,梁剑平1,*
(1.中国科学院近代物理研究所,甘肃兰州 730000; 2.中国科学院大学,北京 100049;3.兰州军区兰州总医院安宁分院,甘肃兰州 730070; 4.西藏自治区农牧科学院畜兽医研究所,西藏拉萨 850009)
采用响应面分析法(RSM)优化纤维素酶提取蛇床子素的工艺条件。在单因素实验的基础上,选取酶解pH、纤维素酶量、酶解时间、酶解温度作为影响因子,以蛇床子素得率为响应值,利用Box-Benhnken中心组合设计原理,研究各自变量及其交互作用对得率的影响,模拟得到二次多项式回归方程的预测模型,确定最佳提取条件为:酶解pH为5.0,酶解时间60min,酶解温度50℃,纤维素酶量3%。在此优化工艺条件下,蛇床子素的得率为0.926%。
独活,蛇床子素,纤维素酶提取,BBD
独活是伞形科植物重齿毛当归的干燥根[1],其主要功能有祛风除湿、通痹止痛的功效。现代药理研究表明,香豆素类化合物为其主要有效部位之一,其中又以蛇床子素的含量最高[2-3],具有抗炎[4]、抗肿瘤[5]、抗焦虑[6]等作用。如何高效地提取蛇床子素对于独活的新药开发具有重要作用。蛇床子素的提取一般采用传统的乙醇回流法[7],该方法简便易行,设备要求低,但是操作时间长,提取效率低。纤维素酶提取方法具有操作简便快捷、绿色无污染、提取效率高[8-10]等特点,已应用到了有效成分的提取中[11]。本实验首次采用纤维素酶提取独活蛇床子素,优化提取其最佳工艺参数,旨在为其产品的开发与利用提供有力的理论依据和技术支持。
1 材料与方法
1.1材料与仪器
独活 西藏农科院提供,由兰州大学第二附属医院王晓飞博士鉴定;乙腈色谱纯;甲醇色谱纯;乙醇,醋酸,醋酸钠,去离子水;其余试剂均为分析纯;蛇床子素对照品 中国药品生物制品检定所。
高效液相色谱仪 美国Waterse2695;DFT-250手提式高速万能粉碎机 温岭市林大机械有限公司;旋转蒸发仪 巩义市予华仪器有限责任公司;Pine-tree纯水机 北京湘顺源科技有限公司。
1.2实验方法
1.2.1 蛇床子素含量的测定
1.2.1.1 色谱条件 蛇床子素含量的测定参考邹继红等方法[12-14]。色谱柱AgilentEclipseXDB-C18(4.6mm×150mm,5μm),流动相为乙腈-水(65∶35),体积流量1.0mL/min;检测波长322nm;柱温25℃;进样体积20μL;等度洗脱。
1.2.1.2 标准曲线的绘制 精密称取蛇床子素对照品适量,加甲醇溶解制成1.0mg/mL的溶液。分别精密吸取不同体积的对照品溶液,依次稀释成不同浓度的系列溶液:蛇床子素0.025、0.05、0.1、0.15、0.25、0.30、0.35mg/mL溶液。按上述色谱条件,各精密吸取溶液20μL,注入高效液相色谱仪。
1.2.2 独活蛇床子素的提取流程及测定 原料粉碎过40目筛,精密称取独活样品1.0g,置于三角瓶中,首先加入一定量的对应pH的醋酸-醋酸钠缓冲液,然后加入一定质量的酶、在一定温度下提取一定时间后,将提取液离心,收集上清液,定容到20mL,用0.45μm的微孔滤膜过滤。精密吸取供试品溶液20μL,注入液相色谱仪,根据标准曲线回归方程计算样品中蛇床子素的质量浓度。
蛇床子素的得率公式:
式中,Y:样品中蛇床子素的得率(%);ρ:根据标准曲线求出的样品浓度(μg/mL);V:样品定容后的体积(mL);m:独活原料的质量(g)。
1.2.3 单因素实验 在纤维素酶用量3%、酶解时间60min、酶解温度50℃的条件下,考察不同酶解pH对蛇床子素得率的影响;在酶解pH5.0、纤维素酶用量3%、酶解温度40℃的条件下,考察不同酶解时间对蛇床子素得率的影响;在酶解pH5.0、纤维素酶用量3%、酶解时间60min的条件下,考察不同酶解温度对蛇床子素得率的影响;在酶解pH5.0、酶解温度50℃、酶解时间60min的条件下,考察不同纤维素酶添加量对蛇床子素得率的影响。
1.2.4 响应面实验设计 在单因素实验基础上,根据Box-Behnken中心组合设计原理[15],选取酶解pH、纤维素酶用量、酶解时间、酶解温度为主要考察因素,以蛇床子素的得率作为评价指标,采用4因素3水平的Box-Behnken实验方法对提取条件进行优化。实验因素水平设计见表1。

表1 Box-Behnken设计因素水平
2 结果与分析
2.1蛇床子素对照品及供试品含量测定
在上述色谱条件下,得到蛇床子素对照品和供试品的色谱图,如图1。分别测定不同浓度对照品的峰面积,以色谱峰面积(Y)对各质量浓度(X)进行线性回归,得回归方程Y=81546X-122060(R2=0.9952),线性范围25~350μg/mL,呈良好的线性关系。

图1 蛇床子素对照品与样品的高效液相色谱图
2.2单因素实验结果与分析
图2a为酶解pH对蛇床子素得率的影响。随着酶解pH的不断升高,蛇床子素得率呈现逐渐增大的趋势,pH超过5.0后,得率下降,在pH5.0时得率达到最高。这是因为过高或过低的pH环境都会影响酶的活性,从而影响蛇床子素的得率。故选择酶解pH为5.0。
图2b为酶解时间对蛇床子素得率的影响。在60min时,蛇床子素的得率达到最高。超过60min后,得率趋于平缓。这是由于随着提取时间的延长,酶解反应进行更充分,蛇床子素不断从细胞溶出,进入溶液,得率升高。因此,酶解时间定为60min。
图2c为酶解温度对蛇床子素得率的影响。蛇床子素的得率随着温度的升高而逐渐增大,并在50℃时达到一个最高值。随后,随着温度的不断升高,其得率有所降低。蛇床子素为内酯环结构,易被水解和氧化[16]。提取过程中过高的温度有可能造成有效成分的降解。综合考虑,酶解温度为50℃为宜。
图2d是纤维素酶添加量对蛇床子素得率的影响图。从图中可以看出,纤维素酶在1%~3%时,蛇床子素的得率变化明显,达到3%以后,得率随着纤维素添加量的增大而降低。这是由于在开始阶段,酶的添加量未达到最佳值,酶促反应不完全;达到最佳值时,酶促反应进行的完全,得率达到最大;因此,选择3%的纤维素酶添加量比较合适。

图2 酶解pH、酶解时间、酶解温度、 纤维素酶添加量对蛇床子素得率的影响
2.3响应面优化实验
2.3.1 响应面实验设计及结果 以酶解pH(X1)、酶解时间(X2)、酶解温度(X3)、纤维素酶量(X4)为自变量,以蛇床子素得率为响应值(Y),根据相应的方案进行实验,通过Box-Behnken设计,总共有29组实验用于优化蛇床子素的提取条件,具体条件如表2所示。
使用Design Expert 7.0软件以 X1、X2、X3、X4为自变量,以蛇床子素得率为响应值(Y),根据相应的方案进行实验,将实验数据进行多元回归拟合,得到以蛇床子素得率(Y)为目标函数的二次回归方程模型为:

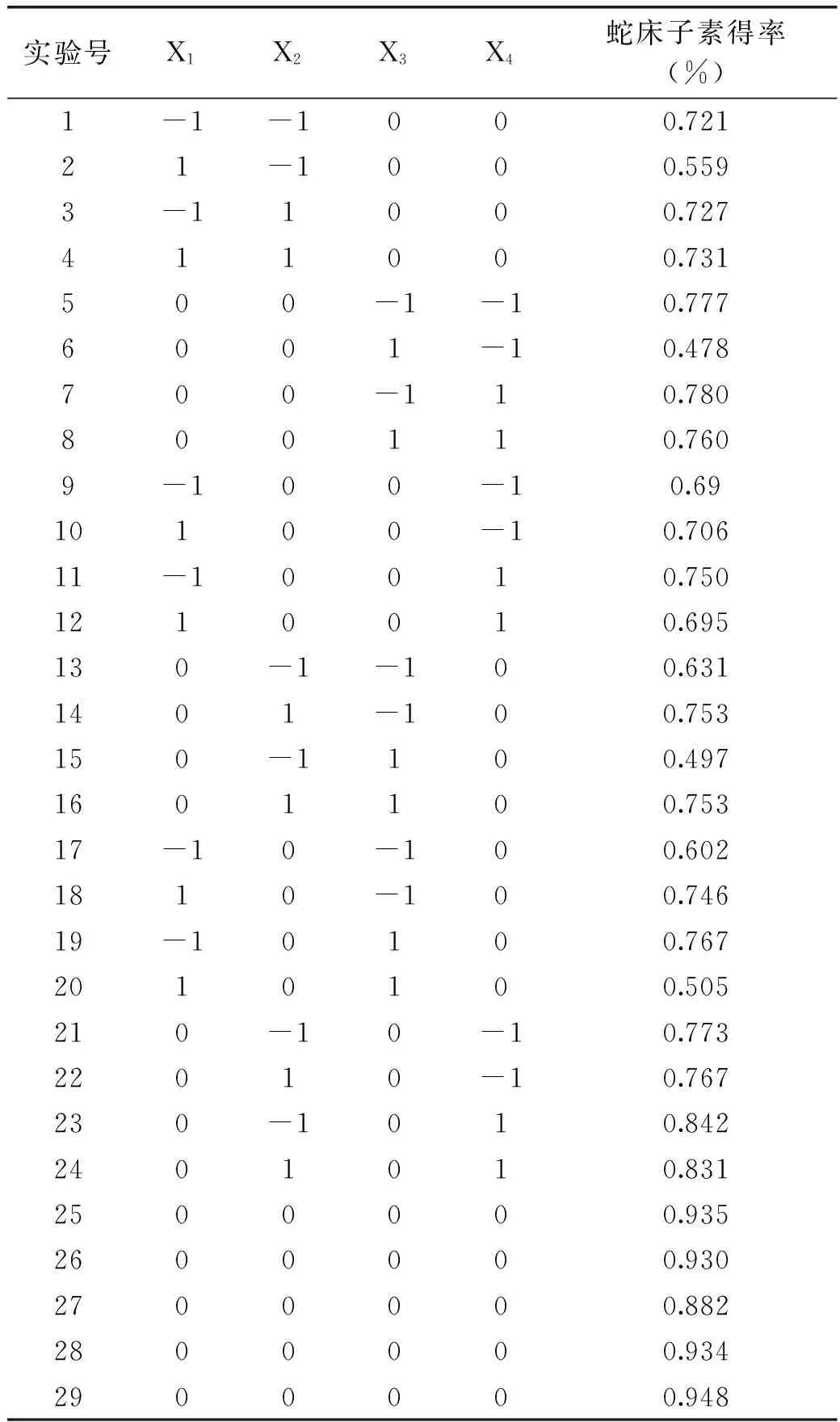
表2 响应面实验分析方案及结果
对该模型进行方差分析,结果见表3。从表中可知,该模型极其显著。实验所得到的蛇床子素的得率与模型计算得来的相关系数R2=0.8931,修正决定系数R2=0.7861,模型p<0.001,说明该模型能解释89.31%响应值的变化,即该模型与实际实验拟合良好。从方差分析表中各因素的F值看出,四个因素对蛇床子素得率影响顺序为:酶解时间>酶解温度>纤维素酶添加量>酶解pH。一次项中变量酶解时间(X2)、酶解温度(X3)、纤维素酶添加量(X4)是显著的(p<0.05)。二次项X12、X32对蛇床子素的得率影响极显著(p<0.001)。交互项X3X4对蛇床子素的得率影响显著(p<0.05),X1X3则对其影响极显著(p<0.01)。
2.3.2 响应面图形分析 根据回归方程,做响应曲面图,考察所拟合的响应曲面的形状,分析酶解pH、酶解时间、酶解温度、纤维素酶量对蛇床子素得率的影响。各两因素交互作用对得率影响的响应面图如图3,六幅图分别直观地反映了各两因素对响应值的影响。曲面的倾斜度反映了两因素对响应值的影响程度,倾斜度越高,即坡度越陡,说明两者交互作用越显著。从图3b中我们可以看出,酶解pH与酶解温度两因素的交互水平达到了高度显著水平,这主要是由于酶解pH和酶解温度两因素对纤维素酶活性的影响最大,从而影响了蛇床子素的得率。

表3 响应面模型方差分析表
注:***p<0.001为差异极显著;**p<0.01为差异高度显著;*p<0.05为差异显著。

图3 实验因素及其交互作用 对蛇床子素得率影响的响应面图
2.3.3 优化提取参数和验证模型 选择最适条件来检测模型方程是否适合预测的最优反应值。通过模型预测,纤维素酶辅助提取西藏产独活的蛇床子素的最优值:酶解pH4.97,酶解时间59.13min,酶解温度50.31℃,纤维素酶量2.86%,蛇床子素得率的理论预测值为0.954%。考虑实际操作,修订提取条件如下:酶解pH为5.0,酶解时间60min,酶解温度50℃,纤维素酶用量3%。
用修订后的条件进行了三次验证性实验,以保证预测值不偏离实际值,蛇床子素的得率平均为0.926%,与模型理论预测值误差在1%以内,表明模型能较好的预测实际得率。
3 结论
本文采用纤维素酶辅助提取西藏产独活的蛇床子素,在单因素实验的基础上建立了以蛇床子素得率为响应值,以酶解pH、酶解时间、酶解温度和纤维素酶量为因素的数学模型,方差分析表明该模型显著,拟合较好。通过对回归方程优化,得到纤维素酶提取的最佳工艺条件为:酶解pH为5.0,酶解时间60min,酶解温度50℃,纤维素酶用量3%。对所建立的数学模型进行了实验验证,在最优条件下得到蛇床子素得率为0.926%,与理论值0.954%基本一致。
[1]中国药典[S]. 2010,246-247.
[2]丁希飞,冯煦,董云发,等. 中药独活化学成分的研究[J]. 中药材,2008,31(4):516-518.
[3]张才煜,张本刚,杨秀伟. 独活化学成分的研究[J]. 解放军药学学报,2007,23(4):241-245.
[4]邱明山,陈进春,徐振兴,等. 独活对大鼠胶原诱导性关节炎的治疗作用[J]. 中医正骨,2012,24(2):6-8.
[5]Chou SY,Hsu CS,Wang KT,etal. Antitumor effects of Osthole from Cnidiummonnieri:aninvitroandinvivostudy[J]. Phytother Res,2007,21(3):226-230.
[6]刘爽,吴东媛,徐建华,等.蛇床子素的抗焦虑作用研究[J].中国医药导报,2012,9(29):19-21.
[7]苏晓乾,杨建宏.蛇床子素提取工艺优化研究[J].天津药学,2009,21(6):3-4.
[8]汪财生,孙安吉,王忠华,等. 紫山药多糖酶法提取工艺优化研究[J]. 食品工业科技,2010,31(2):266-271.
[9]戴清源,朱秀灵,顾蓉,等. 酶法提取脱脂米糠中阿魏酸的工艺优化[J]. 食品工业科技,2010,31(7):269-272.
[10]黄山,公衍玲,金宏.酶法提取绞股总皂苷工艺条件的优化[J]. 食品工业科技,2009,30(4):178-180.
[11]余洪波,张晓昱. 酶法在中药提取中的研究进展[J]. 中成药,2005,27(5):591-593.
[12]邹继红,娜日苏,杨慧明,等. 反相高效液相色谱法测定独活中蛇床子素与异欧前胡素的含量[J]. 赤峰学院学报:自然科学版,2010,26(2):63-65.
[13].Zhou J,Zeng P,Cheng Z H,etal. Application of hollow fiber liquid phase microextraction coupled with high-performance liquid chromatography for the study of the osthole pharmacokinetics in cerebral ischemia hypoperfusion rat plasma[J]. Journal of Chromatography B,2011,879:2304-2310.
[14]黄良永,郑江萍,甘春英. 独活药材及其配方颗粒中蛇床子素的含量比较[J]. 医药导报,2010,29(1):90-92.
[15]ZhouX,Zhao MR,Liang JP,etal. High efficiency degradation crude oil by anovel mutant irradiated from Dietzia strain by12C6+heavy ion using response surface methodology[J]. Bioresource Technology,2013,137:386-393.
[16]刘芳,刘虹,姜佳,等. 独活提取液浓缩过程中蛇床子素稳定性研究[J]. 天津中医药大学学报,2011,30(1):48-49.
Optimization of cellulase-assisted extraction of osthole from root ofRadixAngelicaPubescensusingresponse surface methodology
ZHAOMei-rong1,2,LIXue-hu1,LIUYao-ming3,YAOHai-chao4,LUXi-hong1,ZHOUXiang1,XINZhi-jun1,SEZhu4,LIANGJian-ping1,*
(1. Institute of Modern Physics,Chinese Academy of Sciences,Lanzhou 730000,China; 2. University of Chinese Academy of Sciences,Beijing 100049,China; 3.Anning Branch Lanzhou General Lanzhou Command CPLA,Lanzhou 730070,China; 4.Institute of Animal Science,Tibet Academy of Agricultural and Animal Husbandry Sciences,Lasa 850009,China)
Response surface methodology(RSM)was applied to optimize the extraction conditions of osthole.Based on single factor experiment,pH,the amount of cellulase enzymolysis temperature and time were chosen as influencing factors,the yield of osthole was selected as response value.The mathematical model was established by Box-Behnken central composite design.The results showed that the optimal extraction conditions were as follows:pH5.0,the amount of cellulase 3%,enzymolysis temperature 50℃,enzymolysis time 60min.In this optimal process condition,the yield of osthole was 0.926%.
RadixAngelicaPubescens;osthole;cellulase-assisted extraction;Box-Behnken design
2013-06-28 *通讯联系人
赵美荣(1988-),女,在读硕士研究生,研究方向:辐射药物学。
国家自然科学基金(11105194);院地合作项目(XBCD-2011-018)。
TS201.1
:B
:1002-0306(2014)01-0206-05

