东海原甲藻与中肋骨条藻的种间竞争数值模拟
孙 科, 丘仲锋, 何宜军, 尹宝树
(1. 中国科学院 海洋研究所 海洋环流与波动重点实验室, 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 南京信息工程大学 海洋学院, 南京 210044)
东海原甲藻(Prorocentrumdonghaiense)与中肋骨条藻(Skeletonemacostatum)是我国东海两种常见的赤潮藻种。因两者生态位的不同, 由其所引发的赤潮通常出现在不同时间。中肋骨条藻赤潮多发生于早春, 东海原甲藻赤潮发生于4月初到5月间[1]。赤潮优势种的演替是多因素(如温度、盐度、光照、营养盐、他感作用等)共同作用的复杂过程, 且对其发生原因与控制机制等方面的了解仍处于探索阶段。在以往的研究中, 针对这种演替现象已经做了大量的现场调查与室内实验, 如张传松[2]通过对2002—2007年长江口及其邻近海域调查数据的分析, 得到了赤潮优势种与各环境因子之间的关系; 王宗灵等[3]通过半连续培养实验研究了温度和营养盐对中肋骨条藻与东海原甲藻种间竞争的影响。除生物实验外, 模型也常被应用于这两种藻的竞争研究中, 但所使用的模型多为Lotka-Voltetta模型[4- 5], 只能估计最终竞争结果, 难以体现竞争过程中藻的生长与营养盐吸收。已有学者利用动态数值模型来研究藻类的竞争关系, 如Chapelle等[6]利用校正后的Alexandriumminutum与Heterocapsatriquetra单种生长模型, 成功地模拟了两者在共培养条件下的生长。在此思路基础上, 本文根据东海原甲藻与中肋骨条藻的生长特性建立了两个箱式模型, 分别用于模拟两种藻在单种培养条件下的生长情况, 并通过结合两个模型模拟了两种藻的共培养实验, 初步探讨了该模型在东海原甲藻与中肋骨条藻竞争研究中的应用。
1 模型简介与参数
1.1 模型简介
为了能够以生物机制为基础来描述浮游植物生物过程, Baklouti等[7- 8]综述了浮游植物生物关键过程的先进模拟方法, 包含了对光合作用、呼吸作用、营养盐吸收等生物过程机制的深入理解, 最终提出了一组包含多营养、多物种的浮游植物模型, 即Eco3M。
本文所采用的两个单藻种模型均改编自模型Eco3M的浮游植物和营养盐部分, 分别包括了东海原甲藻与中肋骨条藻的光合作用、营养盐吸收、呼吸作用、叶绿素合成等过程。模型中光照对藻类生长的影响采用Han[9]的机理模型来描述, 并使用Droop[10]的公式来体现营养盐限制对生长的影响。此外, 原Eco3M模型针对可能存在的多营养共限制给出了几种可选公式, 本文选用了利比希法则。模型中考虑的营养盐包括硝酸盐、磷酸盐、硅酸盐(仅中肋骨条藻单种实验与共培养实验)。营养盐的吸收速率与外部营养盐浓度和细胞内营养盐状态都密切相关, 本模型对前者用米氏方程来描述, 对后者用Lehman等[11]的公式表示。呼吸作用表示为每一生物过程的单位呼吸消耗率与发生速率乘积的总和。叶绿素合成的表达式选用Geider等[12]和Flynn等[13]公式的组合。由于实验在灭菌海水中进行, 本文模型中未考虑营养盐的再循环过程。共培养模型为两个单藻种模型的组合, 假设两藻种共同利用同一营养盐来源维持各自生长, 未加入其它相互作用过程。参数校正与模型验证部分所使用的实验数据均取自于李慧[14], 实验培养温度为(20±1) ℃, 光照度为4000 lx, 光暗比为12 h∶12 h, 模型的设置与实验条件相同。四阶龙格-库塔算法被用于求解微分方程, 为足够精确地估计状态变量, 进行了不同积分步长的预实验, 确定步长为60 s。
1.2 参数选取与校正
模型参数多取自东海原甲藻和中肋骨条藻相关的研究文献, 其它参数设置为Eco3M中参数取值范围的中间值。由敏感性分析可知[8], 生物量主要受光合作用参数与营养盐配额参数的影响, 本文对这些敏感性参数进行了校正。由于两种藻具有不同的光饱和点, 且Baklouti等[7]指出这种光适应可以通过调节σ和τ来体现(表1,表2), 根据预实验的结果, 本文仅对光合作用参数中的τ进行校正。因其它直接决定光合作用及营养盐吸收速率的参数未经过校正, 本文加入了参数B来缓冲由此造成的误差。由于实验结果中未体现硅酸盐的利用, 且硅酸盐不是限制性因子, 故本文仅对营养盐配额参数中N、P相关参数(QminN,QmaxN,QminP,QmaxP)进行校正。
本文使用不同接种密度下的东海原甲藻单种培养实验数据对其单种模型参数进行校正[14], 实验采用f/2培养液, 初始接种密度分别为(0.3, 0.5, 1.0, 1.5, 2.25)×104个/mL。在对中肋骨条藻单种模型参数的校正中[14], 实验仍采用f/2培养液, 初始密度分别为(0.225, 0.45, 0.75, 1.5, 2.25)×104个/mL。模拟结果表明, 模拟的细胞数和营养盐变化趋势与实验结果基本一致(图1,图2), 较好地体现了细胞生长与营养盐消耗的大体趋势。模型参数的最终取值如表1—表3所示。
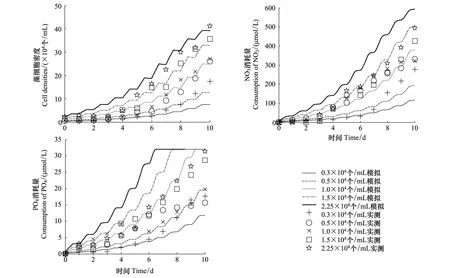
图1 不同接种密度下东海原甲藻单种培养实验结果与模拟结果比较

图2 不同接种密度下中肋骨条藻单种培养实验结果与模拟结果比较

表1 东海原甲藻参数值

表2 中肋骨条藻参数值

表3 共用参数值
2 模型验证
完成模型参数的选取与校正后, 本文进行了三组不同的数值模拟, 分别为东海原甲藻在不同N/P条件下单种培养、中肋骨条藻在不同N/P条件下单种培养、东海原甲藻与中肋骨条藻混合培养, 采用相应的实验室结果对模拟结果进行验证, 为与实验室数据保持一致, 藻细胞密度表示为log10(密度)。
2.1 不同N/P对东海原甲藻生长的影响
在本部分数值模拟中, 培养液按3种方式进行营养盐加富: ①f/2水平, 880 μmol/L NO3-N和32 μmol/L PO4-P; ②N/P=40水平, 530 μmol/L NO3-N和13 μmol/L PO4-P; ③N/P=120水平, 450 μmol/L NO3-N和3.7 μmol/L PO4-P。东海原甲藻的接种密度为1.0×104个/mL, 实验进行10 d, 结果如图3所示。
从图中可以看出, 随着细胞数的增长, NO3与PO4的消耗量不断增加。3种营养盐加富条件下藻细胞数均呈现出较一致的变化趋势, 即随着培养时间延长, 细胞密度不断增加, 其中①②条件下的最终密度高于③(图3);PO4的消耗与细胞数变化大体一致, 即①②的PO4消耗量明显大于③(图3);而NO3的结果较为不同, ②③的NO3消耗量相差不大, 且远小于①(图3)。模拟结果与实验结果吻合较好, 且变化趋势也较为一致, 表明东海原甲藻单种模型可以较好地重现该藻在不同N/P条件下的生长及对营养盐的利用情况。

图3 不同N/P条件下东海原甲藻单种培养实验结果与模拟结果比较
2.2 不同N/P对中肋骨条藻生长的影响
与东海原甲藻单种模型的验证类似, 对于中肋骨条藻同样使用不同N/P条件下的单种培养实验进行验证。N/P实验设置与2.1中所述相同, 中肋骨条藻的接种密度为1.5×104个/mL。实验进行10d, 结果如图4所示。
从图中可以看出, NO3与PO4的消耗量随着细胞数的上升而增加, 且在NO3还有大量剩余的情况下, PO4均已耗尽。细胞数在3种营养盐加富条件下均呈现较一致的变化趋势, 最终密度差别不大, 由高到低依次为①>②>③(图4); 营养盐的消耗量与细胞数变化趋势大体一致, 但不同营养盐条件下的消耗量存在明显的差异, 最终消耗量由高到低依次为①>②>③(图4)。模拟结果与实验值吻合较好, 变化趋势也较为一致, 特别是对PO4消耗量的模拟, 表明中肋骨条藻单种模型可以较好地重现该藻在不同N/P条件下的生长以及对营养盐的利用情况。
2.3 东海原甲藻与中肋骨条藻混合培养实验
共培养实验中, 根据东海原甲藻与中肋骨条藻初始接种比例的不同共设置7个实验组, 为与单种培养实验结果对比, 初始接种比例为两种藻在单种培养实验中不同接种密度的排列组合, 具体初始密度如表4所示, 实验采用f/2培养液, 进行10d, 细胞生长、NO3消耗、PO4消耗结果分别如图5—图7所示。
图5中实验结果显示, 共培养条件下中肋骨条藻的生长曲线与其在单种培养实验中非常相似; 东海原甲藻的生长曲线前段与其在单种培养实验中非常接近, 但分别在第4 天或第6 天出现了细胞数的迅速衰减, 这在其单种培养实验中并没有出现; 比较共培养实验中两藻种的生长曲线发现, 无论在何种初始细胞接种比例下, 中肋骨条藻的最终密度均会超过东海原甲藻, 即中肋骨条藻会在两藻种竞争中占优势。模拟结果中, 共培养条件下中肋骨条藻生长曲线与其在单种培养条件下差别不大, 且生长曲线与实验结果吻合较好; 而共培养条件下东海原甲藻生长曲线前段与其在单种培养条件下生长曲线差别不大, 但在图5所示的第5 天或第6 天出现了较为明显的偏离, 并未能体现实验结果中细胞数迅速衰减这一特征; 无论在何种初始细胞接种比例下, 模拟的中肋骨条藻最终密度均超过了东海原甲藻, 这与实验结果是一致的。

图4 不同N/P条件下中肋骨条藻单种培养实验结果与模拟结果比较

表4 共培养实验中东海原甲藻与中肋骨条藻的初始藻细胞密度
图6中实验结果显示, 共培养实验组A中NO3的变化曲线与中肋骨条藻单种培养条件下非常相近, 但东海原甲藻单种培养条件下的NO3消耗较低, 说明实验组A中的NO3减少主要由中肋骨条藻消耗引起; 其它各实验组中肋骨条藻单种培养条件下的NO3消耗量均高于东海原甲藻, 但后者的消耗量对总消耗量仍具有一定的贡献, 且这种贡献随着东海原甲藻初始接种比例的增加而增大, 由此可见共培养条件下NO3的减少是由两种藻共同消耗造成的。模拟结果中, 共培养各实验组的NO3消耗量均略高于实验结果, 虽然两种藻在其单种培养条件下模拟结果与其实验结果之间存在一定误差, 但仍然体现出东海原甲藻对总NO3消耗量贡献随着东海原甲藻初始接种比例增加而增大的特征。
图7中实验结果显示, 共培养各实验组的PO4均在第4—6 天被消耗尽, 且PO4的变化曲线与中肋骨条藻在单种培养条件下非常接近, 而与东海原甲藻在单种培养条件下的PO4变化曲线差别较大, 说明PO4主要被中肋骨条藻所消耗。模拟结果中, 除实验组G中PO4比实验结果提前1d被消耗尽外, 共培养各实验组中PO4的消耗情况均与实验结果较为一致; 实验组A—D中, 模拟的共培养PO4变化曲线与在中肋骨条藻单种培养条件下较为接近, 体现了PO4主要被中肋骨条藻所消耗的特征, 但实验组E—G的模拟结果显示PO4的减少是中肋骨条藻与东海原甲藻共同消耗的结果, 这可能是由于模拟的单种培养条件下中肋骨条藻PO4消耗较实验结果偏慢(图2C)而东海原甲藻偏快(图1C)导致的。由上述验证结果可见, 模型能够较好地重现共培养实验中东海原甲藻与中肋骨条藻的竞争结果及对营养盐的竞争利用关系。

图5 不同接种比例共培养实验结果与模拟结果比较(生长曲线)

图6 不同接种比例共培养实验结果与模拟结果比较(NO3消耗曲线)

图7 不同接种比例共培养实验结果与模拟结果比较 (PO4消耗曲线)
3 讨论
3.1 营养盐对生长的影响
在单种培养和共培养实验条件下, 对PO4的模拟结果均优于对NO3的模拟。其原因一方面由于模型的最初目的是用于解释长江口的赤潮现象, 而长江口一直被认为是P限制的[15- 17], 故此前的模拟重点放在对P营养的模拟上; 另一方面, 相对于P营养, N营养的生物化学过程较为复杂。
赤潮优势种的演替是由多因素(如温度、盐度、光照、营养盐、他感作用等)共同作用的复杂过程, 由于东海水体富营养化程度日趋严重, 营养盐及其结构常被认为是影响演替的一个重要因素, 因此本文的共培养模型主要研究两种藻对营养盐的竞争过程及其结果。模拟结果显示, 两种藻的竞争结果并不依赖于初始接种密度比例, 中肋骨条藻是完全的优势种, 这与实验结果是一致的。中肋骨条藻的这种竞争优势主要是由于其对营养盐的利用方式以及较高的生长率[18], 这在模拟结果中也得到了充分的体现, 如图7中PO4的消耗主要源于中肋骨条藻的吸收, 且图5显示中肋骨条藻的生长率明显高于东海原甲藻。本文的实验条件中营养盐相对充足, 但有研究表明在营养盐相对匮乏的条件下东海原甲藻往往会在与中肋骨条藻的竞争中取得优势[1,3,19], 因此在营养盐贫乏条件下的模拟结果还需要实验来进一步验证。
3.2 种间相互作用
共培养各实验组中东海原甲藻分别在第4 天或第6天出现了在单种培养实验中未出现的细胞数迅速衰减现象, 李慧[14]将其解释为中肋骨条藻对东海原甲藻产生的黏性共沉降。王江涛等[20]的实验结果表明, 中肋骨条藻过滤液对东海原甲藻的生长没有明显影响; 而Yamasaki等[21]证明, 中肋骨条藻过滤液对东海原甲藻具有抑制作用, 但抑制物与促进物是同时存在的; 赵卫红与陈玫玫[22, 23]的实验结果则表明, 中肋骨条藻与东海原甲藻的过滤液会促进彼此生长。可见, 对于两藻种之间的他感作用尚无定论。此外, Jeong等[24]指出东海原甲藻能够摄食粒径小于(12.1±2.5) μm的微藻, 且其生长快于同等条件下仅依靠光照的生长, 而随后Yoo等[25]证明东海原甲藻能够捕食中肋骨条藻。模拟结果并未捕捉到东海原甲藻细胞数迅速衰减这一现象, 主要由于本文的共培养模型仅为两个单藻种模型结合, 未考虑两藻种之间的他感作用, 只能够体现两者对营养盐的竞争。即使如此, 在图5中, 模拟的共培养条件下东海原甲藻生长曲线分别在第5 天或第6天明显偏离于其在单种培养条件下的生长曲线, 说明营养盐竞争在东海原甲藻细胞迅速衰减这一现象中也起到一定的作用。因此, 在种间竞争模拟中考虑更多的营养形态(如可溶解有机物), 他感作用与捕食关系将是此后工作的研究方向。
4 结论与展望
本文通过对两个单种模型的校正与验证, 初步探讨了模型在东海原甲藻与中肋骨条藻竞争中的应用。结果表明, 校正后的模型能够较好地模拟两种藻在不同N/P情况下单种培养的生长情况, 并能体现出营养盐消耗的大体趋势; 共培养模型虽然不能模拟除营养盐竞争以外的相互作用, 但模拟结果已经能够明显地体现出两种藻的竞争结果以及对营养盐的竞争利用关系。本文所使用的模型在校正与验证中所提到的实验藻种均取自东海或直接取自长江口赤潮高发区, 因此该箱式模型与生态系统模型结合后, 可用于东海赤潮藻竞争与演替的研究。
致谢: 本文得到了中国科学院海洋研究所申辉老师等的协助, 特此致谢。
:
[1] Zhu M Y, Xu Z J, Li R X, Wang Z L, Shi X Y. Interspecies competition for nutrients betweenProrocentrumdonghaienseLu andSkeletonemacostatum(Grey.) Cleve in mesocosm experiments. Acta Oceanologica Sinica, 2009, 28(1): 72- 82.
[2] Zhang C S. The Characteristic and Effects of Nutrient during the Process of HAB in Changjiang River Estuary and its Adjacent Area [D]. Qingdao: Ocean University of China, 2008.
[3] Wang Z L, Li R X, Zhu M Y, Chen B Z, Hao Y J. Study on population growth processes and interspecific competition ofProrocentrumdonghaienseandSkeletonemacostatumin semi-continuous dilution experiments. Advances in Marine Science, 2006, 24(4): 495- 503.
[4] Li H, Wang J T. Inter-specific competition betweenProrocentrumdonghaienseandSkeletonemacostatum. Acta Ecologica Sinica, 2012, 32(4): 1115- 1123.
[5] Yu P. Effect of temperature, irradiance and population interaction on the growth of phytoplankton of East China Sea [D]. Qingdao: Ocean University of China, 2005.
[6] Chapelle A, Labry C, Sourisseau M, Lebreton C, Youenou A, Crassous M P.Alexandriumminutumgrowth controlled by phosphorus: An applied model. Journal of Marine Systems, 2010, 83(3/4): 181- 191.
[7] Baklouti M, Diaz F, Pinazo C, Faure V, Quéguiner B. Investigation of mechanistic formulations depicting phytoplankton dynamics for models of marine pelagic ecosystems and description of a new model. Progress in Oceanography, 2006, 71(1): 1- 33.
[8] Baklouti M, Faure V, Pawlowski L, Sciandra A. Investigation and sensitivity analysis of a mechanistic phytoplankton model implemented in a new modular numerical tool (Eco3M) dedicated to biogeochemical modelling. Progress in Oceanography, 2006, 71(1): 34- 58.
[9] Han B P. A mechanistic model of algal photoinhibition induced by photodamage to photosystem-II. Journal of Theoretical Biology, 2002, 214(4): 519- 527.
[10] Droop M R. Vitamin B12and marine ecology. IV. the kinetics of uptake, growth and inhibition inmonochrysislutheri. Journal of the Marine Biological Association of the United Kingdom, 1968, 48(3): 689- 733.
[11] Lehman J T, Botkin D B, Likens G E. The assumptions and rationales of a computer model of phytoplankton population dynamics. Limnology and Oceanography, 1975, 20(3): 343- 364.
[12] Geider R J, MacIntyre H L, Kana T M. A dynamic regulatory model of phytoplanktonic acclimation to light, nutrients, and temperature. Limnology and Oceanography, 1998, 43(4): 679- 694.
[13] Flynn K J, Marshall H, Geider R J. A comparison of two n-irradiance interaction models of phytoplankton growth. Limnology and Oceanography, 2001, 46(7): 1794- 1802.
[14] Li H. The effect of allelopathy on the species competition betweenSkeletonemacostatumandProrocentrumdonghaiense[D]. Qingdao: Ocean University of China, 2011.
[15] Harrison P J, Hu M H, Yang Y P, Lu X. Phosphate limitation in estuarine and coastal waters of China. Journal of Experimental Marine Biology and Ecology, 1990, 140(1/2): 79- 87.
[16] Huang B Q, Ou L J, Wang X L, Huo W Y, Li R X, Hong H S, Zhu M Y, Qi Y Z. Alkaline phosphatase activity of phytoplankton in East China Sea coastal waters with frequent harmful algal bloom occurrences. Aquatic Microbial Ecology, 2007, 49(2): 195- 206.
[17] Wang B D, Wang X L, Zhan R. Nutrient conditions in the Yellow Sea and the East China Sea. Estuarine, Coastal and Shelf Science, 2003, 58(1): 127- 136.
[18] Lü S H, Li Y. Nutritional storage ability of four harmful algae from the East China Sea. The Chinese Journal of Process Engineering, 2006, 6(3): 439- 444.
[19] Hou J L, Zhang C S, Shi X Y, Lu R, Wang X L. Effect of phosphate on two typical HAB species in East China Sea by mesocosm experiments. Periodical of Ocean University of China, 2006, 36(S1): 163- 169.
[20] Wang J T, Li H, Cao J, Zhang Y W. The effect of allelopathy on the competition and succession betweenSkeletonemacostatumandProrocentrumdonghaiense. Acta Oceanologica Sinica, 2012, 34(2): 169- 178.
[21] Yamasaki Y, Ohmichi Y, Shikata T, Hirose M, Shimasaki Y, Oshima Y, Honjo T. Species-specific allelopathic effects of the diatomSkeletonemacostatum. Thalassas, 2010, 27(1): 21- 32.
[22] Zhao W H, Cheng M M. Effect of nutrient limitation on allelopathy produced ofSkeletonemacostatum. Marine Environmental Science, 2010, 29(2): 225- 228.
[23] Cheng M M, Zhao W H. Allelopathic effects ofProrocentrumdonghaienseLu onSkeletonemacostatum. Marine Sciences, 2007, 31(4): 62- 67.
[24] Jeong H J, Yoo Y D, Park J Y, Song J Y, Kim S T, Lee S H, Kim K Y, Yih W H. Feeding by phototrophic red-tide dinoflagellates: five species newly revealed and six species previously known to be mixotrophic. Aquatic Microbial Ecology, 2005, 40(2): 133- 150.
[25] Yoo Y D, Jeong H J, Kim M S, Kang N S, Song J Y, Shin W, Kim K Y, Lee K. Feeding by Phototrophic red-tide dinoflagellates on the ubiquitous marine diatomSkeletonemacostatum. Journal of Eukaryotic Microbiology, 2009, 56(5): 413- 420.
参考文献:
[2] 张传松. 长江口及邻近海域赤潮生消过程特征及其营养盐效应分析 [D]. 青岛: 中国海洋大学, 2008.
[3] 王宗灵, 李瑞香, 朱明远, 陈炳章, 郝彦菊. 半连续培养下东海原甲藻和中肋骨条藻种群生长过程与种间竞争研究. 海洋科学进展, 2006, 24(4): 495- 503.
[4] 李慧, 王江涛. 东海原甲藻与中肋骨条藻的种间竞争特征. 生态学报, 2012, 32(4): 1115- 1123.
[5] 于萍. 温度、光照及种间相互作用对东海典型浮游植物生长的影响 [D]. 青岛: 中国海洋大学, 2005.
[14] 李慧. 化感作用对中肋骨条藻和东海原甲藻种间竞争的影响 [D]. 青岛: 中国海洋大学, 2011.
[18] 吕颂辉, 李英. 我国东海4种赤潮藻的细胞氮磷营养储存能力对比. 过程工程学报, 2006, 6(3): 439- 444.
[19] 侯继灵, 张传松, 石晓勇, 陆茸, 王修林. 磷酸盐对两种东海典型赤潮藻影响的围隔实验. 中国海洋大学学报, 2006, 36(增刊): 163- 169.
[20] 王江涛, 李慧, 曹婧, 张议文. 化感作用对中肋骨条藻与东海原甲藻竞争演替的影响. 海洋学报, 2012, 34(2): 169- 178.
[22] 赵卫红, 陈玫玫. 营养盐限制对中肋骨条藻产生化感作用的影响. 海洋环境科学, 2010, 29(2): 225- 228.
[23] 陈玫玫, 赵卫红. 东海原甲藻对中肋骨条藻的他感作用初探. 海洋科学, 2007, 31(4): 62- 67.

