三维准连续动脉自旋标记灌注成像对WHO Ⅱ级胶质瘤分型临床应用价值初探
肖华锋,衣岩,安维民*,田树平,王玉林,马威
按照2007年WHO中枢神经系统肿瘤分类标准,WHO Ⅱ级胶质瘤一般临床症状较轻微,生长较缓慢,可能很多年没有进展,但是绝大多数最终都会间变或恶变成高级别胶质瘤,其时间可长可短,随不同病理类型而 异[1]。WHO Ⅱ级胶质瘤主要有星形细胞瘤、少突胶质细胞瘤和由星形细胞和少突胶质细胞两种肿瘤细胞组成的混合型少突星形细胞瘤。据文献报道,星形细胞瘤与少突胶质细胞瘤的生物学行为明显不同,少突胶质细胞瘤相比星形细胞瘤来说,其恶变的周期更长,且对放化疗更敏感,预后更好[2]。而少突星形细胞瘤则介于两者之间。故术前如能对其病理类型进行区分将具有非常重要的临床意义。迄今为止,结合MRI常规检查及某些先进序列已能做到对胶质瘤进行术前病理分级,但对于同为WHO Ⅱ级胶质瘤的不同病理类型进行术前区分国内外虽有不少文献报道,但尚存在不少争议。
作为先进的MR成像技术,灌注成像是目前用于脑肿瘤如星形细胞瘤、胶质瘤分级研究中使用最多的技术,并且已经取得相当可靠的研究结果[3],而对于同为WHO Ⅱ级胶质瘤病理类型的区分能力文献报道说法不一,并未达成一致的看法。本研究运用全新的灌 注成像技术三维准连续 动脉自旋标记(3-dimensional pseudocontinous arterial spin labeling,3D-PCASL)对同为WHO Ⅱ级胶质瘤的不同病理类型进行术前评价,研究其对不同病理类型WHO Ⅱ级胶质瘤的鉴别诊断能力。
1 材料与方法
1.1 临床资料
本研究经医院伦理委员会审核研究通过,所有患者在检查前都必须签署知情同意书,对检查过程和可能出现的副反应完全知晓。根据2007年WHO中枢神经系统肿瘤分类标准,搜集从2011年12月到2013年10月共计34例术后病理证实为WHOⅡ级胶质瘤患者列入研究范围,其中男19例,女15例,年龄从33~75岁,平均48岁。这些患者包括16例星形细胞瘤、13例少突胶质细胞瘤、5例少突星形细胞瘤。患者术前行常规MRI平扫、3D-PCASL及增强扫描。术后查阅病历资料、外科手术记录以及病理诊断结果,收集整理MRI相关数据以备于分析。34例患者临床表现情况:15例以癫痫就诊,13例头痛,9例表现肢体无力,18例头晕,2例无症状偶然发现。
1.2 MR成像采集及数据处理
所有患者均使用GE Discovery MR 750 3.0 T扫描仪,32通道头部专用线圈进行图像采集,常规MRI扫描包括轴面T1WI、T2WI、DWI及冠状面和矢状面T2FLAIR,3D-PCASL及轴面、冠状面及矢状面增强扫描。成像参数为T1WI采用T1-FLAIR技术,TR 1750 ms,TE 24 ms,TI 780 ms。T2WI 采用螺旋桨采集技术,TR 4526 ms,TE 111 ms。DWI 采用压脂单次激发梯度回波成像技术,TR 6000 ms,TE 65.7 ms,b值分别取b=0,1000 s/mm2。3DPCASL成像参数:TR 4653 ms,TE 10.5 ms,标记延迟时间(PLD)1525 ms,FOV 24 cm×24 cm,矩阵512×8,层厚4.0 mm,层间距0 mm,36对标记及对比像,成像时间为4 min32 s。增强扫描对比剂为钆喷替酸普甲胺(Gd-DTPA),剂量为0.1 mmol/kg,扫描参数同平扫。
后处理软件采用GE公司工作站GE Advantage Workstation Functool 4.5.1软件,将3D-PCASL原始图像导入工作站自动生成脑血流量(cerebral blood flow,CBF)伪彩图,为减少误差,所有肿瘤在CBF图上均分别手动选取代表最大灌注层面热点区域放置感兴趣区(ROI),ROI范围28 mm×28 mm~32 mm×32 mm,约8~10像素,共放置5~10个ROI,取最大CBF值作为最后统计数据。测量时需结合常规平扫、增强图及3D-PCASL原始图像,ROI放置时避开囊变、出血、钙化或血管。以对侧正常白质CBF值作为参考,以两者的比值即标准化的CBF (normalized lesion/normal tissue cerebral blood flow,nCBF)用于统计分析。为减少测量误差,由2名有8年以上的神经影像医师分别独立完成所有ROI的放置和nCBF测量,且对患者相关信息及病理结果做到双盲。最后取两者测量的平均值进行统计分析。
1.3 统计分析方法
所有数据均采用SPSS 16.0进行分析,所有灌注数值结果以均数±标准差表示,首先采用方差齐性检验,星形细胞瘤组与少突胶质细胞瘤组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。因少突星形细胞瘤样本量太少(少于10例)未纳入统计分析。
2 结果
本研究中,三种胶质瘤的常规MRI表现与其他研究结果相似。相比较而言,除少突胶质细胞瘤强化率更高些,额叶多发,皮层易受累,瘤内常因囊变及钙化而致信号不均匀外,余三者均未见明显差异。2名影像医师运用上述常规MRI表现特点对三种肿瘤进行拟诊断,他们诊断准确率分别为星形细胞瘤:9/16和10/16、少突胶质细胞瘤:8/13和10/13、对5例少突星形细胞瘤诊断正确率均为0。灌注参数值统计情况为:星形细胞瘤的nCBF范围从0.43到2.29,平均值为1.21±0.51,而少突胶质细胞瘤nCBF范围从0.51到5.81,平均值为1.28±1.41。16例星形细胞瘤和13例少突胶质细胞瘤,两组间平均nCBF未见明显统计学差异(P=0.855)。5例少突星形细胞瘤最小值为0.56,最大值为2.59。典型病例如图1,2所示。
3 讨论
3.1 WHO Ⅱ级胶质瘤病理分型的意义及影像评价
大量临床实验证实:WHO Ⅱ级星形细胞瘤对放疗和化疗不敏感,手术后中位生存期约4~6年。而少突胶质细胞瘤则对放疗和化疗均敏感,其手术后中位生存期约12年[4-5],明显长于星形细胞瘤,尤其是1号染色体短臂(1p)杂合性和19号染色体长臂(19q)杂合性联合缺失的少突胶质细胞瘤对放化疗更敏感,其存活期更长。有研究报道,这种杂合性缺失少突胶质细胞瘤约占少突胶质细胞瘤的50~70%[6],尽管这种基因检测临床并不常用。少突星形细胞瘤则介于两者之间。正是有了上述明显不同的临床意义,针对区分不同病理类型的胶质瘤研究大量涌现。有研究针对三种肿瘤的不同钙化特点试图用CT对他们进行区分[7-8],尽管少突胶质细胞瘤钙化更多见一些,但是由于星形细胞瘤及少突星形细胞瘤也有不少钙化,CT表现存在很大重叠而未取得令人信服的研究结果。有的研究者利用MR扩散加权像的表观扩散系数(apparent diffusion coeffi cient,ADC)来对他们进行区分,研究表明:ADC值在WHO Ⅱ级少突胶质细胞瘤与星形细胞瘤之间存在明显不同,而信号混杂的少突星形细胞瘤的ADC值则居于两者之间[9-10]。尽管ADC值与细胞密度相关,但是病理上的依据不充分,仍然不清楚的是什么原因造成这种参数与胶质瘤的特殊病理类型相关[11]。
3.2 MR灌注成像在WHO Ⅱ级胶质瘤分型中的作用
目前影像学技术中,灌注成像是体现肿瘤血管增生最好的成像技术。因此,许多研究均致力于探索灌注成像在肿瘤分级及分型中的准确性,并已经表明:在胶质瘤中最大血流量与胶质瘤的级别具有很大的相关性[12]。既往研究运用动态磁敏感对比增强(dynamic susceptibility contrast,DSC)灌注成像对低级别胶质瘤进行病理分型研究,研究结果得出了两种不同的结论,一种认为星形细胞瘤的灌注值低于少突胶质细胞瘤,而少突星形细胞瘤居中,差异有统计学意义。其主要原因是因为少突胶质细胞瘤多靠近皮层,且存在明显的1P19q杂合性缺失(它能造成内皮生长因子受体和血管内皮生长因子过度表达),甚至有文献就灌注值与少突胶质细胞瘤1p19q杂合性联合缺失之间的相关性进行了研究,并得出了杂合性联合缺失与灌注值存在明显相关的结论[13-15]。有的研究者认为两种肿瘤的灌注值 没有明显统计学差异[2]。我们知道,DSC灌注成像易受顺磁性物质如钙化、出血等影响,且受动脉输入函数设置的局限,同时其性噪比、分辨率及数值还受对比剂剂量多寡、注射速度等多方面因素影响,故本研究选择了最新灌注模式3D-PCASL技术成像。通常将ASL根据成像方法不同分为连续式ASL和脉冲式ASL[16]。本研究中所运用的3D-PCASL是一种准连续ASL,它集合了连续式ASL 和脉冲式ASL优点[17]。而且,与其他准连续ASL相比,3D-PCASL能够实现三维全脑成像,采取螺旋采集技术使得采集时间更短,同时采用快速自旋回波成像从而很大程度上减少了磁敏感伪影,较之基于平面梯度回波成像的DSC有着更大的优势。所以,从理论上讲,3D-PCASL能够提供十分丰富的定性及定量信息,具有极大的临床应用前景。尽管DSC使用最多的参数是rCBV,但是许多研究已经证实rCBF与rCBV具有同样的诊断价值[18-19]。本研究结果显示:应用3D-PCASL灌注成像技术扫描,同为WHO Ⅱ级的星形细胞瘤与少突胶质细胞瘤在其灌注参数值未见明显差异,这一点与Emblem等运用DSC的研究结果相仿。本研究少突胶质细胞瘤的nCBF平均值为1.28±1.41,与Spampinato等[20]的研究结果和Narang等[21]的CT灌注结果基本类似,Spampinato等[20]报道22例低级别少突胶质细胞瘤的平均rCBV为1.61 ± 1.20,但却远低于Cha等[13]和Jenkinson等[15]的研究,Cha等[13]报道为3.68±2.39。Jenkinson等[15]研究中共有6例1p19q杂合性联合缺失,本研究有2例少突胶质细胞瘤进行了基因检测,并证实都存在1p19q杂合性联合缺失,其中一例呈明显的高灌注,nCBF值达5.87,病理也证实存在少量的枝芽状肿瘤血管,但为何能造成这么明显的高灌注,其真正原因还须进一步探讨,而另一例却未见明显高灌注,nCBF值为1.04(<2),病理上也并未见明显肿瘤血管。由于基因检测在国内医院临床应用得并不广泛,其大多数仍然是注重基础研究开发的生物工程公司或是基础研究室开展的项目,这样导致大多数临床少突胶质细胞瘤患者未能完成这项检查。本研究中余11例少 突胶质细胞瘤与5例少突星形细胞瘤均未进行相关基因检测,其杂合性缺失情况不得而知。
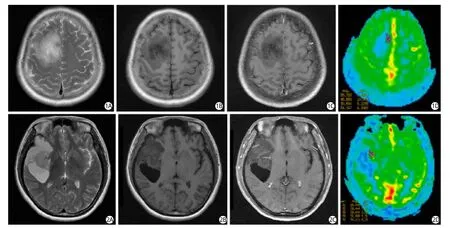
图1 60岁男性患者,病理证实为右侧额叶星形细胞瘤瘤伴囊变(WHO Ⅱ级)。A:T2WI;B:T1WI;C:增强扫描示病变呈轻度斑片样强化。D:3D-PCASL CBF伪彩图示ROI测量肿瘤最大CBF值,未见高灌注 图2 40岁女性患者,病理证实为右侧颞叶少突胶质细胞瘤伴囊变(WHOⅡ级)。 A:T2WI;B:T1WI;C:增强扫描未见明显强化。D:3D-PCASL CBF伪彩图示ROI 测量肿瘤最大CBF值,未见高灌注Fig.1 Sixty-year-old man with an astrocytoma accompanying cystic change in the right frontal lobe (WHO II).A: T2-weighted image.B: T1-weighted image.C: Postcontrast T1-weighted i mage shows slightly patchy enhancement of the infi ltrative tumor.D: ROI selected for maximal CBF of tumor with no hyperperfusion in 3D-ASL CBF color map. Fig.2 Forty-year-old woman with an olig odendroglioma accompanying cystic change in the right temporal lobe (WHO II).A: T2-weighted image.B: T1-weighted image.C: Postcontrast T1-weighted image shows no enhancement in the tumor.D: ROI selected for maximal CBF of tumor with no hyperperfusion in 3D-ASL CBF color map.
但是根据研究结果,50%~70%的少突胶质细胞瘤存在1p19q杂合性联合缺失,且认为这种分子生物学异常是少突胶质细胞瘤诊断的一个病理学标志,虽然本研究多数病例未进行该项检测,但从该结论推断其比例也应不在少数。但其灌注平均值却未出现明显高灌注,分析其原因,可能有以下三种方面:(1)灌注检查采取的方法不同造成的,DSC采用的外源性对比剂是非扩散性示踪剂,它只计算ROI的体积,而3D-PCASL基于内源性示踪剂,反映体内水在毛细血管网间的分布,且DSC测量的计算是基于对比剂完全停留于血管内的模型,这与血脑屏障破坏和肿瘤的实际情况不相符。另外,DSC的动脉输入函数设置和去卷积效应可能也会造成误差。而少突胶质细胞瘤常见的钙化可能也会对DSC灌注造成影响。(2)样本量的偏差。即少突胶质细胞瘤中,1p 19q杂合性联合缺失的比例可能没有文献报道的那么高。(3)1p19q杂合性联合缺失的少突胶质细胞瘤也存在灌注不高的情况[21-22],如本研究所示的第2例1p19q杂合性联合缺失的少突胶质细胞瘤。
由于3D-PCASL只提供CBF一个定量参数,且其设定的标记延迟时间受患者年龄、身高、体重以及患者基础状况等个体差异的影响,本研究将其固定在1525 ms可能会带来一些统计学的偏差。样本量太小,同时未能针对患者的实际情况对标记延迟时间进行个性化设置是本研究的局限,这些都留待以后的研究进一步改进。
本研究结果表明:WHO Ⅱ级胶质瘤各种病理类型肿瘤灌注值未能达到统计学差异,3D-PCASL在区分WHO Ⅱ级胶质瘤病理类型上临床意义不大。
[References]
[1]Louis DN, Ohgaki H, Wiestler OD, et al.The 2007 WHO classifi cation of tumours of the central nervous system.Acta Neuropathol, 2007,114(2): 97-109.
[2]Emblem KE, Scheie D, Due-Tonnessen P, et al.Histogram analysis of MR imaging-derived cerebral blood volume maps: combined g lioma grading and identification of low-grade oligodendroglial subtypes.AJNR Am J Neuroradiol, 2008, 29(9): 1664-1670.
[3]Arvinda HR, Kesavadas C, Sarma PS, et al.Glioma grading:sensitivity, specificity, positive and negative predictive values of diffusion and perfusion imaging.J Neurooncol, 2009, 94(1): 87-96.
[4]Xu M, See SJ, Ng WH, et al.Comparison of magnetic resonance spectroscopy and perfusion-weighted imaging in presurgical grading of oligodendroglial tumors.Neurosurgery, 2005, 56(5): 919-926.
[5]Sepulveda Sanchez JM, Martinez Montero JC, Diez-Lobato R, et al.Classification of oligodendroglial tumors based on histopathology criteria is a signifi cant predictor of survival--clinical, radiological and pathologic long-term follow-up analysis.Clin Neuropathol, 2009,28(1): 11-20.
[6]Osborn AG, Salzman KL, Barkovich AJ, et al.Diagnostic imaging:brain.2nd ed.Vienna: Amirsys, 2010: I-6-44-47.
[7]Xie XB, Fang KH, Liao XY, et al.Analysis for CT characteristics of intracranial oligodendrogliomas.Chin J Clini Radio, 1996, 15(3):139-142.谢学斌, 方昆豪, 廖惜云, 等.颅内少枝胶质细胞瘤CT 特征性表现分析.临床放射学杂志, 1996, 15(3): 139-142.
[8]Khalid L, Carone M, Dumrongpisutikul N, et al.Imaging characteristics of oligodendrogliomas that predict grade.AJNR Am J Neuroradiol, 2012, 33(5): 852-857.
[9]Khayal IS, McKnight TR, McGue C, et al.Apparent diffusion coefficient and fractional anisotropy of newly diagnosed grade Ⅱgliomas.NMR Biomed, 2009, 22(4): 449-455.
[10]Qian YF, Yin MM, Yu YQ.Diffusion weighted MR imaging in differentiation of low grade gliomas.Chin J Magn Reson Imaging,2010, 1(1): 19-22.钱银锋, 殷敏敏, 余永强.扩散加权成像在低级别胶质瘤的鉴别诊断价值.磁共振成像, 2010, 1(1): 19-22.
[11]Jenkinson MD, Smith TS, Brodbelt AR, et al.Apparent diffusion coeffi cients in oligodendroglial tumors characterized by genotype.J Magn Reson Imaging, 2007, 26(6): 1405-1412.
[12]Barrett T, Bre chbiel M, Bernardo M, et al.MRI of tumor angiogenesis.J Magn Reson Imaging, 2007, 26(2): 235-249.
[13]Cha S, Tihan T, C rawford F, et al.Dif ferentiatio n of low-grade oligodendrogliomas from low-grade astrocytomas by using quantitative blood-volume measurements derived from dynamic susceptibility contrast- enhanced MR imaging.AJNR Am J Neuroradiol, 2005, 26(2):266-273.
[14]Whitmore RG, Krejza J, Kapoor GS, et al.Prediction of oligodendroglial tumor subtype and grade using perfusion weighted magnetic resonance imaging.J Neurosurg, 2007, 107(3): 600-609.
[15]Jenkinson MD, Smith TS, Joyce KA, et al.Cerebral blood volume,genotype and chemosensitivity in oligodendroglial tumors.Neuroradiology, 2006, 48(10): 703-713.
[16]Petcharunpaisan S, Ramalho J, Castillo M.Arterial spin labeling in neuroimaging.World J Radiol, 2010, 2(10): 384-398.
[17]Wheaton AJ, Miyazaki M.Non-contrast enhanced MR angiography:physical principles.J Magn Reson Imaging, 2012, 36(2): 286-304.
[18]Lehmann P, Monet P, de Marco G, et al.A comparative study of perfusion measurement in brain tumours at 3 tesla MR: Arterial spin labeling versus dynamic susceptibility contrast-enhanced MRI.European neurology, 2010, 64(1): 21-26.
[19]White CM, Pope WB, Zaw T, et al.Regional and Voxel-wise comparisons of blood flow measurements between dynamic susceptibility contrast magnetic resonance imaging (DSC-MRI) and arterial spin labeling (ASL) in brain tumors.J Neuroimaging, 2014,24(1): 23-30.
[20]Spampinato MV, Smith JK, Kwock L, et al.Cerebral blood volume measurements and proton MR spectroscopy in grading of oligodendroglial tumors.AJR Am J Roentgenol, 2007, 188(1):204-212.
[21]Narang J, Jain R, Scarpace L, et al.Tumor vascular leakiness and blood volume estimates in oligodendrogliomas using perfusion CT: an analysis of perfusion parameters helping further characterize genetic subtypes as well as differentiate from astroglial tumors.J Neurooncol,2011, 102(2): 287-293.
[22]Narang J, Jain R, Scarpace L, et al.Multimodal MR imaging(d iffusion, perfusion, and spectroscopy): is it possible to distinguish oligodendroglial tumor grade and 1p/19q codeletion in the pretherapeutic diagnosis? AJN R Am J Neuroradiol, 2013, 34(7):1326-1333.

