慢性高原病患者脑灰质变化的VBM-MRI研究
刘彩霞,鲍海华*,李伟霞,赵希鹏,吴有森,张红迁,王丽红
慢性高原病(chronic mountain sickness,CMS)是人体长期生活在高原因习服失败(failure of acclimatization;指移居人群)或丧失适应(loss of adaptation;指世居人群)的临床综合征[1],是威胁高原人民健康的常见病及多发病。缺氧是引起慢性高原病的重要的原因,在高原生活的人群,机体处于长期慢性缺氧刺激,致使CMS患者出现红细胞过分代偿、血红蛋白增高,从而导致血液淤滞及缺氧改变。神经系统抗氧能力差,皮质区对缺氧最敏感。在一些急性高原病患者中发现微形态学的损伤,例如脑肿胀、皮质萎缩、皮质及皮层下的损伤[2-3]。研究发现,曾经一次或者多次暴露在极高海拔地区的登山者脑内出现左侧锥体束、左侧角回的体素减少,皮质脊髓束、胼胝体及上纵束等FA值的减低[4-5]。也有研究发现,适应生活在海拔2300~4000 m地区的正常成人不同脑区的灰白质结构发生改变[6]。
基于体素的MRI形态学(voxel-based morphometry, VBM)技术是一种无偏的全自动分析技术,能定量计算大脑某些灰质、白质区域密度和体积的变化,是客观评价大脑局部组织差异的一种重要方法,具有较高的客观性和准确性。此技术已经越来越多地应用于研究多种疾病导致的脑形态学改变[7],并显示了良好的应用前景。笔者应用优化的VBM技术,对CMS患者进行全脑灰质结构的形态学测量,分析其脑灰质结构的改变,从影像学角度探索长期慢性缺氧对大脑结构的影响。
1 材料与方法
1.1 研究对象
1.1.1 病例组
搜集2012年12月至2013年12月于青海大学附属医院住院、门诊部及体检中心确诊的CMS患者,CMS组入选标准:(1)慢性高原病国际诊断标准(青海标准)[8];(2)常规头颅MRI无其他脑实质异常;(3)病人无MRI检查的各项禁忌证。CMS组患者共计14例,年龄平均(41.64±8.30)岁;受教育年限平均(10.50±5.93)年,居住海拔高度平均(3950±300.64) m。并采用青海CMS计分法[8]对CMS的严重程度进行计分,CMS组平均计分(12.71±3.07)分。1.1.2 正常对照组
通过招募,纳入年龄、受教育程度和居住海拔高度与CMS组相匹配的12例正常志愿者作为对照,由于1例头动伪影较大而被剔除,正常对照组共计11例。既往无脑器质性疾患,体检无阳性体征,血常规检测及血压正常;年龄平均(40.27±9.61)岁,受教育程度平均(13.55±4.66)年;居住海拔平均(3609±533.77) m;青海CMS计分平均(3.82±1.17)分。CMS组及对照组人口统计及临床资料见表1。
CMS组与对照组在年龄、受教育年限、居住海拔高度的差异无统计学意义。所有入选者均为右利手,均无脑外伤、脑血管意外及精神疾病史。由于CMS发病率男性高于女性,为消除性别之间的差异,两组均选取男性研究。所有受检者在参与实验前均被告知相关事宜、取得受检者同意,并签订知情同意协议书。本研究经本院伦理委员会的审核批准。
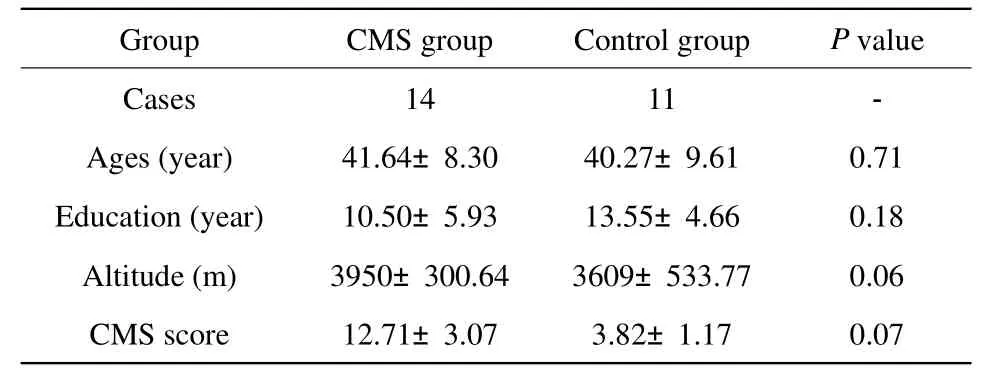
表1 CMS组和对照组的人口统计及临床资料Tab.1 Demographic and physiological characteristic of CMS group and control group.
1.2 MR检查方法
采用Philips Achieva 3.0 T TX多源发射MR扫描系统,标准头颅8通道线圈完成扫描序列。所有对象双耳塞上适当大小棉球以减少噪音的影响并用海绵垫固定两侧。以听眦线为基线精确定位,所有研究对象首先进行常规头部MR成像获得T1和T2图像,由1名经验丰富的影像科医师对其进行诊断,无明显脑实质异常者进入后续的序列扫描。采用超快速场回波(TFE)序列获取3D-T1结构像,扫描参数:TR 7.5 ms,TE 3.7 ms,激发角度7º,层厚2 mm,层间隔-1 mm,矩阵256×256,连续获取176层矢状面图像覆盖全脑。所有扫描均由同一名影像科医师操作完成。
1.3 数据处理及统计分析
在Matlab 2010b (the Math Workes,USA)平台上,采用统计参数图(statistical parametric mapping,SPM8)(www.fil.ion.ucl.ac.uk./spm8/)中的嵌套软件VBM8toolbox进行数据处理。数据处理的基本步骤:(1)检查每个被试的扫描伪迹及整体的解剖异常;(2)调整图像的原点为前联合AC (anterior commissure,AC);(3)将采集到的3D结构图像分割得到灰质、白质及脑脊液后,运用DARTEL工具箱来实现高维度的配准与标准化,体素大小1.5 mm×1.5 mm×1.5 mm;(4)将雅可比算法应用于数据进行调制,以保证灰质总体积在空间标准化的前后不变;(5)应用半高全宽为8 mm的三维高斯平滑核进行图像的空间平滑处理,以减少个体带来的差异;(6)最后利用参数统计检验对平滑后的脑灰质图像进行组间分析,定量测出脑灰质不同区域体积,从而量化分析脑形态上的差异。其统计分析采用两样本t检验进行比较,检验参数t>3.485,P<0.01(未校正),选取相邻体素(voxels)大于100个以上的组块(cluster)视为有差异的脑区,并将发生差异的脑区叠加于结构图模板,并利用XjView软件包对有差异的具体解剖位置进行分析。
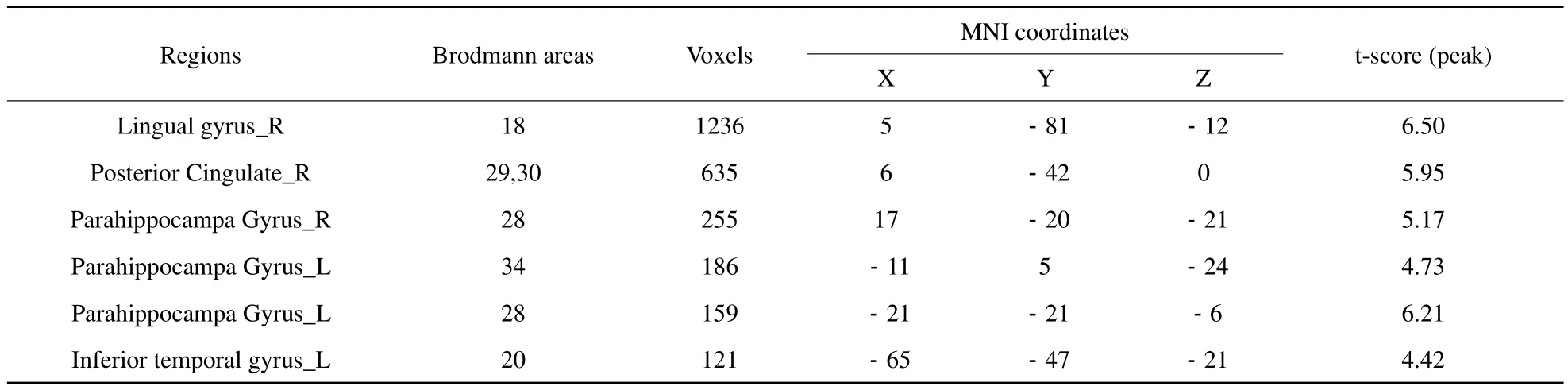
表2 CMS组与对照组相比灰质增加脑区的统计结果Tab.2 The statistic results of increased gray matter voxels in CMS group compared with control group
2 结果
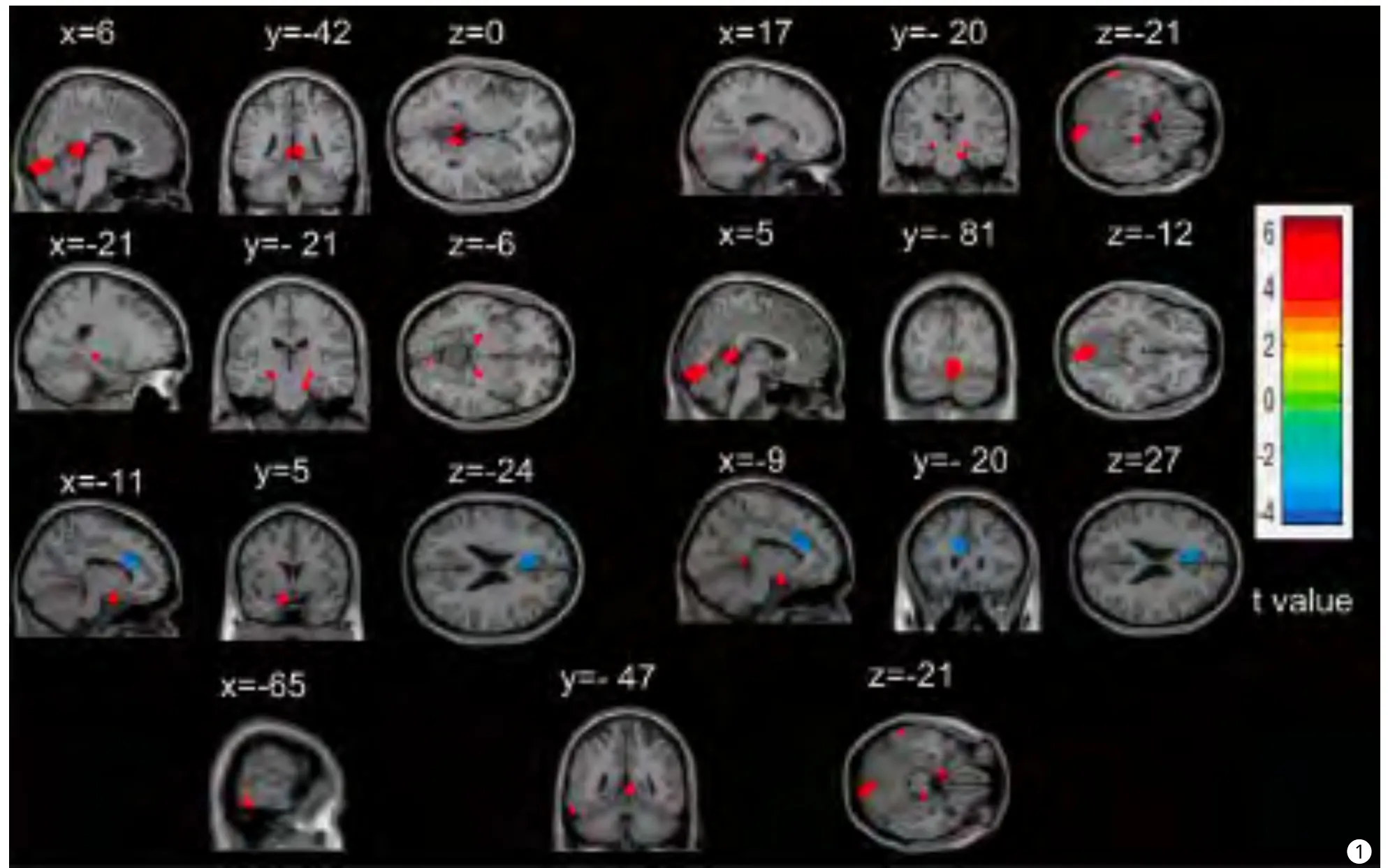
图1 CMS组与对照组相比灰质体积有差异脑区的统计参数图。红色显示CMS患者相对于正常对照组灰质体积增加的脑区,包括:右侧舌回、后扣带回、双侧海马和左侧颞下回;蓝色显示CMS患者相对于正常对照组灰质体积减少的脑区:左侧前扣带回(统计阈值设为P<0.001,cluster size>100,未校正)Fig.1 The statistical parametric map of gray matter volume difference in CMS group compared with control group.Compared with the normal control group, red display the GM volume increased regions of CMS group, include right lingual gyrus, right Posterior Cingulate, bilateral Parahippocampa Gyrus,left ilferior temporal gyrus and blue display the reduced regions in left anterior cingulated.The statistical threshold is set to P<0.001, cluster size>100,uncorrected.

表3 CMS组与对照组相比灰质减少脑区的统计结果Tab.3 The statistic results of reduced gray matter voxels in CMS group compared with control group.
本研究中CMS组14例,对照组12例,对照组中由于1例头动伪影较大而剔除。所有实验对象的常规T1、T2像无明显脑实质异常,两组全脑总体积、白质体积及灰质体积之间的差异无统计学意义。相对于对照组,CMS组右侧舌回、后扣带回、双侧海马旁回及左侧颞下回灰质体积增加(表2,图1);左侧前扣带回灰质体积减少(表3,图1)。
3 讨论
国内外有关慢性高原病的研究很多集中于流行病学、病理生理学、神经化学、病因学和针对该病的诊断和治疗上[1,8-11],而在神经影像方面的研究却很少。
人脑皮层解剖结构具有可塑性[12],可在结构和功能上修改自身以适应客观事实改变。长期高海拔低氧刺激下,血红蛋白浓度以及动脉血氧饱和度的变化改变了大脑血流的氧输送情况,最终导致大脑结构的累积性改变[13-14]。大脑是身体的控制中心,在高海拔低氧环境下,心血管和呼吸系统的适应及非适应性改变通过传入神经反馈作用于大脑的控制中心,也可能引起相应脑区域的结构改变[15]。
灰质的显微结构为神经细胞、纤维、神经胶质和血管错综复杂的混合,从解剖角度来看,灰质体积的增加可能与神经细胞增生、突触增多或者血管改变相关。大脑皮质分为新皮质和古老的异生皮质,人类的新皮质约占全部皮质的96%。新皮质具有神经再生的能力,缺氧能够诱导这种神经的再生[16]。脑缺血是指脑血流量减少以致不足以维持脑的正常代谢、功能及维持脑组织结构,在灌注成像上可见明显的低灌注改变[17]。对CMS患者脑CT灌注研究发现,CMS患者脑灰质CBF下降,MTT和TTP延长,说明脑组织处于缺血、缺氧状态[18],脑缺血能够刺激小胶质细胞和巨噬细胞增殖[19]。本研究结果显示CMS患者较对照组右侧舌回、后扣带回、双侧海马旁回及左侧颞下回灰质体积增加,说明CMS患者该部分脑区对缺氧较对照组敏感。海马旁回是学习和记忆加工的重要脑区,并可抑制间脑促进呼吸的区域[6],而低氧使海马旁回神经细胞增加,降低低氧通气的功能,加重缺氧,因此笔者推测这可能是CMS发病机制之一[9]。对高海拔移民者适应生活两年的人脑结构研究也发现了右侧海马旁回灰质体积较低海拔人群增加[6]。后扣带回是默认模式网络的中心节点之一,在默认模式的网络中发挥着核心作用,与海马旁回同是处理情节和工作记忆的重要构成部分,海马旁回和后扣带回灰质体积的变化,可能与CMS患者记忆力下降有一定的联系[20-21]。右侧舌回是本研究中灰质增加最明显的区域,舌回是视区所在位置,负责视觉冲动的传导。另外,颞下回为视觉中枢V4区的一部分,这个区域与复杂的形觉和色觉功能相关[22],舌回和颞下回灰质密度的改变,这有助于理解CMS患者视力下降现象。
前扣带回是突显网络(salience network,SN)的重要节点。SN能够从来自体内、外大量的认知或情感信息中正确鉴别当前最显著的信息,并指导相应系统及网络的活动[23],主要参与注意、工作记忆、高级控制任务的启动。本研究结果显示CMS患者前扣带回的灰质体积明显萎缩,这有助于解释流行病学调查中发现CMS患者不同程度的认知功能损伤、记忆力下降现象[8,20-21]。
高原缺氧对脑结构的影响是一个复杂的过程,受到多种因素的影响。笔者利用DARTELVBM方法初步探讨了CMS患者全脑灰质体积的变化,结果CMS组患者较对照组右侧舌回、扣带回、双侧海马旁回及左侧颞下回灰质体积增加,左侧前扣带回灰质体积减少,说明不同脑区对缺氧的耐受不同。本研究脑白质未见明显异常,这也验证了CMS患者脑灰质对缺氧的敏感性高于脑白质[12]。
笔者初步探讨了慢性缺氧对脑结构的影响,这仅是一个横向的研究,样本量较小,难以做出CMS患者严重程度及在高原居住时间长短的分层分析。没有设计神经心理学的测验,对研究中发现的阳性结果的解释主要依赖于其他学者的研究结果。后面将进一步扩大样本量,增加神经心理学的测试、DTI脑白质完整性研究、BOLD脑功能成像研究等,提供对CMS患者脑结构和功能改变的更多证据,增进我们理解缺氧对大脑结构和功能的影响。
[References]
[1]Wu TY.The latest research progress of chronic mountain sickness in Qinghai Xizang plateau of China.Chin J Pract Inter Med, 2012, 32(5):321-323.吴天一.我国青藏高原慢性高原病研究的最新进展.中国实用内科杂志, 2012, 32(5): 321-323.
[2]Fayed N, Modrego PJ, Morales H.Evidence of brain damage after high-altitude climbing by means of magnetic resonance imaging.Am J Med, 2006, 119(2): 1-6.
[3]Rostrup E, Larsson HB, Born AP, et al.Changes in BOLD and ADC weighted imaging in acute hypoxia during sea-level and altitude adapted states.Neuroimage, 2005, 28(4): 947-955.
[4]Di Paola M, Bozzali M, Fadda L, et al.Reduced oxygen due to highaltitude exposure relates to atrophy in motor-function brain areas.Eur J Neurol, 2008, 15(10): 1050-1057.
[5]Zhang H, Lin J, Sun Y, et al.Compromised white matter micro structural integrity after mountain climbing: evidence from diffusion tensor imaging.High Alt Med Biol, 2012, 13(2): 118-125.
[6]Zhang J, Zhang H, Li J, et al.Adaptive modulation o f adult brain gray and white matter to high altitude: structural MRI studies.PLoS ONE,2013, 8(7): e68621.
[7]Zhang J, Zhang CZ, Zhang YT.Advanced clinical application of voxelbased morphometery.Int J Med Radiol, 2010, 33(4): 314-316.张敬, 张成周, 张云亭.基于体素的形态学测量技术临床应用进展.国际医学放射学杂志, 2010, 33(4): 314-316.
[8]León-Velarde F, Maggiorni M, Reeves JT, et al.Consensus statement on chronic and subacute high altitude disease.High Alt Med Biol,2005, 6(2): 147-157.
[9]An WJ, Gao F.Research progess about pathogenesis of chronic mountain sickness.Med Recapit, 2009, 15(14):2153-2154.安文静, 高芬.慢性高原病发病机制研究进展.医学综述, 2009,15(14): 2153-2154.
[10]Negi PC, Asotra S, V RK, et al.Epidemiological study of chronic mountain sickness in natives of Spiti Valley in the Greater Himalayas.High Alt Med Biol, 2013, 14(3): 220-229.
[11]Penaloza D, Arias-Stella J.The heart and pulmonary circulation at high altitudes: healthy highlanders and chronic mountain sickness.Circulation, 2007, 115(6): 1132-1146.
[12]Draganski B, Gaser C, Busch V, et al.Neuroplasicity: changes in grey matter induced by training.Natural, 2004, 427(6972): 311-312.
[13]Iwasaki K, Zhang R, Zuckerman JH, et al.Impaired dynamic cerebral autoregulation at extreme high altitude even after acclimatization.J Cereb Blood Folw Metab, 2011, 31(1): 283-292.
[14]Yan X, Zhang J, Gong Q, et al.Cerebrovascular reactivity among native-raised high altitude residents: an fMRI study.BMC Neurosci,2011, 12: 94.
[15]Zhang J, Yan X, Shi J, et al.Structural modifi cations of the brain in acclimatization to high-altitude.PLoS One, 2010, 5(7): e11499.
[16]Zhu C, Qiu L, Wang X, et al.Age-dependent regenerative responses in the striatum and cortex after hypoxia-ischemia.J Cereb Blood Flow Metab, 2009, 29(2): 342-354.
[17]Men QL, Sun XJ.Advances of magnetic resonance perfusion imaging in hypertensive cerebrovasular diseases.Chin J Magn Reson Imaging,2011, 2(5): 384-387.孟庆雷, 孙学进.磁共振灌注成像在高血压脑血管病的应用进展.磁共振成像, 2011, 2(5): 384-387.
[18]Wang DY, Bao HH, Zhao XP, et al.Multi-slice spiral computed tomography manifestations of brain and cerebral hemodynamics in chronic mountain sickness.J Pract Radiol, 2011, 27(3): 322-326.王铎尧, 鲍海华, 赵希鹏, 等.慢性高原病脑部MSCT表现与血流动力学研究.实用放射学杂志, 2011, 27(3): 322-326.
[19]Pforte C, Henrich-Noack P, Baldauf K, et al.Increase in proliferation and gliogenesis but decrease of early neurogenesis in the rat forebrain shortly after transient global ischemia.Neuroscience, 2005, 136(4):1133-1146.
[20]Yan X, Zhang J, Gong Q, et al.Prolonged high-altitude residence impacts verbal working memory: an fMRI study.Exp Brain Res, 2011,208(3): 437-445.
[21]Yan X, Zhang J, Gong Q, et al.Adaptive infl uence of long term high altitude residence on spatial working memory: an fMRI study.Brain Cogn, 2011, 77(1): 53-59.
[22]Schoenfeld MA, Noesselt T, Poggel D, et al.Analysis of pathways mediating preserved vision after striate cortex lesions.Ann Neurol,2002, 52(6): 814-824.
[23]Fedy A, Carlier R, Roby-Brami A, et al.Longitudinal study of motor recovery after stroke: recruitment and focusing of brain activation.Stroke, 2002, 33(6): 1610-1617.

