HBV相关肝硬化结节多步演变MR影像特征研究现状及最新进展
张岩岩,张琦,李云芳,李宏军
肝细胞癌(HCC)是肝脏最常见的原发恶性肿瘤,是世界上导致人类死亡的第三大癌症,每年有超过70万新发病例,近60万患者死亡。我国是世界上HCC发生率较高的国家之一,高达52.1/10万人口,占全世界新发病例的50%以上[1-2]。肝癌与嗜肝病毒尤其是乙肝病毒感染密切相关,由感染病毒到慢性炎症到肝硬化最后进展为肝癌的发展过程已被世界公认,中国85%的肝癌都与乙肝相关。1995年世界胃肠病大会国际工作组(International Working Party,IWP)对肝细胞癌的演变机制进行推测,认为:再生结节(RN)可发展为低级不典型增生结节(LGDN)和高级不典型增生结节(HGDN)再发展为带亚灶HCC的DN,进一步发展为小肝细胞癌(small HCC),最终成为肝细胞癌(HCC),所以早期肝癌与肝硬化结节具有密切关系,如果能准确识别并鉴别肝硬变背景下结节的性质将有助于对HCC高风险人群进行病情监测、治疗方案选择及预后评估。
血流动力学的改变是肝硬化结节癌变过程中一个重要的伴随症状,RN和LGDN以门静脉供血为主,随着结节去分化的进展,血管生成通路被激活,尤其是以非配对小动脉及微动脉增加为特点[3-4],结节也由以门静脉供血为主转变为以肝动脉供血为主,90%以上肝细胞癌是以丰富的动脉供血为主,表现为动脉早期强化明显,门静脉和平衡期清除也更明显,因此病灶内的血流动力学研究已成为影像学的研究热点。然而由HGDN向HCC转变过程中,HGDN与HCC动脉血供分布情况有重叠,所以实际工作中,两者的鉴别仍然相当困难。
1 RN
RN是在肝硬化基础上增生而形成的肝实质小岛,为良性的肝硬化结节,通常多发或弥漫散布于整个肝脏。它由再生的肝细胞构成,周围有纤维隔围绕,其结构和血供与正常的肝细胞非常相似。根据直径大小,RN可分为微结节(≤3 mm)、大结节(>3 mm)和混合结节。2 cm以上的RN多见于长期存在布加综合征[5]或患有自身免疫性肝炎的肝硬化患者[6]。RN在T1WI和T2WI上多表现为与肝实质相同的等信号,少数在T1WI上可呈高信号,T2WI上呈低信号,RN在T1WI上高信号可能与脂肪、蛋白或铜沉积有关,在T2WI上低信号可能与含铁血黄素沉着或周围有被炎细胞和增生的假胆管浸润的纤维包膜有关。RN绝少在T2WI上显示高信号。部分RN内有铁质沉积,MRI是目前无创性评价活体肝脏铁含量的有效工具之一,它可以较敏感地检测到体内铁含量变化所致的局部微环境的改变[7],由于铁的顺磁效应在T1WI、T2WI上均显示低信号。磁敏感加权成像(Susceptibility weighted imaging,SWI)是目前检测铁沉积最敏感的技术[8]。RN结节主要由门静脉供血,静脉注射Gd-BOPTA后结节强化程度同周围肝实质相似[9],但延迟期呈略低于肝实质的低信号(图1)。
2 不典型增生结节(DN)
DN是指一组有不典型增生即存在细胞质和细胞核异常而在组织学上无恶性依据,直径在1 cm以上的肝细胞群。DN是一种肿瘤性病变,也可能属于癌前病变,由于该病变可有也可无细胞或结构异型性,因此分为低级DN和高级DN,两者的异型程度和恶性潜能依次增高[10]。Iavarone等[11]在一项36个LGDN和HGDN穿刺标本组成的前瞻队列研究中证实随着结节体积的增大,后者具有更高的恶转倾向。美国肝病研究学会(American Association for the study of liver diseases,AASLD)最新制订的指南指出,DN不能和肿瘤一样治疗,确诊或怀疑DN者不应过于监测或追踪[12]。随着DN继续进展,其中可出现癌变细胞,及早期肝癌。
2.1 低级不典型增生结节(LGDN)
低级DN是一种克隆性或肿瘤性病变而不是增生性病变,结节具有轻度异型性,结构上尚未见明确异型性。其内可见大细胞或小细胞改变,包含许多汇管区和终末肝小静脉,常呈正常分布,确诊需要肝穿活检或手术病理。低级DN和一般再生性结节的区别比较困难[13],提示低度DN的特征只包括病变的大小以及出现孤立的无胆管伴行的动脉。MRI被认为是显示DN最敏感的影像方法,其敏感性文献报道差异较大,从15%~60%都有,癌变的概率也多少不一。典型DN的MRI特点为T2WI低信号,T1WI上信号多变(低信号,等信号或高信号)。如果DN含铁量明显增高,则在T1WI、T2WI上均表现为低信号,增强扫描均无强化。但从动态增强扫描图像,LGDN无法同RN相鉴别。
2.2 高级不典型增生结节(HGDN)
高级DN是指具有中度或以上的细胞学或组织学异型性,未达到HCC水平,但具有许多提示癌前病变或癌的特征:⑴细胞异型性、密度明显增加,是周围肝细胞密度的1.3~2.0倍;⑵结构异型性,形成假腺样或硬癌样改变,肝板增厚(大于3个细胞);⑶结节内结节,提示增殖旺盛。DN的MRI表现可归纳为两类:一类具有“结中结”表现,中央结节为T1WI低信号,T2WI呈等或稍高信号,动态增强为早期强化;其周围在T1WI上为高信号,T2WI为高或等信号,动态增强为逐渐轻度强化;另一类信号较均匀的DN在T1WI以等或稍低信号为主,在T2WI上主要为等或稍高信号,动态增强过程中动脉期强化较明显,门脉期以等信号为主,延迟期为等信号及稍高信号。HGDN很难同高分化肝癌鉴别[14-16],在HGDN内部也可有HCC微灶形成。与HCC的鉴别点是DN极少在T2WI上呈现高信号。LGDN和HGDN在长期的随访中可消失不见,但大多数的HGDN会迅速发展为HCC[17](图2)。
3 小肝癌(SHCC)
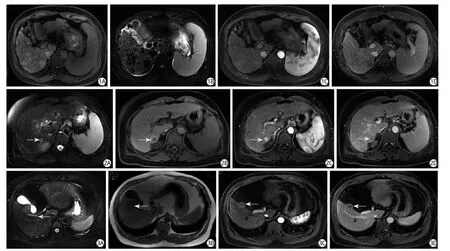
图1 RN。女,48岁。A:轴面T1WI示肝内弥漫多发稍高信号小结节,结节大小不等;B:T2WI示小结节显示为低信号;C:T1WI增强动脉期图像示主动脉明显强化, 肝内结节未见异常强化;D:为延迟3 min后图像,结节呈低信号图2 结中结。男,59岁。A:T2WI示肝右后叶可见小圆形高信号病灶(箭);B:T1WI示病灶呈低信号,周边可见环状高信号影(箭);C:静脉注射钆造影剂后的动脉期病灶呈明显异常强化(箭);D:延迟扫描可见中心病灶明显廓清呈低信号,周边亦可见环状低信号,呈双环征(箭)图3 小肝癌。男,61岁。A:T2WI示肝右前叶近胆囊旁可见类圆形略高信号影(箭);B:团块在T1WI呈低信号(箭);C:增强扫描动脉期病灶明显异常强化(箭);D:延迟3 min后,病灶明显廓清(箭)Fig.1 Shows RNs.Female, 48 Y.A: Axial T1WI image shows diffuse slightly high signal nodules within the liver parenchyma, which vary in size.B:T2WI image could see that the nodules showed low signal.C: T1WI enhancement scanning arterial phase, aorta abdominalis obvious reinforcement,intrahepatic nodules no enhancement.D: Shows delay phase after 3 min, the nodules are low signal.Fig.2 Shows “a nodule within a nodule”.Male, 59 Y.A: T2WI shows a small round high signal intensity nodules (arrow) in the posterior lobe of liver.B: The lesions displays low signal, annular high signal around in the T2WI (arrow).C: Arterial phase the lesion shows visible enhancement (arrow).D: Delay scanning displays center low signal lesion, visible low signal ring around the lesion, a double loop (arrow).Fig.3 Shows a sHCC.Male, 61 Y.A: T2WI image shows a round slightly high signal (arrow) in hepatic anterior right near the gallbladder.B: The lesion shows low signal on T1WI (arrow).C: The lesion displays arterial enhancement (arrow).D: Delay phase after 3 min shows clear out (arrow).
WHO、日本和韩国学者将<2 cm的肿瘤诊断为早期小肝癌[18-19];在我国SHCC是指<3 cm的孤立癌结节或者2个癌结节直径之和<3 cm。我们发现部分sHCC (<1.5 cm)在T1WI和T2WI上呈等信号,仅在增强扫描时明显强化,同样地部分sHCC在T1WI呈高信号,T2WI呈低信号,因此很难和DN鉴别。典型sHCC在T1WI上以低或稍低信号为主,在T2WI以高或稍高信号为主,增强扫描动脉期明显异常强化,延迟期快速廓清。T1WI低信号的主要原因为病灶的纤维化、液化坏死;T2WI高信号是由于肿瘤内血窦增加、脂肪沉积、细胞密度增加及结缔组织减少[20-21]。Ebara等[22]对小肝癌信号改变影响因素的研究表明,T1WI上信号愈高表示癌组织分化愈好,癌内有较多肝糖原或铜沉积,而周围肝组织内有较多锌沉积;T2WI上信号愈高则表示癌组织分化愈低。部分肝癌可见包膜,包膜一般呈双层结构,内层为纤维组织,外层为丰富的受压小血管或新生的胆管,内层比外层薄,T1WI显示肿瘤包膜更为敏感,呈现肿瘤周围的低信号带,增强扫描后于门脉期及平衡期欠规则、环形高信号带。弥散加权成像(diffusion weighted imaging, DWI)对肝脏病变(特别是肝癌)的检出敏感度较常规T2WI序列高[23]。小b值(<200 s/mm2)黑血扩散成像可抑制肝实质的背景血管信号,更有利于病灶的检出;而大b值(>200 s/mm2)提供扩散的信息,有利于肿块的定性[24](图3)。
另外,在MRI检查中的另一难点是肝硬化背景下一些小的(<2 cm)富血供结节,常常没有特异性的影像表现[25],常被误诊为小肝癌。动静脉分流和门静脉末梢阻塞引起的一过性动脉期增强,在影像上要注意与肝癌动脉期的强化相鉴别,但分流引起的动脉期强化常呈楔形,且多分布于肝周。早期的不典型血管瘤亦可出现小肝癌的强化方式,临床需3~6个月后复查,对病灶进行定性诊断。早期高分化肝细胞癌(HCC)与HGDN的诊断及鉴别诊断一直是争论的焦点,也是诊断的难点[19,26]。随着核磁新技术和新型对比剂的不断开发和研究,肝硬化结节的早期诊断及鉴别诊断将成为现实。
[Refercnces]
[1]Sherman M.Epidemiology of hepatocellular carcinoma.Oncology,2010, 78(Suppl 1): 7-10.
[2]But DY, Lai CL, Yuen MF.Natural history of hepatitis-related hepatocellular carcinoma.World J Gastroenterol, 2008, 14(11):1652-1656.
[3]Borzio M, Fargion S, Borzio F, et al.Impact of large regenerative, low grade and high grade dysplastic nodules in hepatocellular carcinoma development.J Hepatol, 2003, 39(2): 208-214.
[4]Roncalli M, Roz E, Coggi G, et al.The vascular profi le of regenerative and dysplastic nodules of the cirrhotic liver: implications diagnosis and classifi cation.Hepatology, 1999, 30(5): 1174-1178.
[5]Brancatelli G, Federle MP, Grazioli L, et al.Large regenerative nodules in Budd-Chiari syndrome and other vascular disorders of the liver: CT and MR imaging fi ndings with clini-copathologic correlation.AJR Am J Roentgenol, 2002, 178(4): 877-883.
[6]Qayyum A, Graser A, Westphalen A, et al.CT of benign hypervascular liver nodules in autoim mune hepatitis.AJR Am J Roentgenol, 2004,183(6): 1573-1576.
[7]Hu S, Hu CH, Zhang JG, et al.Comparative study of MRI R2* with different ROI measurement in iron-overloaded liver.Chin J Magn Reson Imaging, 2012, 3(1): 44-47.胡粟, 胡春洪, 张京刚, 等.感兴趣区设置方法对磁共振R2*值无创评估铁过载肝脏铁含量的影响.磁共振成像, 2012, 3(1): 44-47.
[8]Zeng MS, Li RK.Clinical value of susceptibility-weighted imaging for studying the multi-step hepatocaicinogenic process of cirrhotic liver nosules.J Clin Hepatol, 2013, 29(1): 38-41.
[9]Choi BI, Han JK, Hong SH, et al.Dysplastic nodules of the liver:imaging fi ndings.Abdom Imaging, 1999, 24(3): 250-257.
[10]Kudo M.Multistep human hepatocarcinogenesis: correlation of imaging with pathology.J Gastroenterol, 2009, 44(19): 112-118.
[11]Iavarone M, Manini MA, Sangiovanni A, et al.Contrast-enhanced computer tomography and ultrasoud-guided liver biopsy to diagnose dysplastic liver nodules in cirrhosis.Dig Liver Dis, 2013, 45(1): 43-49.
[12]Bruix J, Sherman M.Management of hepatocellular carcinoma.Hepatology, 2005, 42(5): 1208-1236.
[13]International Working Party.Terminology of nodular hepatocellular lesions.Hepatology, 1995, 22(3): 983-993.
[14]Lim JH, Choi D, Cho SK, et al.Conspicuity of hepatocellular nodular lesions in cirrhotic livers at ferumoxides-enhanced MR imaging:importance of Kupffer cell number.Radiology, 2001, 220(3): 669-676.
[15]Libbrecht L, Desmet V, RoskamsT.Preneo plastic lesions in human hepato carcinogenesis.Liver Int, 2005, 25(1): 16-27.
[16]Kojiro M, Roskams T.Early hepatocellular carcinoma and dysplastic nodules.Semin Liver Dis, 2005, 25(2): 133-142.
[17]Serste T, Barrau V, Ozenne V, et al.Accuracy and disagreement of computed tomography and magnetic resonance imaging for diagnosis of small hepatocellular carcinoma and dysplastic nodules: role of biopsy.Hepatology, 2012, 55(3) : 800-806.
[18]Hamilton S, Aaltonen L.World Health Organization classifi cation of tumors: pathology and genetics of tumours of the digestive system.Lyon: IARC Press, 2000: 167-169.
[19]Kojiro M.Focus on dysplastic nodules and early hepatocellular carcinoma: an eastern point of view.Liver Transpl, 2004, 10(2 Suppl 1):S3-S8.
[20]Kadoya M, Matsui O, Takashima T, et al.Hepatocellular carcinoma:correlation of MR imaging and histopathologic fi ndings .Radiology,1992, 183(3): 819-825.
[21]Hussain HK, Syed I, Nghiem HV, et al.T2-weighted MR imaging in the assessment of cirrhotic liver.Radiology, 2004, 230(3): 637-644.
[22]Ebara M, Fukuda H, Kojima Y, et al.Small hepatocellular carcinoma:relationship of signal intensity to histopathologic fi ndings and metal content of the tumor and surrounding hepatic parenchyma.Radiology,1999, 210(1): 81-88.
[23]Yang DM, Jahng GH, Kim HC, et al.The detection and discrimination of malignant and benigh focal hepatic lesion: T2 weighted vs diffusionweighted MRI.Br J Radiol, 2011, 84(1000): 319-326.
[24]Chen X, Liang CH, Liu ZY.The application of diffusion-weighted magnetic resonance imaging in liver.Chin J Magn Reson Imaging,2013,4 (1):76-80.陈鑫, 梁长虹, 刘再毅.MR扩散加权成像在肝脏中的应用.磁共振成像, 2013,4 (1):76-80.
[25]Jonathon MW, Hero KH, Saroja AM, et al.MR imaging of hepatocellular carcinoma in the cirrhotic liver: challenges and controversies.Radiology, 2008, 247(2): 311-330.
[26]Kojiro M, Roskams T.Early hepatocellular carcinoma and dysplastic nodules.Semin Liver Dis, 2005, 25(2): 133-142.

