SDS对焙烧沸石物化性质和除氨氮效果的影响*
林 海,郑倩倩,董颖博,金 鑫,张小佩
(北京科技大学 土木与环境工程学院,北京 100083)
近年来水体富营养化问题日益严重,导致太湖等湖泊连续发生蓝藻爆发,而氨氮是造成水体富营养化的主要因素,因而废水中氨氮含量的控制问题日渐受到重视[1-2].为了防止富营养化趋势发展,世界各国在污水脱氮方面开展了广泛的研究.其中吸附与离子交换法由于其占地面积小,操作工艺简单,脱氮效率高得到人们的关注[3].
通过比较目前国内外使用的各种水处理材料,发现天然沸石及改性沸石由于其架状、多孔含水的特殊结构使其拥有较好的离子交换、选择吸附性能,因此在水处理中得到了广泛的研究[4].但是目前改性沸石多采用无机化学药剂改性,虽然对水中氨氮的去除效果明显,但是改性后残存在沸石孔内的药剂又会对水体造成新的污染,而单独的物理改性方式污染物去除率不高[5].基于此,本文采用先有机添加剂十二烷基硫酸钠(SDS)修饰后焙烧加热的顺序对天然沸石进行改性处理(残留在沸石孔内的药剂随水分杂质等一起被烧掉,从而减少了药剂污染),研究了SDS修饰对焙烧沸石去除市政污水处理厂二级出水中氨氮效果的影响,同时对SDS加入前后焙烧改造沸石物理化学性质的变化进行了表征,以期探求出更简便、高效、经济,有实际应用意义的氨氮处理方法.
1 试样准备及测试方法
1.1 实验材料及试剂
试验所用沸石产地为沈阳某地,样品经干燥、粉碎、过150目筛,其粒度组成在0.106~0.15 mm之间.对上述粒度的沸石进行水洗、抽滤、110 ℃恒温烘箱中烘干2~3 h,储存在干燥器中备用,其主要化学成分(由沸石生产厂商提供)见表1.
表1沸石主要成分
Tab.1Maincompositionofzeolite %
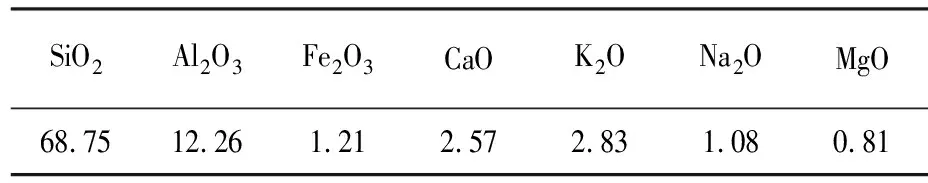
SiO2Al2O3Fe2O3CaOK2ONa2OMgO68.7512.261.212.572.831.080.81
试剂:十二烷基硫酸钠(SDS)、酒石酸钾钠、纳氏试剂、氢氧化钠、盐酸、NH4Cl,均为分析纯.
1.2 仪器及设备
WFZ UV-2000型紫外-可见分光光度计;HZQ-F160型恒温空气振荡培养箱;FA 1104电子天平; DHG-9053A型电热恒温鼓风干燥箱;SX-10-13型箱式电阻炉;MY3000-6智能型混凝试验搅拌仪;JEOL钨灯丝扫描式电子显微镜JSM-6510A(误差范围0.1 %~0.3%);MXP21VAHF型X射线衍射仪; V-Sorb 4800P比表面积和孔径测试仪(误差范围3%~5%);Magna-750傅里叶变换红外光谱仪.
1.3 实验方法
1.3.1 天然沸石的改造
单独焙烧沸石:本课题组前期研究发现,制造单独焙烧沸石的最佳改造条件为:焙烧温度400 ℃,焙烧时间0.5 h,焙烧气氛为常氧,冷却方式为随炉冷却,焙烧改造最优沸石的氨氮去除率达到了71.24%,因此本次研究采用此最佳条件制造出单独焙烧沸石.
SDS修饰后的焙烧沸石:称取天然沸石 4 g放入盛有一定浓度的SDS溶液的烧杯中,在搅拌器上搅拌 120 min,静置30 min后过滤脱水、烘干;然后将烘干样品置于马弗炉中,在一定温度下加热一段时间;取出加热后的焙烧沸石,放在原容器内自然冷却,用去离子水清洗后抽滤,将其在105 ℃下烘干,备用.
1.3.2 吸附试验
配制氨氮浓度为20 mg/L的水样,加入0.5 g 不同条件下制备的改性沸石,于室温下,转速为300 r/min搅拌吸附120 min,静置30 min后,用0.45 μm滤膜抽滤,取适量上清液,测定其中氨氮含量.其中每个沸石样品的测氨氮试验均做3次平行试验,求平均值为最终得出的氨氮含量的数据.
1.3.3 阳离子交换容量的测定
准确称取0.2 g样品于100 mL烧杯中,加25 mL 1mol/L NH4Cl溶液,100 ℃水浴加热30 min(中间轻轻摇动2次),取出,用定量滤纸过滤,将残渣全部转入滤纸并多次洗涤烧杯壁和滤纸至无Cl-1离子存在.残渣连同滤纸浆一起用1 mol/L KCl溶液洗回原烧杯(约20 mL),加2.5 mL中性甲醛溶液(2+1),2滴酚酞指示剂,用0.1 moL/L NaOH滴定至PH 9.10即为终点.
根据下式计算阳离子交换容量(CCEC,mmol/100 g)
CCEC=C×V/G×100.
式中:C为NaOH溶液的浓度,mol/L;V为消耗NaOH溶液的体积,mL;G为样品的质量,g.
其中每个沸石样品的阳离子交换容量的测试都进行了3次平行试验,取平均值为样品最终测得的阳离子交换容量.
1.4 分析测试方法
1.4.1 氨氮浓度测试
氨氮含量的测定采用国家标准纳氏试剂比色法 GB 7479-87.
其中氨氮去除率:以r(%)表示,按下式计算:
式中:C1为剩余氨氮浓度,mg/L;C0为初始氨氮浓度,mg/L;r为氨氮去除率.
1.4.2 表征手段
利用扫描电镜(SEM)对改造前后沸石颗粒表面形貌和结构变化进行观察分析;同时利用能谱分析(EDS)对沸石颗粒微区成分的变化进行描述;利用比表面积及孔径分析仪,对不同改造条件下沸石颗粒比表面积、孔容积、孔直径的变化进行测试分析[12];XRD用来测试样品晶体结构的变化;IR用来表征样品基团的变化;阳离子交换容量用来估测样品离子交换容量的大小.
2 试验结果与讨论
2.1 SDS修饰下焙烧沸石吸附性能的变化规律
2.1.1 SDS用量的影响
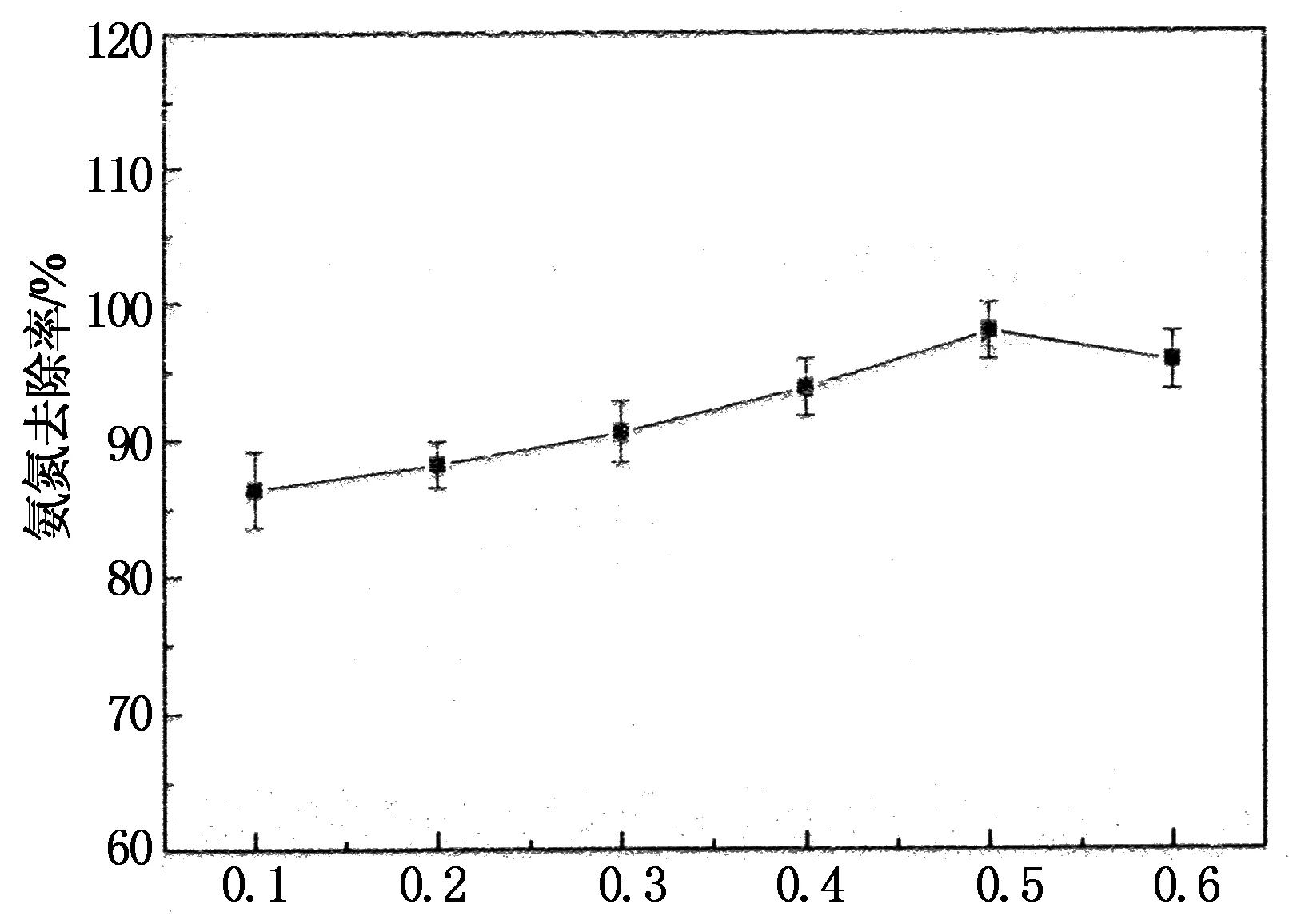
在焙烧温度为400 ℃,加热时间 30 min,焙烧气氛为常氧,随炉冷却的条件下,不同的 SDS用量对氨氮去除效果影响结果见图1.
SDS质量浓度/%
图1表明随着SDS添加量的增加,改造沸石对氨氮的去除率有所上升.当SDS质量浓度达到0.5%时,氨氮去除率达到最大(97.86%).经分析认为,阴离子表面活性剂SDS与天然沸石作用后,一部分SDS与沸石发生化学作用进入沸石内部,提高了沸石对氨氮的离子交换性能.另一部分包覆在沸石表面和孔道内未与沸石发生作用的添加剂,经过焙烧之后,这些表面活性剂连同孔内水分杂质被烧失的同时,沸石被阻塞的孔道被有效打开,沸石的比表面积增大,进而增加其静电力与色散力,使得沸石对水中氨氮的物理吸附作用增强[6].
2.1.2 SDS修饰焙烧沸石正交试验
由于沸石焙烧气氛、SDS浓度、焙烧时间、焙烧温度对焙烧沸石氨氮去除率均有较大影响,为了考察上述因素对焙烧沸石效果影响的程度大小,采用四因素三水平进行了正交实验.正交表设计如表2所示.
实验结果如图2所示,利用极差法对正交实验表进行结果处理,得出影响氨氮去除率的因素从大到小依次为焙烧温度>焙烧时间>SDS浓度>焙烧气氛,各因素的最优水平为,焙烧温度为400 ℃,焙烧时间为0.5 h,SDS浓度为0.5%,焙烧气氛为常氧.在最佳SDS修饰焙烧条件下,氨氮去除率可达98.79%,比单独焙烧改性提高了27个百分点,比天然沸石氨氮去除率提高45%.
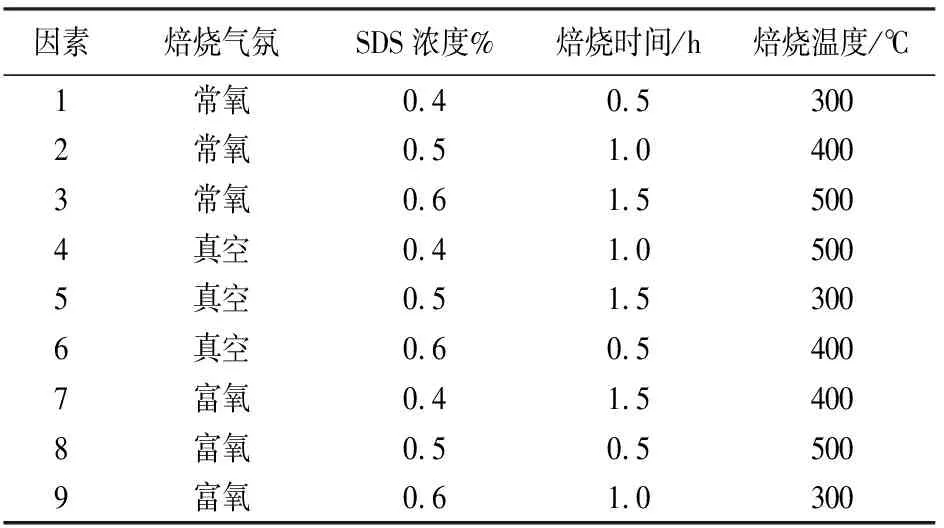
表2 SDS修饰焙烧沸石正交实验数据
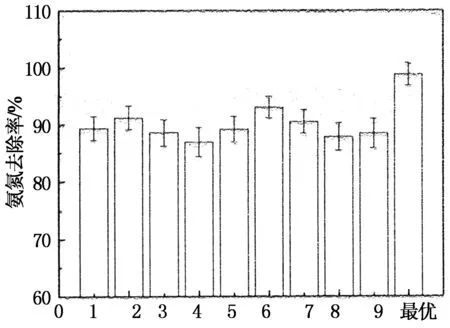
正交实验因素
2.2 改造前后沸石物化性质表征
2.2.1 形貌特征
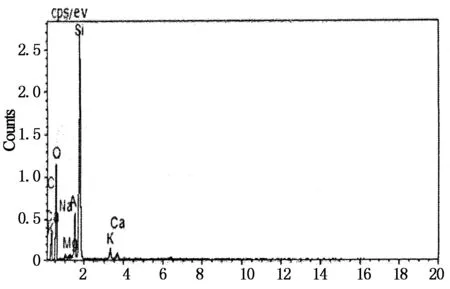
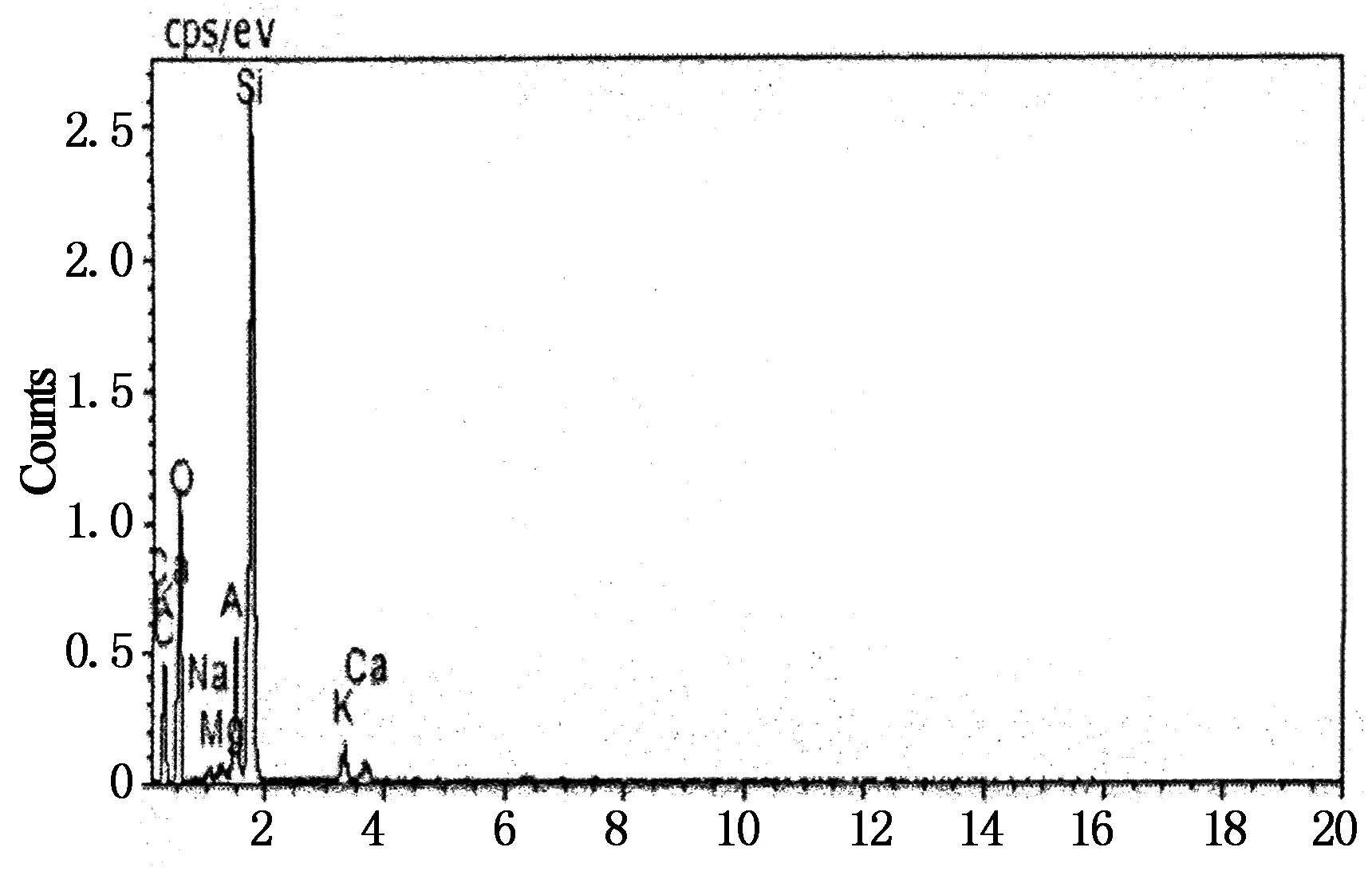
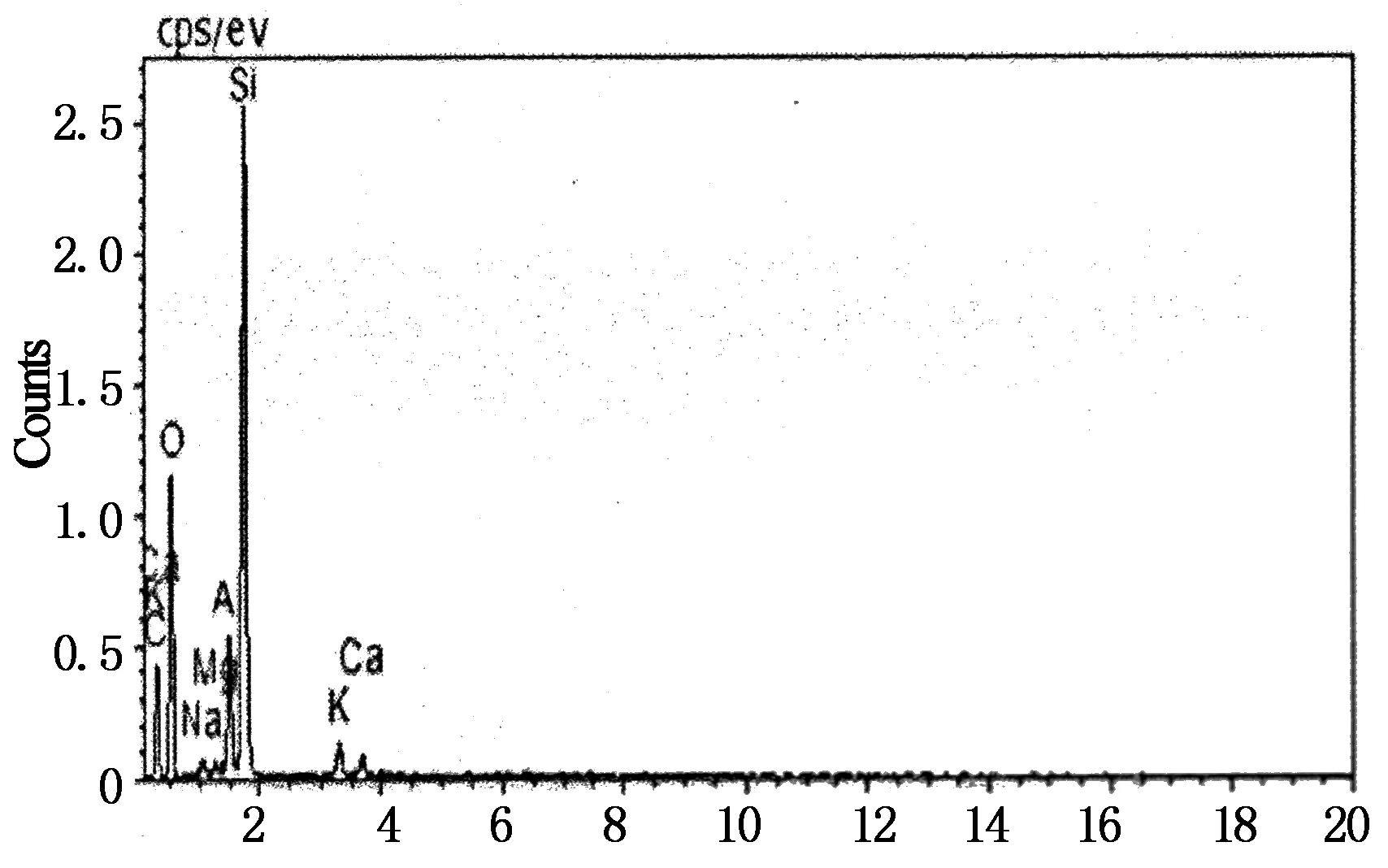
分别对天然沸石、单独焙烧沸石、SDS表面修饰焙烧沸石进行扫描电镜 (SEM)和能谱图分析(EDS),结果如图3~5所示.

(a)
keV

(a)
keV

(a)
keV
从图3可以看出天然沸石结构排列紧密,沸石表面布满了杂乱的小颗粒,粗糙不均匀[6].图4为焙烧沸石的扫描电镜图,不同于天然沸石,其表面形貌出现团絮状,线条变得平缓光滑,微孔明显增多且排列均匀,这说明焙烧改性拓宽了沸石的孔道,并去除了沸石表面和孔道内的杂质[7].图5为SDS修饰焙烧沸石的扫描电镜和能谱分析图,可以看出,SDS修饰焙烧改造沸石表面较单独焙烧沸石光滑,且沸石表面更加松散,出现了更多的孔道,这是因为与沸石之间发生物理化学吸附作用的SDS药剂,在燃烧的过程中促进了沸石颗粒部分杂质、灰分以及内部吸附水的挥发,使得空隙进一步得到释放,表面更光滑,微孔更明显,表面积进一步增大,从而提高了沸石的表面活性[8].

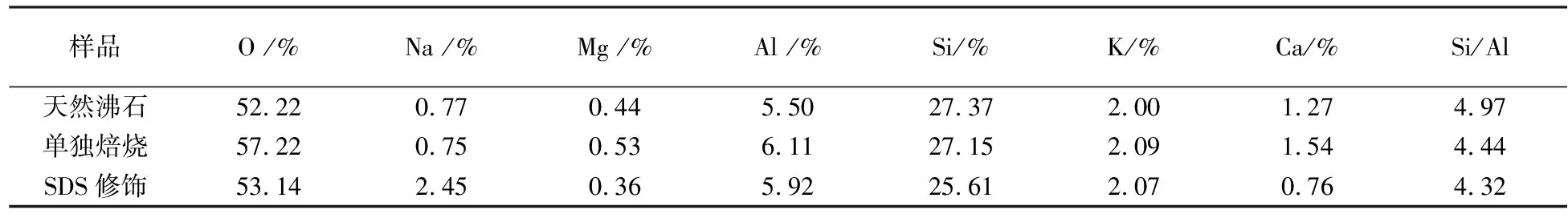
表3 3种沸石样品中主要元素的质量分数
2.2.2 表面结构分析
表4为天然沸石、单独焙烧沸石、SDS修饰焙烧沸石的比表面积及孔径数据分析表.从表中发现,焙烧沸石的多点BET比表面积和BJH脱附累积孔内表面积(31.089 1 m2/g和51.268 9 m2/g)均较天然沸石有了一定程度的提高.这应该是焙烧作用在脱除沸石部分的水和杂质的同时,使得沸石微孔增多,从而使得沸石内外比表面积出现一定程度的增加[10].而焙烧沸石经SDS修饰后,多点BET比表面积和BJH脱附累积孔内表面积较单独焙烧沸石和天然沸石都有了更大程度的提高,且SDS修饰焙烧改造后沸石颗粒的总孔体积(0.082 0 cm3/g)和平均孔直径(11.305 8 nm)较单独焙烧沸石(0.079 8 cm3/g和11.184 9 nm)和天然沸石(0.070 9 cm3/g和8.348 0 nm)出现了较大的增加现象,在数据方面再次说明残留的部分表面活性剂并没有堵塞孔穴,相反其在后续的焙烧燃烧过程中促进了沸石孔内的水和杂质的燃烧和脱除,比表面积有了更进一步的提高,使得沸石与氨氮的接触面积增大,反应活性位增多,从而提高了其吸附性能[11].
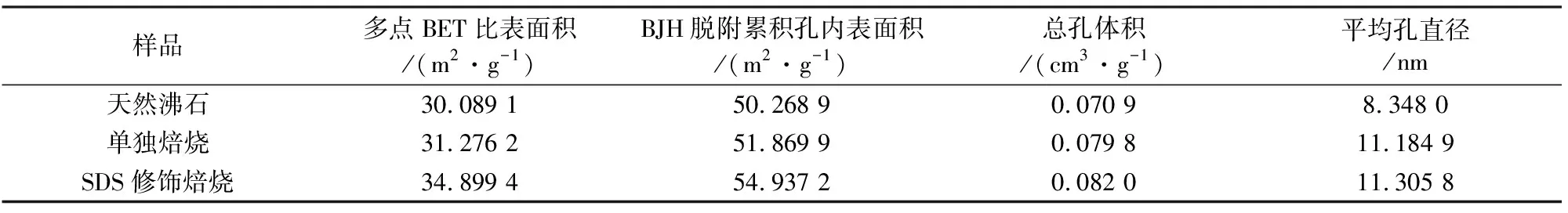
表4 3种沸石样品的比表面积及孔径的比较
2.2.3 XRD分析
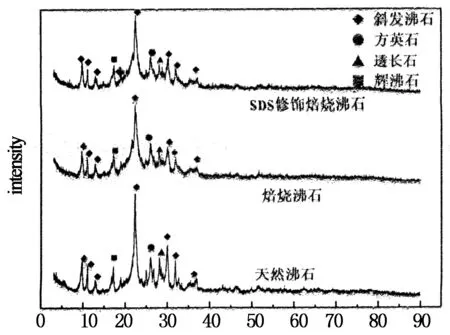
在相同的测试条件下,对天然沸石、单独焙烧沸石、SDS修饰焙烧沸石进行X射线衍射分析,得到XRD衍射图谱,结果如图6所示.
2θ/(°)
分析各XRD衍射峰之间差异可知,焙烧沸石的主衍射峰强度,较天然沸石有一定的降低,这是由于焙烧手段使得沸石的结晶度有所降低,晶格内的晶格缺陷增加,从而使得沸石的表面活性增强[12].而焙烧沸石经SDS有机改性后,主峰的位置发生了偏移,即主峰的2θ由焙烧沸石的23.20°转变为20.00°.由Bragg方程:2dsinθ=nλ(其中θ为入射角,λ为入射线的波长,n为衍射级数,d为间距)可知:SDS修饰焙烧沸石的间距d增大,表明阴离子表面活性剂SDS的加入,增大了沸石的空间,从而提高了沸石的反应活性[8].
2.2.4 IR分析
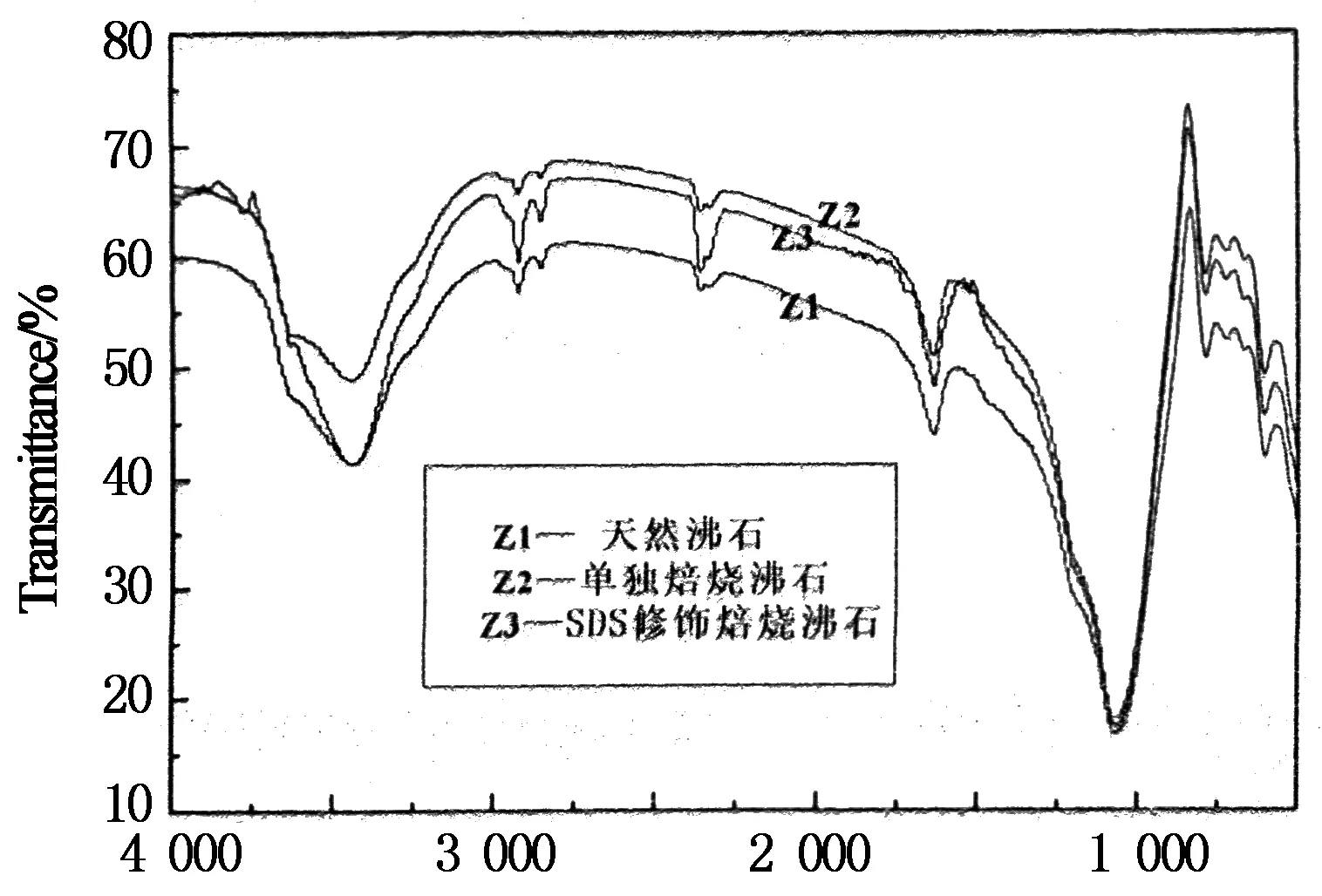
在完全相同的测试条件下,同时对天然沸石、单独焙烧沸石、SDS修饰焙烧沸石进行红外吸收光谱图分析,得到三者红外吸收对比叠谱,见图7.
Wave numbers/(cm-1)
单独焙烧沸石图谱与天然沸石红外图谱相比,Si(Al)-O键的伸缩振动、O-Si(Al)-O的弯曲振动和Si-O-Si(Al)的弯曲振动的峰值及强弱均在测量所允许的误差范围内,且单独焙烧沸石的红外光谱图中并未出现新的特征谱带[13].单独焙烧沸石图谱3 447.71 cm-1,1 637.22 cm-1处缔合态沸石水中O-H伸缩振动和弯曲振动峰较天然沸石图谱中相似位置3 447.30 cm-1,1 635.66 cm-1处吸收峰的强度要弱很多,说明后续高温焙烧处理使得天然沸石中较多的缔合态的结晶水被逸出,提高了沸石的吸附性能[14].
对比单独焙烧沸石的图谱,SDS修饰焙烧沸石的红外光谱发生了如下变化:在2 916 cm-1及2 847 cm-1处出现了两个尖锐的强吸收峰,这归属于十二烷基硫酸钠改性剂中-CH3和-CH2产生的对称和反对称伸缩振动;沸石骨架中Si-O或Al-O吸收振动峰(1 066 cm-1,789 cm-1,465 cm-1)的强度和面积也发生了变化,表明一定量的十二烷基硫酸钠(SDS)通过复杂的化学作用已复合进入了沸石中,使得沸石内部结构中的化学基团发生变化,这大概也是沸石氨氮去除率提高的原因[15].
2.2.5 阳离子交换容量结果分析
沸石的阳离子交换容量(CEC)直接影响其在污水处理方面的应用性能,也是评价沸石吸附性和阳离子交换能力的一个重要技术指标.对天然沸石、单独焙烧沸石、SDS修饰焙烧沸石进行阳离子交换容量的测试[16],结果如表5.

表5 不同沸石样品的离子交换容量对比
从表5中可以看出单独焙烧沸石的阳离子交换容量为156.7mmol/100g,相比天然沸石(142.4 mmol/100g)有了一定程度的提高.说明天然沸石经焙烧改性后,由于沸石颗粒微孔的增多,比表面积的增大,使得沸石表面的吸附点位增多,离子交换更容易进行[7].SDS修饰焙烧沸石阳离子交换容量为177.9 mmol/100 g,较单独焙烧沸石有了更大程度的提高,进一步证明,在SDS表面修饰和焙烧的相互作用下,有利于沸石吸附的物理化学性能都有一定程度的提高,所以较单纯焙烧沸石氨氮吸附能力提升较大[17].
3 结 论
1)经SDS修饰后,焙烧沸石的氨氮去除效果有了更大幅度的提高,获取的最佳条件为:焙烧温度为400 ℃,焙烧时间为0.5 h,SDS浓度为0.5%,焙烧气氛为常氧,此时改性沸石对氨氮的去除效果最好,氨氮去除率可达98.79%,与不修饰相比,氨氮去除率提高了27.52个百分点.
2)各物化性质测试手段分析表明,SDS的加入使得焙烧沸石微孔结构得到了充分扩展,比表面积、孔径、孔容积都有所增加,且沸石硅铝比减少,主衍射峰强度有所减弱,沸石内部化学基团也发生一定的变化,Na离子取代了Ca,Mg等离子,离子交换容量也有很大程度的提高,这些物理化学性质的变化促进了沸石除氨氮效率的提高.
[1]LIU J, SU Y, LI Q,etal. Preparation of wheat straw based super absorbent resins and their applications as adsorbents for ammonium and phosphate removal [J]. Bioresource Technol, 2013, 143:32-39.
[2]MOUSSAVI G, TALEBI S, FARROKHI M,etal. The investigation of mechanism, kinetic and isotherm of ammonia and humic acid co-ads-orption onto natural zeolite[J]. Chem Eng J, 2011, 17(3): 1159-1169.
[3]林海, 江乐勇, 赵志英,等.市政污水厂二级出水深度脱氮除磷吸附材料[J].北京科技大学学报,2009, 31 (5):552-554.
LIN Hai, JANG Le-yong, ZHAO Zhi-ying,etal. Adsorption materials of nitrate and phosphate removal in secondary effluent advanced treat- ment [J]. Journal of University of Science and Technology Beijing, 2009, 31 (5):552-554. (In Chinese)
[4]HUANG H, XIAO X M,YAN B,etal. Ammonium removal from aqueous solutions by using natural Chinese (Chende) zeolite as adsorbent[J].J Hazard Mater, 2010, 175(1/3):247-252.
[5]戴双林, 王荣昌, 赵建夫. 改性沸石去除废水中氮和磷的机理与应用[J]. 净水技术, 2011, 30 (6): 53-57.
DAI Shuang-lin, WANG Rong-chang, ZHAO Jian-fu. Mechanism and application of modified zeolite for nitrogen and phosphorus removal in wastewater treatment[J]. Water Purification Technology, 2011, 30(6): 53-57. (In Chinese)
[6]江乐勇, 林海, 宋乾武, 等. 复合沸石脱氮除磷性能研究[J].工业安全与保护, 2011(2): 7-9.
JIANG Le-yong, LIN Hai, SONG Qian-wu,etal. Study on nitrogen and phosphate removal by using compound zeolite [J]. Industrial Safety and Environmental Protection, 2011(2): 7-9. (In Chinese)
[7]COSTA C F M, DINIZ A P, SILVA V J. Influence of calcination temperature on the morphology and magnetic properties of Ni-Zn ferrite applied as an electromagnetic energy absorber [J]. Journal of Alloys and Compounds, 2009(483):563-565.
[8]翁晴. SDS改性沸石吸附亚甲基蓝的研究[J]. 福建工程学院学报, 2012, 10( 3):214-217.
WENG Qing. Study on absorption of methylene blue by sodium dodecyl sulfate (SDS) modified zeolite[J]. Journal of Fujian University of Technology, 2012, 10( 3):214-217. (In Chinese)
[9]HUO H X, LIN H, DONG Y B. Ammonia- nitrogen and phosphates sorption from simu- lated reclaimed waters by modified clinopti- lolite [J]. Journal of Hazardous Materials, 2011, (229/230): 292-297.
[10]LIN L, LEI Z F, WANG L. Adsorption mechanisms of high-levels of ammonium onto natural and NaCl-modified zeolites [J]. Separation and Purification Technology, 2013, 103: 15-20.
[11]LI M Y, Z X Q, ZHU F H,etal. Application of modified zeolite for ammonium removal from drinking water [J]. Desalination,2011,271: 295- 300.
[12]ELAIOPOULOS K, PERRAKI T,GRIGORO-POULOU E. Monitoring the effect of hydrothermal treatments on the structure of a natural zeolite through a combined XRD, FTIR, XRF, SEM and N2-porosimetry analysis [J]. Microporous and Mesoporous Materials, 2010, 134: 29-43.
[13]BASKAN M B, PALA A. Removal of arsenic from drinking water using modified natural zeolite [J]. Desalination, 2011, 281: 396-403.
[14]FAGHIHIAN H, KABIRI T M. Removal of zirconium from aqueous solution by modified clinoptilolite [J]. Journal of Hazardous Materials, 2010, 178: 66-73.
[15]杨效益,张高勇,张威,等. SDS与CTAB混合表面活性剂体系对合成4A沸石的影响[J]. 应用化工,2006, 35(4) : 246-248.
YANG Xiao-yi, ZHANG Gao-yong, ZHANG Wei,etal. Influence of mixture system of SDS and CTAB on synthesis of 4A zeolite[J]. Applied Chemical Industry, 2006, 35(4):246-248. (In Chinese)
[16]郭新锋, 黎艳, 王娟芳, 等. 几种测定膨润土阳离子交换容量方法的比较[J] . 工业计量, 2008, 18 (1): 11-12.
GUO Xin-feng, LI Yan, WANG Juan-fang,etal.Comparison of several measuring methods for bentonite cation exchange capacity [J]. Etrology Test Technology and Verification,2008, 18 (1): 11-12. (In Chinese)
[17]THORNTON A, PEARCE P, PARSONS S A. Ammonium removal from solution using ion exchange on to mesolite an equilibrium study [J]. Journal of Hazardous Materials, 2007, 147: 883-889.

