硒源和硒水平对种公羊血清和精清抗氧化能力的影响
任有蛇,白元生,刘晓妮,焦光月,刘文忠,石磊,赵俊星,吕丽华,张建新,张春香
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.山西省生态畜牧产业管理站,山西 太原 030002)
硒源和硒水平对种公羊血清和精清抗氧化能力的影响
任有蛇1,白元生2,刘晓妮2,焦光月2,刘文忠1,石磊1,赵俊星1,吕丽华1,张建新1,张春香1
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.山西省生态畜牧产业管理站,山西 太原 030002)
为研究硒源和硒水平对血清和精清抗氧化酶活性的影响,选择年龄、体重相近、健康的黎城大青羊成年种公羊42只,随机分为7组。分别喂以基础日粮、基础日粮+0.5、1.0、2.0 mg·kg-1DM的酵母硒;基础日粮+0.5、1.0、2.0 mg·kg-1DM的亚硒酸钠,饲喂期60 d,试验第60 d采集血液和精液样品,测定其抗氧化能力。结果显示,日粮添加硒极显著提高种公羊血清GPxs活性、血清和精清T-AOC含量,显著提高血清、精清SOD和精清GPxs活性;极显著降低血清、显著降低精清中OH-的含量,改善机体的抗氧化能力。硒水平与血清和精清中GPxs、SOD活性、T-AOC和OH-的含量有剂量——效应关系。与1.0 mg·kg-1组和0.5 mg·kg-1组相比,2.0 mg·kg-1组血清、精清中OH-的含量升高,血清GPxs活性下降,精清SOD活性和T-AOC含量下降;日粮硒浓度相同时,其血清GPxs活性高于精清4~10倍,而精清SOD活性高于血清约20倍。成年种公羊日粮中硒的适宜添加量为0.5~1.0 mg·kg-1酵母硒或0.5 mg·kg-1亚硒酸钠。血清和精清中抗氧化系统存在差异。
硒;血清;精浆;抗氧化酶;种公羊
微量元素硒对雄性动物的生殖机能有重要影响。Smith等[1]报道公牛睾丸、附睾、精囊腺和前列腺中的硒含量仅次于肾脏。缺硒可使雄性动物睾丸发育和精子发生受阻,导致精液品质下降,降低母畜的受胎率[2,3]。当硒摄入不足时,会造成机体抗氧化能力降低,活性自由基产生增加,组织和细胞中过氧化产物积累,导致细胞结构受损、功能下降。机体适宜的硒含量可增强机体抗氧化能力,保持细胞结构的完整性和正常功能。然而关于硒对机体抗氧化能力的研究主要集中在猪、鸡、牛和生长期绵山羊上,关于种用公山羊方面的研究较少。因此,本试验选用42只黎城大青山羊成年种公羊为研究对象,通过在日粮中添加不同水平的亚硒酸钠和酵母硒,研究硒源和硒水平对成年种公羊血液和精清抗氧化物活性的影响及其变化规律,为探讨硒对公山羊生殖机能的作用及其机制提供科学依据。
1 材料与方法
1.1 试验动物与处理、基础日粮与饲养管理
1.1.1 试验地点
试验在山西省长治地区东北部的黎城县大青山羊种羊场进行。该地区属典型的北温带大陆性季风气候,年平均气温10.3℃,降雨量568 mm,无霜期180 d左右,位于东经113°11′~113°35′,北纬36°23′~36°53′之间,是我国典型的缺硒区(0.03~0.06 mg·kg-1)。
1.1.2 试验设计
选择体重相近、体格健壮、性欲旺盛、精液质量正常,年龄3~4岁的黎城大青羊成年种公羊42只。随机分为7组,每组6只。分别饲喂基础日粮组、基础日粮+0.5、1.0和2.0 mg·kg-1(以硒计算)酵母硒,基础日粮+0.5、1.0和2.0 mg·kg-1(以硒计算)亚硒酸钠。试验日粮配制参照NRC(2007)山羊饲养标准,基础日粮组成及营养水平见表1,饲喂全混合日粮。试验期为70 d,其中预试期为10 d,正试期为60 d。
1.1.3 饲养管理
试验种公羊采取全舍饲方式进行饲养,每日每只供给相应试验日粮1.5 kg,分别在早7:00和晚18:00分两次等量饲喂,自由饮水。定期修蹄。每天运动1~2 h。
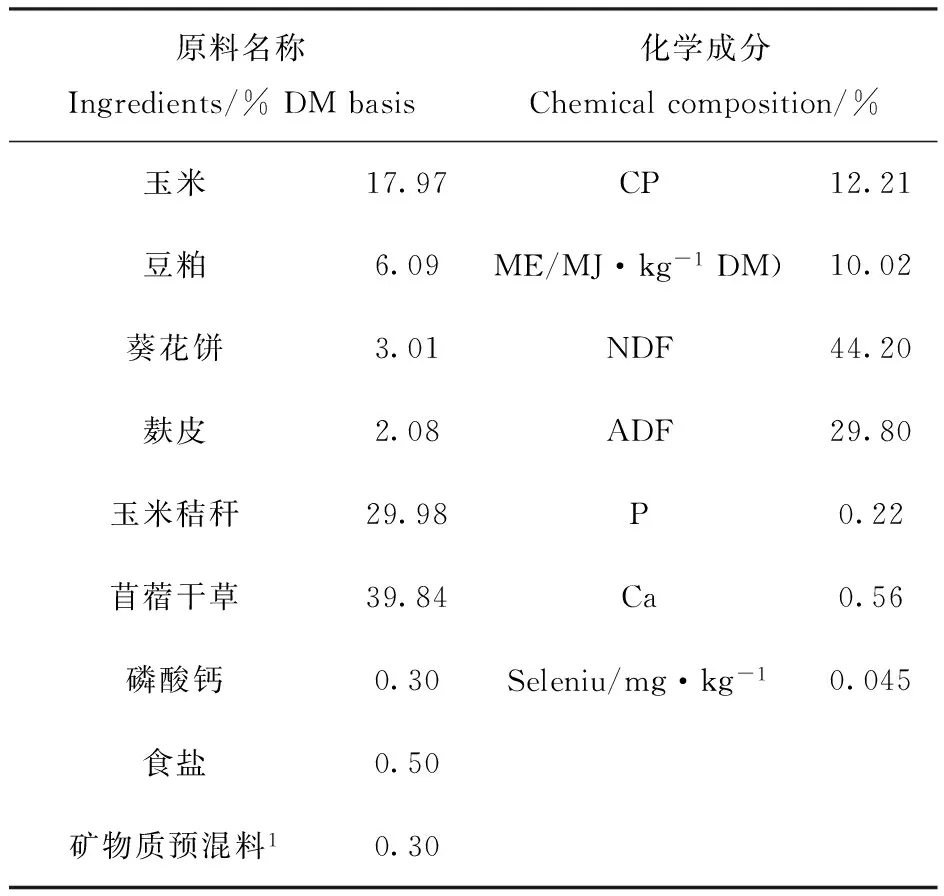
表1 种公羊日粮配方及营养水平
注:1.微量元素预混料(每千克饲料提供):锰30 mg;锌50 mg;钴0.2 mg;碘0.5 mg;铜15 mg;铁50 mg;维生素A2000 IU、维生素E 220 IU和维生素D 500 IU;2.除代谢能外,其他均为实测值。
Note:1.Provided per kilogram of the diet: 30 mg of Mn as MnSO4.H2O; 50 mg of Zn as ZnSO4.7H2O; 0.2 mg of Co as Cocl2. 6H2O;0.5 mg of I as KI; 15 mg of Cu as CuSO4.5H2O; 50 mg of Fe as FeSO4.7H2O; 2000 IU of Vitamin A,220 IU of Vitamin E and 500 IU of Vitamin D. 2.Analyzed values except metabolizable energy.
1.2 样品采集
1.2.1 精液样品采集与制备
试验结束前1周开始采精训练,隔日采精1次。试验结束当天(第60 d)采集种公羊精液,后隔日采精1次,连续采精3次。采精结束后,把种公羊精液离心10 min(2500 r·min-1),然后用移液器量取精清,并分装于1 mL的离心管中,标记封口后置于-20℃冰箱中冷冻,冻后取出放入0 ℃保存箱中,立即运回实验室,置于-70℃冰箱中保存待测。
1.2.2 血样采集与制备
在正试期的第60 d上午采精结束后,颈静脉采血,采集血液10 mL左右,置于37℃恒温水浴中水浴30 min,待析出部分血清后,离心10 min(2500 r·min-1),离心后用移液器量取血清,并分装于1 mL的离心管中,标记封口后置于-20℃冰箱中冷冻,冻后取出放入0 ℃保存箱中,立即运回实验室,置于-70℃冰箱中保存待测。
1.3 测定指标与方法
血液和精清中的GPxs活性、总SOD活性、T-AOC和OH-含量采用试剂盒进行测定。试剂盒由南京建成生物工程研究所提供。测定时,按说明书的操作步骤进行。
1.4 数据统计与分析
利用SAS软件包(The SAS System for Windows V8)中的GLM过程进行方差分析,用Duncan氏法进行多重比较。结果以平均数±标准误表示。
2 结果与分析
2.1 硒源和硒水平对种公羊血清抗氧化能力的影响
从表2可见,日粮添加硒可极显著(Plt;0.01)或显著(Plt;0.05)提高种公羊血清GPxs活性。3个酵母硒组和1.0 mg·kg-1亚硒酸钠组血清GPxs活性均极显著(Plt;0.01)高于对照组,显著(Plt;0.05)高于0.5 mg·kg-1亚硒酸钠组和2.0 mg·kg-1亚硒酸钠组,且以0.5 mg·kg-1酵母硒组血清GPxs的活性为最高,而3个酵母硒组之间、亚硒酸钠组之间血清GPxs活性的差异不显著(Pgt;0.05)。
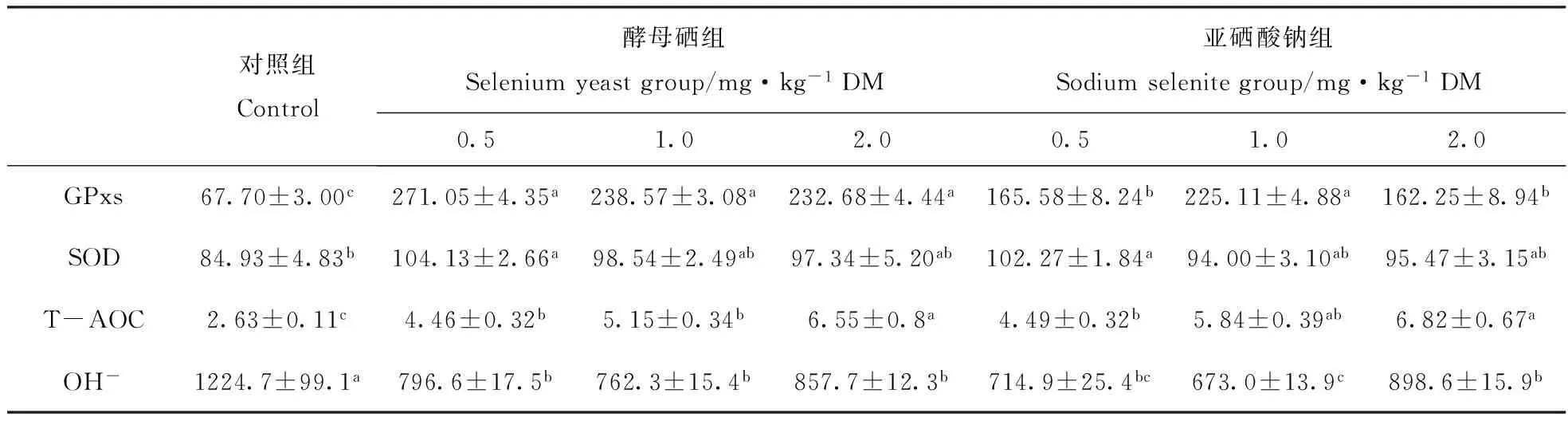
表2 硒源和硒水平对种公羊血清抗氧化能力的影响
注:同行上标字母相同表示差异不显著(Pgt;0.05),相邻字母不同表示差异显著(Plt;0.05),相间字母不同表示差异极显著(Plt;0.01)。表3同。
Note:Same letters stands for no significant (Pgt;0.05), the different between adjacent letters stands for significant (Plt;0.05)and the different between interphase letters stands for very significant (Plt;0.01). Same as Table 3.
日粮添加硒0.5 mg·kg-1硒可显著(Plt;0.05)提高种公羊血清SOD活性。0.5 mg·kg-1酵母硒组和0.5 mg·kg-1亚硒酸钠组间种公羊血清SOD活性均显著(Plt;0.05)高于对照组,而0.5 mg·kg-1酵母硒组和0.5 mg·kg-1亚硒酸钠组间,其他试验组与对照组间血清SOD活性的差异不显著(Pgt;0.05)。
日粮添加硒可极显著(Plt;0.01)或显著(Plt;0.05)提高种公羊血清T-AOC的含量。2.0 mg·kg-1酵母硒组和2.0 mg·kg-1亚硒酸钠组血清T-AOC含量极显著(Plt;0.01)高于对照组,显著(Plt;0.05)高于0.5 mg·kg-1酵母硒组、0.5 mg·kg-1亚硒酸钠组和1.0 mg·kg-1酵母硒组;其余各试验组间血清T-AOC含量的差异不显著(Pgt;0.05)。
日粮添加硒可极显著(Plt;0.01)或显著(Plt;0.05)降低种公羊血清OH-的含量。1.0 mg·kg-1亚硒酸钠组血清OH-含量极显著(Plt;0.01)低于对照组,显著(Plt;0.05)低于3个酵母硒组和2.0 mg·kg-1亚硒酸钠组,其他试验组血清OH-含量均显著(Plt;0.05)低于对照组,但其他试验组间血清OH-含量的差异不显著(Pgt;0.05)。
结果显示,酵母硒提高种公羊血清GPxs活性的效应大于亚硒酸钠,1.0 mg·kg-1的亚硒酸钠降低种公羊血清OH-含量的效应大于1.0 mg·kg-1的酵母硒;酵母硒和亚硒酸钠在提高种公羊血清SOD活性和T-AOC含量的效应方面没有明显差别。
2.2 硒源和硒水平对种公羊精清抗氧化能力的影响
从表3可见,日粮添加硒可提高种公羊精清GPxs活性。0.5 mg·kg-1酵母硒组、1.0 mg·kg-1亚硒酸钠组和2.0 mg·kg-1亚硒酸钠组种公羊精清GPxs活性差异不显著(Pgt;0.05),但均显著(Plt;0.05)高于对照组和0.5 mg·kg-1亚硒酸钠组;1.0 mg·kg-1酵母硒组和2.0 mg·kg-1酵母硒组种公羊精清GPxs活性差异也不显著(Pgt;0.05),但均极显著(Plt;0.01)高于对照组和0.5 mg·kg-1亚硒酸钠组,显著(Plt;0.05)高于0.5 mg·kg-1酵母硒组、1.0 mg·kg-1亚硒酸钠组和2.0 mg·kg-1亚硒酸钠组;0.5 mg·kg-1亚硒酸钠组和对照组间种公羊精清GPxs活性的差异不显著(Pgt;0.05)。结果显示,酵母硒增强种公羊精清GPxs活性的效应大于亚硒酸钠。与表2血清中的GPxs活性相比,精清中GPxs活性明显低于血清。硒对精清中GPxs活性的增强效应小于对血清中GPxs活性的增强效应。
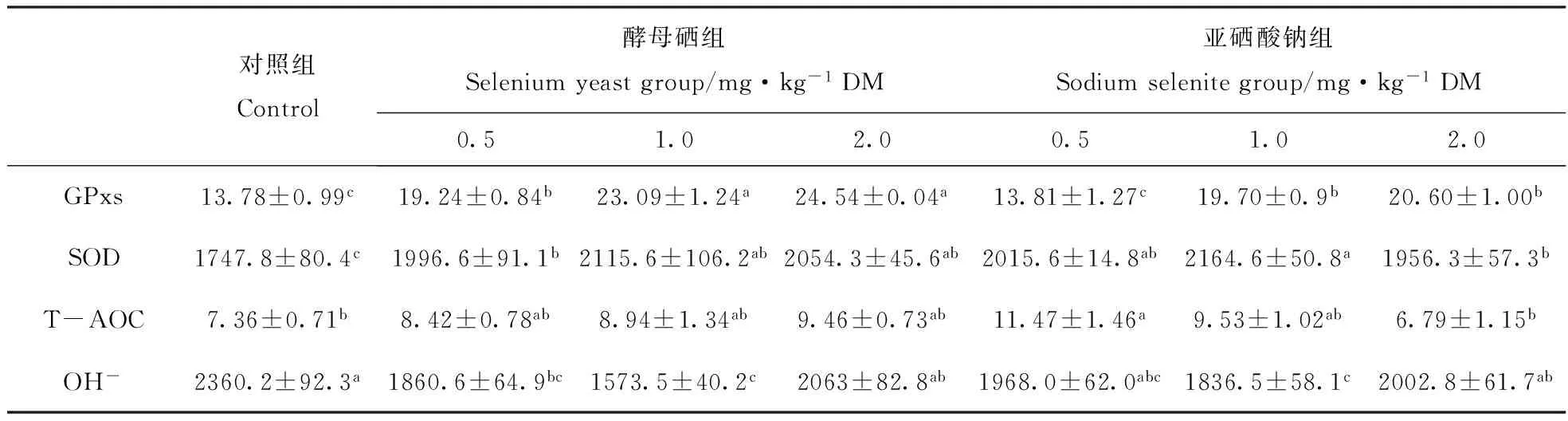
表3 硒源和硒水平对种公羊精清抗氧化能力的影响
日粮添加硒可极显著(Plt;0.01)或显著(Plt;0.05)提高种公羊精清中SOD的活性。1.0 mg·kg-1亚硒酸钠组种公羊精清中SOD的活性极显著(Plt;0.01)高于对照组,显著(Plt;0.05)高于0.5 mg·kg-1酵母硒组和2.0 mg·kg-1亚硒酸钠组,其他试验组之间的差异不显著(Pgt;0.05)。结果显示,添加剂量大于1.0 mg·kg-1以后,增强种公羊精清中SOD活性的效应减弱。酵母硒和亚硒酸钠对增强种公羊精清SOD的活性的效应没有明显差异。与表2血清中的SOD活性相比,精清中SOD活性明显大于血清中SOD的活性。可见,SOD对保护种公羊精子结构免受氧化损伤有重要作用。随日粮硒添加剂量的提高,3个酵母硒组种公羊精清中T-AOC含量逐渐升高,但与对照组相比差异均不显著(Pgt;0.05);亚硒酸钠组种公羊精清中T-AOC含量随硒添加量的增加先升高而后又逐渐降低,其中日粮添加0.5 mg·kg-1亚硒酸钠组种公羊精清中T-AOC含量显著(Plt;0.05)高于对照组,但1.0 mg·kg-1亚硒酸钠组和2.0 mg·kg-1亚硒酸钠组种公羊精清中T-AOC含量与对照组间的差异均不显著(Pgt;0.05)。与表2血清中的T-AOC含量相比,精清中T-AOC含量普遍大于血清,但添加硒对精清T-AOC含量的影响小于对血清T-AOC含量的影响。
日粮添加硒均降低了种公羊精清中OH-的含量。其中,1.0 mg·kg-1酵母硒组和1.0 mg·kg-1亚硒酸钠组种公羊精清中OH-的含量均极显著(Plt;0.01)低于对照组,显著(Plt;0.05)低于2.0 mg·kg-1酵母硒组和2.0 mg·kg-1亚硒酸钠组,而这两组种公羊精清中OH-含量的差异不显著(Pgt;0.05);0.5 mg·kg-1酵母硒组种公羊精清中OH-的含量也显著(Plt;0.05)低于对照组;其他各试验组及对照组间种公羊精清中OH-含量的差异均不显著(Pgt;0.05)。与表2血清中的OH-含量相比,精清中OH-的含量也普遍大于血清。硒的添加对精清OH-含量的影响小于对血清OH-含量的影响。
3 讨论
3.1 硒水平对种公羊机体抗氧化能力的影响
3.1.1 硒水平对血清抗氧化能力的影响
微量元素硒是抗氧化酶GPxs活性中心的组成成分,SOD是生物体自由基清除系统中的另一个重要金属酶。动物体缺硒通常会导致血硒含量下降,血液、肝脏等组织中GPxs、SOD等抗氧化物酶活性的下降,减弱抗氧化系统的防御作用,引起生产性能下降,甚至引发疾病。Osame 等[4]研究表明,缺硒和维生素E可导致羔羊患白肌病,使羔羊血液GPxs活性和血硒浓度显著降低。Zachara 等[5]在配种前给缺硒的母羊注射硒酸钡,发现可使母羊妊娠和泌乳期红细胞数量和血清中GPxs活性极显著提高。Molnár 等[6]研究表明,绵羊日粮补硒能显著提高全血GPxs活性和血清硒浓度。秦顺义等[7]研究发现,日粮添加0.1 mg·kg-1硒能极显著提高羔羊全血GPxs活性及组织硒含量。武晓英等人[8]的研究表明,在基础日粮中添加0.5 mg·kg-1纳米硒可显著增高绒山羊妊娠期血清SOD、GPxs活性以及总抗氧化能力,显著降低MDA含量,增强机体的抗氧化能力。Kumar等[9]研究结果表明,日粮中添加0.15和0.3 mg·kg-1硒可提高羔羊血清硒浓度和红细胞GPxs活性。张捷等[10]报道,妊娠后期给母羊补硒能够显著提高血清CuZn-SOD和T-SOD活性。张春香等[11,12]研究表明,日粮添加0.3 mg·kg-1亚硒酸钠、0.3~1.0 mg·kg-1纳米硒可显著提高山羊公羔血清中SOD和GPxs活性,显著降低MDA含量,增强机体抗氧化功能,促进其生长。施力光等[13]研究发现,日粮添加0.3 mg·kg-1的纳米硒和蛋氨酸硒(以硒计)均能显著提高波尔山羊公羔血清、肝脏、全血中GPxs的活性。Yue等[14]在日粮中添加0.3~0.5 mg·kg-1蛋氨酸硒显著提高了太行青山羊公羔血清GPxs和SOD活性,明显改善羔羊机体的抗氧化功能。本研究结果显示日粮添加硒后种公羊血清GPxs、SOD活性显著提高,这与前人的研究结果一致。
3.1.2 硒水平对睾丸和精清抗氧化能力的影响
精液中抗氧化酶活性对保护精子功能有重要作用。刘超等[15]研究表明,山羊精液中GPxs、SOD的酶活性与精子活率呈极显著正相关,说明精清中GPxs和SOD对保证山羊精液质量有重要的作用。石磊等[16]研究发现,在妊娠期和哺乳期的母羊日粮中添加适量的硒可提高后代公羔睾丸组织的抗氧化能力。杨茹洁等[17]研究发现,在日粮中添加0.3 mg·kg-1的硒(纳米硒)可极显著提高性成熟前雄性波尔山羊睾丸硒沉积和睾丸GPxs活性,促进促进睾丸曲精细管和间质组织及间质细胞发育,维持曲精细管中生殖细胞的发生、分化及分裂,改善其性机能。宋宪勃等[18]报道,日粮添加硒能显著提高公牛精清中GPxs活性。苏惠龙等[19]研究表明,日粮中添加0.3 mg·kg-1的硒(富硒益生菌)可显著提高公猪精液中GPxs活性,改善公猪精液品质。梁明振等[20]研究发现日粮添加0.35 mg·kg-1硒显著提高了公猪精浆GPxs活性和精液品质。本课题组研究结果也显示日粮添加硒显著提高了精液品质,提高了精浆GPxs和SOD活性,改善了精浆的抗氧化能力[21]。
综合血清和精浆的抗氧能力,以0.5 mg·kg-1酵母硒组、1.0 mg·kg-1酵母硒组和0.5 mg·kg-1亚硒酸钠组效果较好。因此,推荐在成年公山羊日粮中酵母硒的适宜添加量为0.5~1.0 mg·kg-1DM,亚硒酸钠的适宜添加量为0.5 mg·kg-1DM。
3.1.3 血清与精清中抗氧化酶活性的比较本研究结果显示,血清与精清中的抗氧化系统存在一定差异。从图1和图2可看出(以酵母硒组为例),血清、精清中GPxs和SOD活性差异较大。对照组血清中GPxs活性是精清中的4.69倍,添加0.5和1.0 mg·kg-1酵母硒组血清中的GPxs活性是精清中10倍多,而在精浆中的SOD活性是血清中的20倍左右。Peeker等[22]研究结果显示人血清中总SOD约26.9 U·mL-1,而精浆中总SOD约780 U·mL-1。这说明血清中是以GPxs为主,而精清中是以SOD为主发挥抗氧化作用的,其调控的机制需进一步研究。
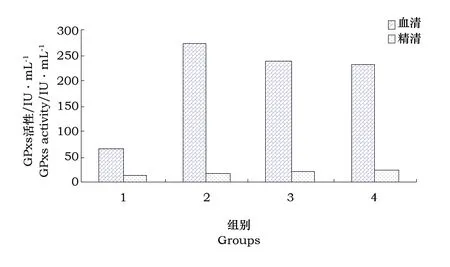
图1 血清与精清中GPxs活性比较
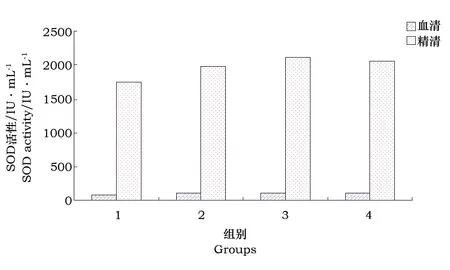
图2 血清与精清中SOD活性比较
3.2 硒源对种公羊机体抗氧化能力的影响
无机硒因为价格便宜成为最常用的硒源,但生物利用率低,硒毒性强,剂量不易控制,也容易对环境造成污染。有机硒生物利用率高,其有毒副作用和对环境污染小的优点。据Henry等[23]报道,硒源在奶牛体内的生物学利用率分别为: 以亚硒酸钠为标准100%,蛋氨酸硒为245%,酵母硒为290%。
硒对动物机体抗氧化能的影响与硒源类型和添加剂量有关。朱晓敏等[24]研究发现,当日粮硒添加水平在0.5 mg·kg-1DM时,蛋氨酸硒组绒山羊血清GPxs活性显著高于亚硒酸钠组。郄彦昭等[25]研究表明,在妊娠后期和泌乳期母猪日粮中添加0.3 mg·kg-1的亚硒酸钠和硒代蛋氨酸的研究发现,硒代蛋氨酸组与亚硒酸钠组相比显著提高了仔猪血清T-AOC水平、GPsx和SOD活性及GSH含量,显著降低了血清MDA含量。秦顺义等[7]研究发现,日粮添加硒(0.1 mg·kg-1)能极显著提高羔羊全血GPxs活性及组织硒含量,且发现有机硒源提高羔羊机体硒状态以及机体抗氧化能力的效果优于无机硒源。黄玉邦等[26]在滩羊羔羊日粮中添加0.1 mg·kg-1亚硒酸钠和富硒酵母(60 d),发现富硒酵母组羔羊血液GPxs和SOD活性显著高于亚硒酸钠组,说明有机硒在改善抗氧化功能方面优于无机硒。Qin等[27]结果显示酵母硒和富硒益生菌组血液硒浓度和GPxs活性显著或极显著高于亚硒酸钠组,有机硒在提高组织和血液硒浓度、血液GSH-Px酶活性比无机硒更有效。本研究也发现,酵母硒提高种公羊血清和精清中GPxs活性、T-AOC含量,降低种公羊血清OH-含量的效应大于亚硒酸钠。
4 结论
日粮添加适宜剂量的硒可极显著(Plt;0.01)提高种公羊血清GPxs活性、血清和精清T-AOC含量,显著(Plt;0.05)提高血清、精清SOD和精清GPxs活性;极显著(Plt;0.01)降低血清、显著降低精清中OH-的含量,改善机体的抗氧化能力。且硒水平与血清、精清中酶活性、T-AOC和OH-的含量有剂量——效应关系。当硒添加量在2.0 mg·kg-1时,与1.0 mg·kg-1和0.5 mg·kg-1相比,血清、精清中OH-的含量升高,血清GPxs活性下降,精清SOD活性和T-AOC含量下降。血清和精清中抗氧化酶系统存在差异。
[1]Smith DG,Senger PL,McCutchan JF,et al.Selenium and glutatione peroxidase distribution in bovine semen and selenium-75 [isotope]retention by the tissues of the reproductive tract in the bull[J].Biology of Reproduction,1979,20(2):377-383.
[2]Liu CH.Preliminary studies on influence of selenium to the developments of fenital organs and spermatogenesis of infancy boars [J].Acta Vet Zootech Sin,1982,13:73-77.
[3]Merin JC.Selenium and fertility in animals and man [J].Acta Vet Scand,1996,37:19-30.
[4]Osame S,Ohtani T,Ichijo S.Studies on serum tocopherol and selenium levels and blood glutathione peroxidase activities in lambs with white muscle disease[J].Nihon Juigaku Zasshi,1990,52(4):705-710.
[5]Zachara BA,Trafikowska U,Kaptur M,et al.The effect of barium selenate injection on selenium concentration and glutathione peroxidase activity in blood of pregnant does fed selenium-deficient diet[J].Biol Trace Elem Res,1992,32:415-419.
[6]Molnár J,MacPherson A,Dixon J.Effect of supplementation with selenium on whole blood glutathione peroxidase activities and on plasma and tissue selenium concentrations in lambs[J].Biol Trace Elem Res,1996,55(3):253-262.
[7]秦顺义,黄克和,高建忠,等.硒源对羔羊抗氧化能力、细胞因子及T3、T4的影响[J].南京农业大学学报,2007,30(2):102-106.
[8]武晓英,曹贵东.纳米硒对岢岚绒山羊妊娠母羊血液生理生化指标的影响[J].现代畜牧兽医,2011(6):42-44.
[9]Kumar N,Garg AK,Mudgal V,et al.Effect of different levels of selenium supplementation on growth rate,nutrient utilization,blood metabolic profile,and immune response in lambs[J].Biol Trace Elem Res,2008(Suppl 1):S44-56.
[10]张捷,吴树清,杜山.外源Se对绵羊孕期体内相关抗氧化酶的影响[J].中国畜牧兽医,2009,36(8):82-84.
[11]张春香,岳文斌,董文甫,等.纳米硒对山羊生长、血清抗氧化酶生长激素和胰岛素的影响[J].激光生物学报,2007,16(5):583-587.
[12]张春香,岳文斌,张晓峰 ,等.不同硒水平对山羊生长性能和血液理化指标的影响[J].中国畜牧杂志,2007,43(9):36-39.
[13]施力光,杨茹洁,岳文斌,等.蛋氨酸硒和纳米硒对波尔山羊种公羔生长及血液、组织硒含量的比较[J].家畜生态学报,2009,30(1):68-72.
[14]Yue W,Zhang C,Shi L,et al.Effect of supplemental selenomethionine on growth performance and serum antioxidant status in taihang black goats[J].Asian-Australian Journal of Animal Sciences,2009,22 (3):365-370.
[15]刘超,任有蛇,张春香,等.山羊精清中抗氧化酶活性与精子活力的相关性分析[J].中国草食动物,2010(3):20-23.
[16]石磊,任有蛇,张春香,等.不同水平母源硒对黎城大青羊后代公羔睾丸组织抗氧化能力的影响[J].饲料工业,2012,3(5):47-50.
[17]杨茹洁,施力光,岳文斌,等.纳米硒对性成熟前雄性波尔山羊生殖机能发育的影响[J].中国农业科学,2009,42(8):2923-2929.
[18]宋宪勃,陆治年,丁晓明,等.日粮补硒对公牛精液品质及某些生化指标的影响[J].南京农业大学学报,1993,16(4):73-78.
[19]苏惠龙,李儒曙,贺湘仁,等.富硒益生菌对种公猪精液品质的影响[J].广东农业科学,2009(7):156-158.
[20]梁明振,卢克焕,黎宗强,等.日粮不同硒水平对公猪繁殖及精浆营养生化参数的影响[J].广西农业生物科学,2003,22(3):165-170.
[21]任有蛇.硒源和硒水平对山羊繁殖性能和GPxs基因在睾丸中表达的影响[D].山西农业大学博士学位论文,2013:46-55.
[22]Peeker R,Abramsson L.and Marklund S.L.Superoxide dismutase isoenzymes in human seminal plasma and spermatozoa[J].Molecular Human Reproduction,1997,3 (12):1061-1066.
[23]Henry PR,Ammerman CB.Selenium bioavailability of nutrients for animaIs,Amino Acids,Minerals and Vitamins C[M].New York:American Acidemin Press,1995:184-216.
[24]朱晓敏,张春香,任有蛇,等.硒源和硒水平对妊娠前期绒山羊血清酶指标的影响[J].农业技术与装备,2010(2):58-60.
[25]郄彦昭,占秀安,李星,等. 母猪日粮添加硒代蛋氨酸对后代乳猪生长的影响[J].中国粮油学报,2010,25(10):78-81,103.
[26]黄玉邦,孙永武,周进勤,等.有机硒对羔羊生长性能及抗氧化能力的影响[J].畜牧与饲料科学,2009,30(9):22-24.
[27]Qin S,Gao J,Huang K.Effects of different selenium sources on tissue selenium concentrations,blood GSH-Px activities and plasma interleukin levels in finishing lambs[J].Biol Trace Elem Res,2007,116(1):91-102.
EffectofDifferentSourcesandLevelsofSeleniumonAntioxidantAbilityinSerumandSeminalPlasmaofBucks
Ren Youshe1, Bai Yuansheng2, Liu Xiaoni2, Jiao Guangyue2, Liu Wenzhong1, Shi Lei1, Zhao Junxing1, Lv Lihua1, Zhang Jianxin1, Zhang Chunxiang1
(1.CollegeofAnimalScienceandVeterinaryMedicines,ShanxiAgriculturalUniversity,TaiguShanxi030801,China; 2.ManagementStationofShanxiEcologyandAnimalHusbandryIndustry,TaiyuanShanxi030002,China)
The aim of this study was to investigate the effect of different sources and levels of selenium on antioxidase activities in serum and seminal plasma of bucks. A total of 42 healthy Licheng Black bucks with similar body eight (45±2.3 kg) were randomly selected and divided into 7 groups by completely randomized design. Bucks were fed with a basal diet or basal diet supplemented with 0.5, 1.0, 2.0 mg·kg-1DM yeast selenium or basal diet supplied with 0.5, 1.0, 2.0 mg·kg-1DM selenite sodium, respectively, for 60 days. Then blood and semen were sampled and their antioxidant abilities were measured. The results showed that, serum GPxs activity (Plt;0.01), serum and seminal T-AOC contents (Plt;0.01), serum and seminal SOD contents (Plt;0.05) and seminal GPxs (Plt;0.05) were significantly increased by supplementing Se in diet, whereas serum OH-(Plt;0.01) content and seminal OH-(Plt;0.05) content was decreased significantly. Selenium levels and serum/seminal enzymatic activities (SOD and GPxs) showed a dose-dependent manner, the same relationship as that between selenium levels and T-AOC and OH-contents. The content of OH-in serum and seminal plasma in group 2.0 mg·kg-1selenium (selenium yeast or sodium selenite) was higher than the groups of 1.0 mg·kg-1and 0.5 mg·kg-1selenium (selenium yeast or sodium selenite), but GPxs activity in serum, and SOD activity and T-AOC contents in seminal plasma were all decreased. When the animals
equal selenium concentration, GPxs activity in serum was 4~10 times higher than that in seminal plasma, and SOD activity in seminal plasma was 20 times higher than that in serum. The results indicated the appropriate additive amount of selenium yeast was 0.5~1.0 mg·kg-1, and optimal additive amount was 0.5 mg·kg-1. There were significant differences in antioxidant system between serum and seminal plasma.
Selenium; Serum; Seminal plasma; Antioxidases; Bucks
2014-04-29
2014-05-27
任有蛇(1970-),男(汉),山西岢岚人,副教授,博士,研究方向:动物繁殖调控。
张春香,副教授,硕士生导师。Tel:0354-6289216;E-mail:zhchx66@126.com
国家现代农业产业技术体系建设专项资金(CARS-39);山西省肉羊联合育种科技合作项目(SXLHYZ201309)
S827
A
1671-8151(2014)05-0411-07
(编辑:马荣博)

