如皋黄鸡42日龄体重母体遗传效应评估
窦套存,王克华,曲亮,沈曼曼,胡玉萍, 郭军
(江苏省家禽科学研究所,江苏 扬州 225125)
如皋黄鸡42日龄体重母体遗传效应评估
窦套存,王克华,曲亮,沈曼曼,胡玉萍, 郭军
(江苏省家禽科学研究所,江苏 扬州 225125)
随着遗传模型和计算方法的发展,动物遗传育种研究中可以应用复杂模型分析大数据集,文章应用6种模型分析如皋黄鸡42日龄体重方差组分和遗传力。收集2010-2013年如皋黄鸡生产记录,包括8575只鸡的22 935条体重记录,利用WOMBAT软件以平均信息约束最大似然法(AIREML)分析表型方差组分。应用动物模型时考虑了加性效应、母体遗传效应和环境效应,对不同日龄体重进行了标准化。以AIC值、BIC值以及似然比值选择最优模型。结果表明:如皋黄鸡42日龄体重性状遗传模型应考虑加性遗传效应、母体遗传效应和母体环境效应;如皋黄鸡42日龄遗传力为0.33±0.02,母体遗传效应可以解释8%表型方差,加性遗传与母体遗传呈现负相关。遗传分析结果显示42日龄体重属于中低遗传力性状,因此应用动物模型-BLUP方法估计育种值更有效。
如皋黄鸡;遗传力;母体效应;动物模型;体重
如皋黄鸡,原产于长江中下游地区,主要用于生产草鸡蛋和优质鸡,属于兼用型品种。研究如皋黄鸡42日龄体重遗传参数的意义,可以促进如皋黄鸡选育与利用,为其他国内地方鸡种选育提供参考。鸡早期体重是评价其肉用性能的重要指标,尽管多篇文献报道了鸡早期生长性能遗传参数,但很少有研究以中国地方鸡种为试验素材。Danbro等研究结果表明白羽肉鸡早期体重性状属于中等遗传力[1]。Koerhuis等报导一种肉用型鸡母系6周龄体重遗传力在0.28左右[2]。Maniatis等分析了安伟捷公司的一个肉鸡品系体重遗传参数,7周龄体重遗传力为0.17~0.25,母体遗传力为0.1~0.15,加性遗传与母体遗传呈负遗传相关[3]。近年来,国内外对地方鸡种资源保护与利用工作越发重视,地方鸡种遗传参数研究成为研究热点。Kamali等以DF-REML软件应用多元方差分析方法计算了伊朗法尔斯省地方鸡种12周龄体重遗传力[4]。随后,Ghorbani等利用WOMBAT软件估计了法尔斯鸡经济性状遗传力,该鸡8周龄体重遗传力为0.32±0.02[5]。Niknafs以及Ghorbani等分别用 DF-REML、WOMBAT软件估计了伊朗北部马曾德兰地方鸡种8周龄以及12周龄体重遗传力[6,7]。Salehinasab等以单性状方差分析计算了伊朗伊斯法罕省兼用型地方鸡种8周龄体重遗传力[8]。综上所述,雏鸡体重遗传参数受遗传背景影响很大,中国地方鸡种遗传选育工作不适宜借鉴国外鸡种体重遗传参数。本试验以如皋黄鸡为素材,分别采用6种统计模型计算体重遗传参数。通过对如皋黄鸡42日龄体重遗传力的解析,有助于其个体育种值估计及选择方案制定。
1 材料和方法
1.1 试验动物
如皋黄鸡个体记录来自扬州翔龙禽业有限公司,选取2010-2013年连续四代雏鸡体重数据进行整理、分析。试验鸡个体单独戴翅号, 0~7周为育雏阶段,笼养,笼具为四层重叠式,人工清粪。饲喂嘉吉公司雏鸡饲料。育成期人工补光,煤炉加热。每代由40~60个家系组成。
1.2 数据处理
依据出雏表整理系谱信息,以个体翅号、父亲翅号、母亲翅号依次排列,缺失翅号信息记为0。体重数据经初步筛选,去除明显错误、重复数据,保存成excel格式。
体重数据标准化:如图1所示,大部分个体42日龄测量体重,少数个体体重测量日在42日龄附近,因此需要将非42日龄体重数据标准化。据Huisman等研究,体重方差随日龄增加而增加[9]。目前,有多种处理这种异质化方差的方法,比如随机回归分析、依赖标准差调整表型值[10],本研究采用不同日龄体重标准差比值和均值校正非42日龄数据。具体公式为:
其中,yij是j个体在i日龄体重,mi是i日龄体重平均值,Si是i日龄标准差,m42、S42分别是42日龄平均值、标准差。以SAS 软件包计算临时群体体重数据均值和标准差,标准化之后除去3倍标准差之外数值。
系谱信息加入各代配种公鸡以及2009年如皋黄鸡系谱信息,然后去掉重复信息。由wombat总结汇总系谱信息,详见表1;各日龄体重平均值及标准差由SAS 8.0获得,详见图1。应用SAS GLM分析各临时群体体重差异,以生产记录包含的年代、批次、性别及出雏日期对表型值进行方差分析,确定进入固定效应的因素。所用动物模型矩阵表达式有:

表1 如皋黄鸡系谱、数据描述
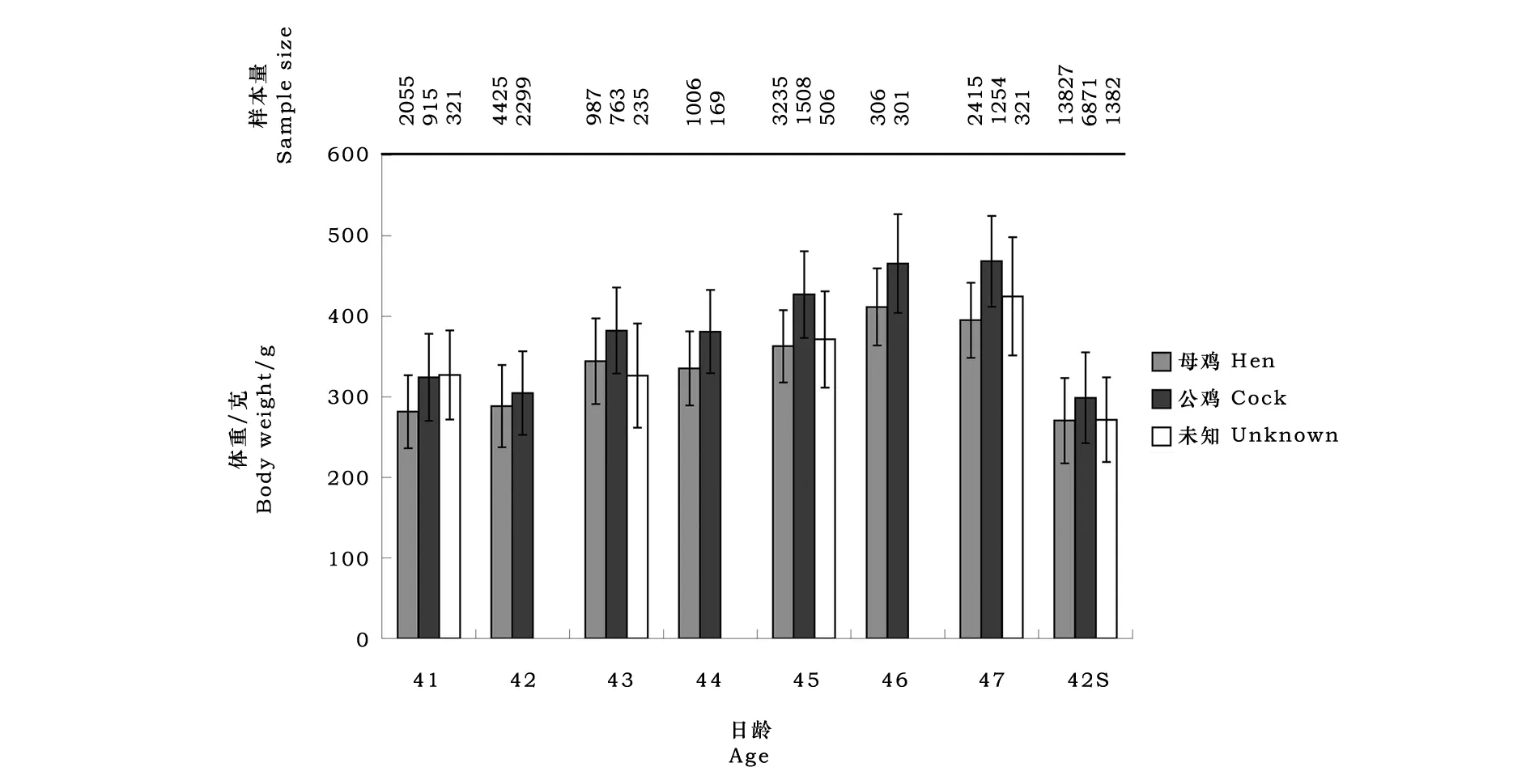
图1 如皋黄鸡各日龄雏鸡体重及标准差
模型I:
y=Xb+Zaa+e
模型II:
y=Xb+Zaa+Zcc+e
模型III:
y=Xb+Zaa+Zmm+e,covam=0
模型IV:
y=Xb+Zaa+zmm+e,covam≠0
模型V:
y=Xb+Zaa+Zcc+Zmm+e,covam=0
模型VI:
y=Xb+Zaa+Zcc+Zmm+e,covam≠0
y是所有个体性状表型值向量;a,b,c,m,e分别是加性遗传效应、固定效应、母体环境效应、母体遗传效应以及残差效应的向量。X,Za,Zm,Zc分别是固定效应、加性遗传效应、母体遗传效应以及母体环境效应的指定矩阵。
应用WOMBAT软件分析各性状(协)方差组分以及遗传力[11]。加性遗传与母体遗传之间的相关以下面的公式求得:

计算遗传力参照Willham给出的公式[12]:
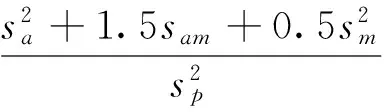
1.3 模型评估标准
选择最佳模型是获得可靠结论的基础。本文采用AIC准则、BIC准则以及似然比值选择最适合描述如皋黄鸡42日龄体重的统计模型,并进行比较,以期提高数据分析的准确度。AIC准则由日本学者赤池弘次(Akaike)首次提出,该准则针对当前模型与真模型之间存在的K-L距离给出无偏估计量,其公式为[13,14]:
AIC=-2logL+2p
BIC准则,即贝叶斯信息准则,是统计模型选择中广泛采用的标准。如果真模型存在于分析模型之列,BIC值最小的即为真模型。计算BIC值公式为:
BIC=-2logL+plogn
其中,L是模型的极大似然函数,p为模型的独立参数总数,n为观察值总数。
最后,以似然比比较各性状适用模型。似然比检验统计量为:
其中LR为似然比值,服从卡方检验。如果检验结果差异不显著,则接受原假设,适用模型为model1。
2 结果
2.1 数据描述
从2010-2013年,以42日龄为测定日统计如皋黄鸡生长早期体重数据,连续统计4个世代。如皋黄鸡各批次体重数据见表2,经非配对t检验分析,公鸡体重显著高于同期母鸡体重,因为公鸡雄激素水平高,雄激素可以促进骨骼、肌肉生长分化。将数据集依据性别分成两组,分别计算遗传参数,显示新分两组之间差异不显著,表明42日龄体重并非性连锁基因控制。鉴于此,将性别列入固定效应。雏鸡体重按出雏批次分组后平均值存在显著差异,因此批次差异应列入固定效应。批次之间,饲养管理、气温、湿度条件存在差异,各批体重数据平均值表现显著差异。

表2 如皋黄鸡各批次体重测量信息
2.2 方差组分及遗传力
应用单性状方差分析计算的如皋黄鸡42日龄体重方差组分及遗传力见表3。各个模型计算的表型方差相差不大,介于2266~2435之间。残差所解释的表型方差存在差异,模型IV和模型VI残差效应较少,约占表型方差的43%,其余模型的残差效应在58%~65%之间。残差效应越少,模型适用性越好。残差效应较高,表明42日龄体重受环境因素影响较大。在不考虑母体效应情形下,模型I的遗传力估值最大,约为0.41±0.02。考虑母体遗传和母体环境效应之后,加性遗传力相应减少。但是由于选择准确性提高,遗传进展未必随遗传力估值减少而减少。如皋黄鸡开产日龄加性遗传效应与母体遗传效应之间存在负相关(ram,-0.60及-0.45),表明提高42日龄体重加性遗传效应不利于母体遗传效应选育。

表3 如皋黄鸡42日龄体重性状方差组分
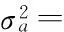

6种统计模型之中,模型IV的最大似然函数对数值略大于模型VI的,但小于其它模型对应到最大似然函数对数值,模型IV与模型VI的似然比值为72.44,两模型独立参数之差为1,以参数差作为自由度查阅卡方检验表,α=0.01对应临界值为6.635,因此接受模型VI为适用模型。模型VI对应的AIC值最小,表明模型Ⅵ距离真模最近。表3显示,模型Ⅵ对应的BIC值最小。因此,若真模存在于分析模型之列的话,模型Ⅵ即为真模。三者综合,可选择模型VI为42日龄体重适用模型。使用最适模型估计的如皋黄鸡42日龄体重遗传力为0.33±0.02,母体遗传力为0.08±0.01,加性遗传与母体遗传之间到遗传相关系数为0.85,母体环境效应可以解释5%表型方差。
3 讨论
3.1 体重遗传力
生长性状表型值存在较大变异,剖分42日龄体重表型方差并计算遗传力及遗传相关,对如皋黄鸡肉用性能选育提高至关重要。本研究仅选取如皋黄鸡连续四代选育记录,虽然时间跨度不长,但每代选择相同季节繁育,有助于消除环境对表型值的影响。从表3可知,如皋黄鸡42日龄体重遗传力在0.33左右,与同类研究结果相近。体重属于中等遗传力性状,Danbro等分析了白羽肉鸡连续7代早期生长性状遗传力,研究结果表明白考尼什鸡7周龄体重遗传力在0.10至0.27之间,白洛克鸡的遗传力在0.19至0.33之间[1]。Koerhuis等以REML方法分析了两个肉鸡群体(分别是3代和6代)生长性状遗传参数,早期体重遗传力分别为0.32和0.27,早期体重受母体遗传作用[15]。Maniatis等分析了安伟捷公司一个肉鸡品系(连续6代)体重遗传参数,7周龄体重遗传力在0.17~0.25之间。如皋黄鸡42日龄体重遗传力略高于肉鸡的,其原因在于肉鸡经过长期高强度选育后遗传力减少。随着选育不断推进,生长性能较差个体被淘汰,体重遗传方差呈减少趋势。如皋黄鸡源自地方鸡种,遗传多样性相对较高,虽然经过短期选育,但42日龄体重变异系数接近20%(表1),表明选育潜能较大。如皋黄鸡42日龄体重遗传力低于伊朗地方鸡种法尔斯鸡(0.68[4]和0.41[5]),高于伊朗地方鸡种马曾德兰鸡(0.24[6]和0.19[7])和伊斯法罕鸡(0.24[8])。其中,法尔斯鸡仅经过10年选育,马曾德兰鸡和伊斯法罕鸡经过30年选育。
3.2 母体效应
多个研究团队报导母体效应对鸡早期生长性状有着重要影响,本研究结果表明如皋黄鸡42日龄体重母体遗传力和母体环境效应不可忽略。母体效应分为母体遗传效应和母体环境效应。雌鸟自身可以调控禽蛋中非DNA物质含量,从而影响后代的生长发育。例如,蛋黄中生殖激素、类胡萝卜素以及维生素影响后代生长发育,母禽依据环境条件调节这些物质在禽蛋中的含量,改变后代生长发育轨迹[16~18]。据Tuiskula-Haavisto等研究鸡基因组存在母本遗传现象,鸡3号染色体存在屠体性状母体印记座位[19]。一些研究认为家禽体重遗传模型应该包括母体遗传效应和母体环境效应[5,20],但也有研究人员认为只包含母体遗传[21],或母体环境效应即可[22]。如表2所示,加入母体效应后,模型对应AIC值及BIC值显著减小。去除母体效应,如模型I所示,加性遗传方差增加,加性遗传力也相应增加,但导致选育准确率降低。加性遗传与母体遗传存在负相关,Hartmann等在来航鸡上以及Ghorbani在法尔斯鸡上也发现类似结果[5,21]。
4 结论
对肉蛋兼用型品种如皋黄鸡来说,早期生长性状选育具有重要经济意义。本研究将不同日龄如皋黄鸡体重数据标准化至42日龄体重,然后构建6种统计模型,利用类似BLUP原理分析如皋黄鸡生长性状遗传力和遗传相关系数,结果表明:1)如皋黄鸡42日龄体重性状遗传模型应考虑加性遗传效应、母体遗传效应和母体环境效应。如果将母体效应从遗传模型中去除,将导致42日龄体重遗传力估值过高,影响后续个体育种值及群体选择反应计算。2)如皋黄鸡42日龄遗传力为0.33±0.02,母体遗传效应可以解释8%表型方差,加性遗传与母体遗传呈现负相关。与经过长期选择的肉鸡和兼用型鸡种相比,如皋黄鸡早期体重遗传力相对较高,有利于进一步选择。但母体遗传与加性遗传存在较强负相关,如果如皋黄鸡选育程序忽略母体遗传效应,母体遗传优势将随着选育推进逐渐消失。遗传分析结果显示42日龄体重属于中低遗传力性状,因此应用动物模型-BLUP方法估计育种值更有效,获取遗传进展更快捷。
[1]Danbaro G,Oyama K,Mukai F,et al.Heritabilities and genetic correlations from a selection experiment in broiler breeders using restricted maximum likelihood[J].Japanese poultry science,1995,32(4):257-266.
[2]Koerhuis A N M,Mckay J C.Restricted maximum likelihood estimation of genetic parameters for egg production traits in relation to juvenile body weight in broiler chickens[J].Livestock production science,1996,46(2):117-127.
[3]Maniatis G,Demiris N,Kranis A,et al.Model comparison and estimation of genetic parameters for body weight in commercial broilers[J].Canadian journal of animal science,2013,93(1):67-77.
[4]Kamali M A,Ghorbani S H,Sharbabak M M,et al.Heritabilities and genetic correlations of economic traits in Iranian native fowl and estimated genetic trend and inbreeding coefficients[J].British poultry science,2007,48(4):443-448.
[5]Ghorbani S,Tahmoorespur M,Maghsoudi A,et al.Estimates of (co)variance components for production and reproduction traits with different models in Fars native fowls[J].Livestock Science,2013,151(2):115-123.
[6]Niknafs S,Nejati-javaremI A,Mehrabani-yeganeh H,et al.Estimation of genetic parameters for body weight and egg production traits in Mazandaran native chicken[J].Tropical animal health and production,2012,44(7):1437-1443.
[7]Ghorbani S,Kamali M A,Abbasi M A,et al.Estimation of maternal effects on some economic traits of North Iranian native fowls using different models.[J].Journal of agricultural science and technology,2012,14(1):95-101.
[8]Salehinasab M,Zerehdaran S,Abbasi M A,et al.Determination of the best model for estimating heritability of economic traits and their genetic and phenotypic trends in Iranian native fowl[J].Archiv fur tierzucht-archives of animal breeding,2013,56:237-245.
[9]Huisman A E,Veerkamp R F,Van Arendonk J A M.Genetic parameters for various random regression models to describe the weight data of pigs.[J].Journal of animal science,2002,80(3):575-582.
[10]Wiggans G R,Vanraden P M.Method and effect of adjustment for heterogeneous variance[J].Journal of dairy science,1991,74(12):4350-4357.
[11]Meyer K.WOMBAT-A tool for mixed model analyses in quantitative genetics by restricted maximum likelihood (REML)[J].Journal of zhejiang university science b,2007,8(11):815-821.
[12]Willham R L.The role of maternal effects in animal breeding:III.Biometrical aspects of maternal effects in animals[J].Journal of animal science,1972,35(6):1288-1293.
[13]Akaike H.A new look at the statistical model identification[J].Automatic control,IEEE Transactions,1974,19(6):716-723.
[14]刘璋温.赤池信息量准则 AIC 及其意义[J].数学的实践与认识,1980(3):64-72.
[15]Koerhuis A N M,Thompson R.Models to estimate maternal effects for juvenile body weight in broiler chickens[J].Genetics selection evolution,1997,29(2):225-249.
[16]Newbrey J L,Reed W L.Growth of yellow-headed blackbird Xanthocephalus xanthocephalus nestlings in relation to maternal body condition,egg mass,and yolk carotenoids concentrations[J].Journal of avian biology,2009,40(4):419-429.
[17]Groothuis T G,Müller W,Von Engelhardt N,et al.Maternal hormones as a tool to adjust offspring phenotype in avian species[J].Neuroscience amp; biobehavioral reviews,2005,29(2):329-352.
[18]Biard C,Gil D,Karadas F,et al.Maternal effects mediated by antioxidants and the evolution of carotenoid-based signals in birds[J].The American Naturalist,2009,174(5):696-708.
[19]Tuiskula-haavisto M,Vilkki J.Parent-of-origin specific QTL-a possibility towards understanding reciprocal effects in chicken and the origin of imprinting[J].Cytogenetic and genome research,2007,117(1-4):305-312.
[20]Saatci M,Omed H,Ap Dewi I.Genetic parameters from univariate and bivariate analyses of egg and weight traits in Japanese quail[J].Poultry science,2006,85(2):185-190.
[21]Hartmann C,Johansson K,Strandberg E,et al.Genetic correlations between the maternal genetic effect on chick weight and the direct genetic effects on egg composition traits in a White Leghorn line[J].Poultry science,2003,82(1):1.
[22]Aslam M L,BastiaanseN J W,Crooijmans R P,et al.Genetic variances,heritabilities and maternal effects on body weight,breast meat yield,meat quality traits and the shape of the growth curve in turkey birds[J].BMC genetics,2011,12(1):14.
MaternalgeneticeffectsofBodyWeightinRugaoYellowChicken
Dou Taocun,Wang Kehua, Qu Liang, Shen Manman, Hu Yuping, Guo Jun
(JiangsuInstituteofPoultryScience,YangzhouJiangsu225125,China)
With the advances in genetic models and algorithmic efficiency, studis on animal science could apply more complex models to analyze large dataset. In this paper, six models were used to estimate variance components and heritability for body weight in Rugao Yellow chicken. The data were collected from four generations of Rugao Yellow chicken from 2010 to 2013. A total of 22 935 recorders corresponding to 8575 hen were evaluated. Direct genetic and maternal effects were embedded to the mixed models. The recorders at different day-olds were standardized to 42 day-old body weights. Models were compared using AIC, BIC and LR values. Variance components were estimated using AIREML method with WOMBAT software. The results suggested: i) genetic model of 42 day-old body weight should include direct genetic, maternal genetic and environment effects; ii) the heritability of 42 day-old body weight was 0.33±0.02, maternal genetic effect counted for 8 percent of phenotypic variances, and genetic correlation between direct and maternal genetic effects was negative in the study. Since heritability for the weight traits were moderate, selection based on predicted breeding values using animal model-BLUP would become an effective method for genetic improvement on Rugao Yellow chicken.
Rugao Yellow Chicken; Heritability; Maternal effect; Animal model; Body weight
2014-05-27
2014-09-25
窦套存(1975-),女(汉),江苏兴化人,副研究员,硕士,研究方向:家禽育种研究。
王克华,研究员,博士,硕士生导师。Tel:13805276606;E-mail:sqbreeding@126.com
现代农业产业技术体系建设专项资金(CARS-41-K02);江苏省科技成果转化专项资金(BA2014132);江苏省三新工程(SXGC[2014]290);江苏省自然科学基金(BK20131237)
S831.2
A
1671-8151(2014)06-0511-07
(编辑:马荣博)

