洱海沉积物中反硝化细菌的分离与反硝化作用研究
奎一平, 张 文, 林丽佳, 倪兆林, 申元英*
1.大理市环境保护局, 云南 大理 671000;
2.大理学院公共卫生学院, 云南 大理 671000
硝化和反硝化过程是无机氮生物化学循环中的重要环节,它们通过微生物的生化过程将铵盐转化为可溶性的硝酸盐、亚硝酸盐,进而转化为气态的氮气和氧化亚氮[1],其反应物铵盐、硝酸盐和亚硝酸盐是引起海水富营养化的主要化学物质。近年来,国内外很多研究已经证明,细菌的反硝化作用不仅可在厌氧条件下进行,同时也可在好氧条件下进行[2,3]。
洱海位于云贵高原,大理白族自治州境内,为云南省第二大淡水湖泊,洱海全湖面积256 km2,平均水深10.5 m,容积27.7亿m3,是大理州生态、经济及社会发展的基础条件。近年来随着社会经济的发展,对洱海开发活动的不断加剧,洱海现正处于中营养水平向富营养湖泊的过渡阶段[4],洱海沉积物中氮磷含量较高而且蓝藻水华每年夏秋季都会频繁地在大部分湖湾发生,为应对环境问题,针对洱海水质、水生动植物及沉积物等都进行了广泛的研究[5~8]。尽管近年来加大了对洱海的治理,但湖泊富营养化的进程依然是困扰洱海可持续发展的重要问题。因此,本文拟从洱海沉积物中分离筛选出具有较强反硝化能力的细菌,并进行反硝化作用分析,以为后续反硝化细菌的开发应用提供理论基础。
1 材料与方法
1.1样品来源
根据2009年对洱海水质和沉积物各指标检测数据,从洱海18个常规采样点中设10个点位(21#、68#、73#、100#、105#、121#、132#、142#、177#和209#),湖泊采样时采用GPS定位技术准确定位,确定采样点。用GPS仪记录下位点经纬度坐标,使用Google earth软件做出采样位点实际分布图,再根据实际分布图使用Photoshop CS2软件做出采样位点示意图(见图1)。采样船只为中国环境科学研究院洱海基地调查船,用自制表层采样器采集表层沉积物,装入无菌离心管中,放入冰盒中带回实验室。
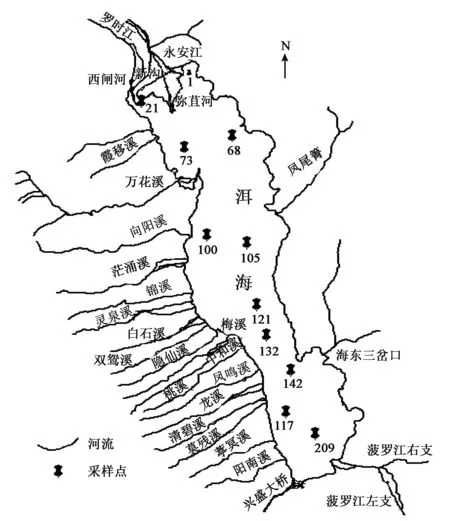
图1 洱海采样点位分布图
1.2主要实验仪器及试剂
SW-CJ-2FD洁净工作台(苏州安泰空气技术有限公司);JA1203N电子天平(上海精密科学仪器有限公司);YXQ-LS-50S11立式压力蒸气灭菌器(上海博讯实业有限公司医疗设备厂)。
1.3主要培养基
反硝化液体培养基:KNO32 g/L、MgSO40.2 g/L、KH2PO40.5 g/L、酒石酸钾钠20 g/L,pH 7.2。
柠檬酸盐培养基:柠檬酸钠2 g/L、K2HPO41 g/L、NH4H2PO41 g/L、NaCl 5 g/L、MgSO40.2 g/L、1%(V/V)溴麝香草酚蓝(酒精溶液);pH 6.8。
LB培养基:胰蛋白胨10 g/L、酵母抽提物5 g/L、NaCl 10 g/L,pH 7.2。
1.4反硝化细菌的分离纯化
将采集的沉积物样品称取1g加入到装有100 mL反硝化液体培养基的250 mL锥形瓶中,混匀后,加棉塞塞口,30℃恒温静置培养3~4 d,至培养液变浑浊。取5 mL菌液接入装有100 mL新鲜反硝化液体培养基的250 mL锥形瓶中培养,重复此操作2~3次;将富集培养后的菌液反复划线培养直至出现单个菌落,即得到纯化后的菌株。将纯培养平板置于4℃冰箱备用。培养过程中用磺基苯磺酸和a-萘胺的混合溶液定性检测菌株的反硝化能力,筛选出反硝化能力最强的菌株。
1.5反硝化细菌的形态学及生理生化鉴定
分别挑起单个菌落进行涂片、干燥、革兰氏染色和显微镜下观察,并参考《伯杰细菌鉴定手册》[9,10]、《环境微生物学实验方法与技术》[11]进行接触酶(过氧化氢酶)试验、产硫化氢试验、葡萄糖氧化发酵试验、淀粉水解试验和产脂酶(Tween 80)试验等生理生化实验。
1.6菌株对硝酸盐降解能力测定
2 结果与分析
2.1细菌筛选结果
通过对洱海沉积物细菌培养纯化,分离得到101株反硝化细菌。这些细菌均可在以硝酸盐为唯一氮源的条件下生长,为以后氮测试试验排除干扰。
2.2反硝化能力测定
将101株细菌分别接种于反硝化液体培养基中,37℃恒温培养24 h后向培养液中滴入1滴对磺基苯磺酸和a-萘胺的混合溶液。101株细菌的培养基颜色均变红,证明有亚硝酸盐产生。该101株细菌在液体培养过程中将硝酸盐氮转变成亚硝酸盐氮,实现了反硝化过程的第一步,具有反硝化能力。其中编号为EH314的菌株培养液颜色最深,说明其反硝化能力最强,将该细菌作为研究对象。
2.3细菌形态学鉴定
分离纯化的细菌经革兰氏染色,显微镜镜检后得到EH314为G-杆菌,排列不规则。
2.4生理生化特性
对EH314菌株生理生化特性进行测定,结果表明,该菌株能在30℃恒温生长,在有氧条件下能以硝酸盐为唯一氮源的培养基中接触酶(过氧化氢酶)产气,能水解淀粉,硫化氢试验阳性,葡萄糖氧化发酵试验结果为氧化菌,产脂酶(Tween 80)试验结果为阴性,见表1。

表1 EH314菌株生化反应结果
2.5菌株EH314对硝酸盐降解能力测定
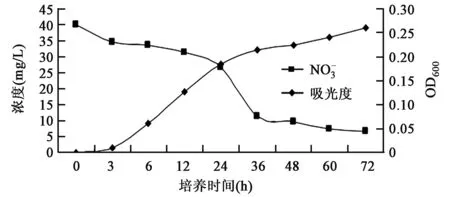
图2 菌株EH314对硝酸盐的降解
3 讨论
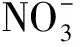
洱海沉积物氮磷含量高于长江中下游湖泊,文献表明:洱海沉积物总氮平均为2 204.54 mg/kg[16],总磷含量为307.43~1 454.39 mg/kg[17],但低于处于劣Ⅴ类的滇池,总氮为8 670 mg/kg,总磷为3 460 mg/kg[18]。较高的氮磷含量,使洱海沉积物具有较大的释放风险,而洱海水体却保持较好。由于沉积物中存在大量反硝化细菌,并且这些细菌具有较强的反硝化能力。细菌通过反硝化作用,将沉积物中大量氮元素转化为气体(N2、N2O)逸散出水体,降低了沉积物对洱海上覆水中氮含量的贡献,从而使洱海上覆水保持较好。作为反硝化作用的主体,研究洱海沉积物中反硝化细菌能够为今后治理洱海及预测洱海水体变化提供重要信息。
[1]沈国英, 施并章. 海洋生态学[M].北京:科学出版社, 2003, 292-295.
[2]杨新萍,钟 磊,周立祥.有机碳源及DO对好氧反硝化细菌AD6脱氮性能的影响[J]. 环境科学,2012,31(6):1633-1638.
[3]Robertson L A, van Niel E W, Torremans R A. Simultaneous nitrification and denitrification in aerobic chemostat culture ofThiosphaerapantotroph[J]. Appl. Environ. Microbiol., 1988,54:2812-2818.
[4]彭文启, 王世岩, 刘晓波. 洱海水质评价[J]. 中国水利水电科学研究院学报, 2005, (3):192-198.
[5]张 文. 洱海沉积物反硝化细菌鉴定研究[D].云南大理:大理学院, 硕士学位论文, 2012.
[6]潘晓洁, 常锋毅, 康丽娟, 等. 洱海鱼腥藻优势种的形态鉴定与16S rRNA基因序列分析[J].武汉植物学研究, 2008, 26(3):229-234.
[7]倪兆林, 申元英, 王 涛, 等. 洱海水华铜绿微囊藻生长特性的初步研究[J].大理学院学报, 2013, 12(4):48-50.
[8]倪兆林, 申元英, 王 涛, 等. 苹果酵素对微囊藻的溶藻特性研究[J]. 环境与健康杂志, 2014, 31(1):57-59.
[9]Garrity G M, Winters M, Searles N B. Searles Bergry’s Manual of Systematic Bacteriology [M].(2nd edn). Berlin:Springer-Verlag, 2009.
[10]布坎南 R E, 吉本斯 N E. 伯杰细菌鉴定手册[M].北京:科学出版社, 1984.
[11]王 兰, 王 忠. 环境微生物学实验方法与技术[M].北京:化工工业出版社, 2009.
[12]李 妍, 赵琳娜, 何宗均, 等.反硝化细菌的筛选及应用研究[J].天津农业科学, 2008, 14(5):43-44.
[13]Robertson L A, Kuenen G J. Aerubic denitrification:A controversy revived [J]. Arch. Microbiol., 1984,139(5):351-354.
[14]Wilson L P, Bouwer E J. Biodegradation of aromatic compounds under mixed oxygen/denitrifying conditions:A review [J]. J. Ind. Microbiol. Biotechnol., 1997,18(2-3):116-130.
[15]孙建光, 高俊莲, 马晓彤, 等. 反硝化微生物分子生态学技术及相关研究进展[J].中国土壤与肥料, 2007, (2):7-12.
[16]王圣瑞, 焦立新, 金相灿, 等. 长江中下游浅水湖泊沉积物总氮、可交换态氮与固定态铵的赋存特征[J]. 环境科学学报, 2008, 28(1):37-43.
[17]孟凡德, 姜 霞, 金相灿. 长江中下游湖泊沉积物理化性质研究[J].环境科学研究, 2004, 17:24-29.
[18]高 丽, 杨 浩, 周健民, 等. 滇池水体和沉积物中营养盐的分布特征[J].环境科学研究, 2004, 17(4):1-4.

