亲环素A生物学活性研究进展
刘紫艳, 田航宇, 邢文溪, 刘樾彤, 李 明
云南大学生命科学学院, 云南省高校动物遗传多样性和进化重点实验室, 昆明 650091
亲环素A(cyclophylin A,CypA)于1984年首次从牛胸腺细胞中提取得到,属于亲环素蛋白家族成员之一[1],被认为是一种免疫蛋白。亲环素是高度保守、广泛分布的蛋白家族,也称为亲免素,其中CypA分布最为广泛,几乎存在于所有的原核和真核生物细胞中。CypA是环孢霉素A(cyclosporin A,CsA)在细胞内的主要受体,所以又被称为环孢霉素A结合蛋白。CsA是由11 个氨基酸组成的环状多肽,是具有免疫抑制剂活性的真菌代谢产物,在临床上用于治疗器官移植后产生的免疫排斥反应,对抑制自身免疫疾病也有重要作用,因此认为CypA参与了体内的免疫抑制过程[2]。其后有大量研究表明,CypA除了具有免疫抑制功能外,还参与了生物体内许多其他重要生理功能,本文就CypA在蛋白折叠、免疫抑制、炎症反应、病毒感染、细胞凋亡以及植物方面的功能进行综述。
1 CypA在细胞内的生化反应机制
1.1分子伴侣
CypA在各种生物组织的广泛分布和表达,意味着CypA可能参与了细胞内的一些普遍性的生化功能。新生蛋白的正确折叠以及生物大分子的自我组装需要肽链的N末端肽键的顺反式异构化。亲环素蛋白家族的一个共同特征是其核心结构域中具有肽脯氨酰顺/反异构酶(peptidylprolylcis-transisomerase,PPIase)活性,亲环素的多样性由核心结构域侧面的N端和C端的氨基酸序列差异引起。CypA的PPIase中心能识别肽链中脯氨酸残基,通过催化脯氨酸肽键由反式变为顺式,从而迅速有效地整合新合成的蛋白质,改变蛋白质的构象,加速细胞内新生蛋白的折叠、装配和迁移,并参与调节有丝分裂、RNA成熟和DNA降解等[3]。缺少亲环素会导致蛋白质再折叠缓慢,而如果在蛋白折叠的过程中发生错误,就可能诱发异常蛋白,这可能会导致自身免疫疾病[4]。肿瘤发生过程中信号通路的不当激活可能造成一些蛋白复合物的错误折叠和断裂,而CypA的分子伴侣活性可修补这些错误并可维持蛋白质的稳态,这可能是CypA帮助肿瘤发生和存活的一个重要原因[5,6]。另外,CypA还在稳定多蛋白复合体,如Ca2+通道、类固醇激素受体和酪氨酸激酶受体等扮演重要角色,同时还参与了Pre-mRNA的剪接,RNA-RNA螺旋中断等[7]。
1.2信号分子
CypA除了通过协助蛋白折叠发挥着分子伴侣的作用外,大量研究表明,CypA可以作为一种信号分子,参与多方面的生理功能,例如炎症发生等。当机体组织受到损伤而发生炎症时,炎症区的多种细胞会分泌CypA。如在心肌炎中,活化的巨噬细胞和淋巴细胞,以及平滑肌细胞会分泌CypA,分泌到细胞外的CypA与其受体蛋白EMMPRIN(CD147)结合,一方面可以上调基质金属蛋白酶(matrix metalloproteinase,MMPs),发挥心肌重构的作用;另一方面激活炎症途径(inflammatory pathways),主要是通过上调单核细胞分泌的EMMPRIN受体IL-6和TNF-α来参与炎症反应,因此,CypA可以作为心肌损伤的一个检测信号指标来判断心肌炎的病理情况[8]。在细胞凋亡、免疫抑制等方面,CypA作为一种信号分子,也参与了许多信号传导的过程。
2 CypA在哺乳动物中的生物活性
2.1介导CsA的免疫抑制
CsA是广泛使用的一种免疫抑制药物,CypA是其在哺乳动物中分离纯化的第一个靶标分子。 在T细胞中,神经钙蛋白(calcineurin,CaN)是活化T细胞核因子(nuclear factor of activated T cells,NFAT)的一个调控蛋白,其活性受Ca2+和及钙调素(calmodulin,CaM)调节。NFAT是一个具有多向调节功能的转录因子,如调节T细胞的活化、分化和自身耐受性等。CsA通过与CypA结合,形成CsA-CypA复合物,再与CaN结合形成CsA-CypA-CaN复合物,从而抑制CaN的活性,使NFAT不能被去磷酸化,阻断了NFAT从胞浆到细胞核的转移,其下游的相关蛋白的转录活动被抑制,T 细胞活化所必需的一些细胞因子如IL-2等表达受阻,从而抑制了T细胞的增殖和活化,免疫反应被抑制[9~11](见图1)。本实验室在研究昆虫的细胞免疫反应中,发现了与哺乳动物非常不同的免疫抑制机制,当寄生蜂寄生斜纹夜蛾时,CypA和CypD可能参与了促进寄主血细胞的凋亡,从而抑制了寄主的免疫反应(未发表数据)。
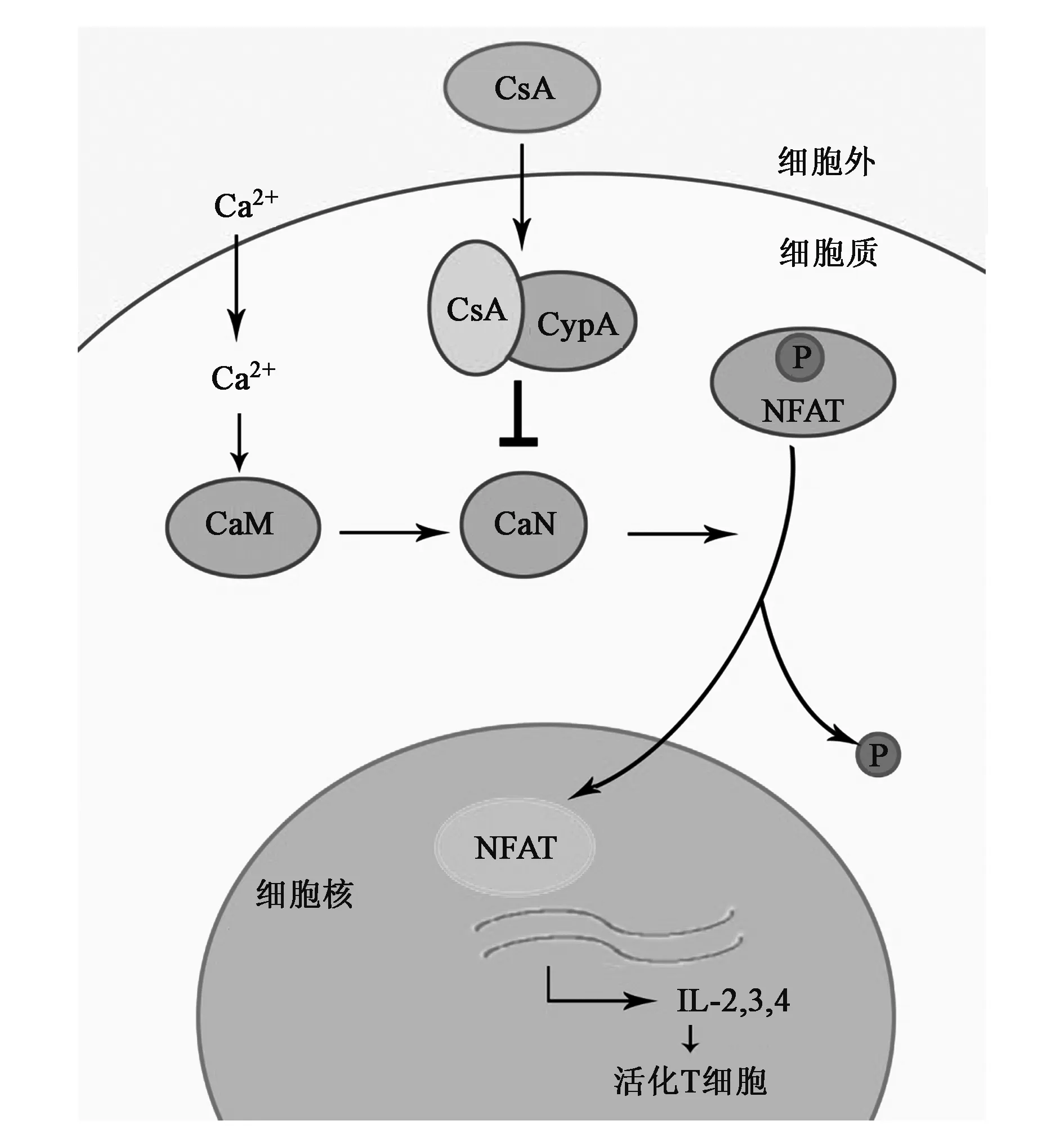
图1 CypA参与免疫抑制信号通路模式图
对于CypA的PPIase活性中心是否参与了免疫抑制,目前还具有争议。虽然有研究表明PPIase活性中心也是CsA的结合位点,但该位点结合CsA后不能再与其他底物结合。此外,Cyp A 与CsA 结合后,其PPIase 活性被抑制,但不影响CypA的免疫抑制功能[12]。CsA能抑制CypA的PPIase活性,但却不能抑制其他免疫抑制剂蛋白受体的PPIase活性[13]。
2.2参与炎症反应
体内外的研究表明,CypA是一种氧化应激诱导分泌因子,在炎症反应中产生的一系列活性氧簇(reactive oxygen species,ROS),如H2O2可刺激多种细胞分泌CypA,该过程需要Rho GTP酶(包括RhoA、Cdc42和Rac1)的参与,分泌到细胞外的CypA还可以通过NF-κB途径放大ROS的产生。CypA同时也是直接的炎症细胞趋化物质,可诱导炎症细胞分泌IL-6,通过活化NF-κB通路,刺激单核巨噬细胞的细胞/化学因子表达,如TNF-α、单核细胞趋化蛋白-1(MCP-1)、IL-8和IL-1。最后,CypA通过激活MMPs调节胶原蛋白水解活性,为炎症细胞迁移创造条件。在CypA基因敲除型(CypA-/-)小鼠体内,炎症细胞迁移到内膜明显减少,在CypA 过表达的老鼠体内却增加[14~16]。目前,已经在多种炎症疾病中检测到了CypA的高表达,如动脉粥样硬化[17]、风湿性关节炎[18]、败血症[19]和炎症心脏病[20]。
目前,研究发现在炎症反应中,分泌到细胞外的CypA可引起细胞内相关因子的产生和酶的激活,这与其受体膜蛋白CD147的表达存在密切关系。在炎症反应中,两者表达水平上调是重叠的,都可通过趋化因子作用使免疫细胞向炎症部位聚集,引起快速的炎症反应;而当阻断CypA与CD147的结合时,这种反应下降,细胞内的MMPs活性降低,IL-6和TNF-α表达下降,这说明CypA主要是与CD147结合激活了下游通路[8,21,22]。
2.3CypA与细胞凋亡
CypA作为一个炎症因子在参与炎症反应的过程中就与细胞凋亡存在密切关系[23]。早在1994年,Montague等[24]就发现CypA具有核酸内切酶的活性,具有降解超螺旋DNA的能力。与细胞凋亡时DNA降解的产物类似,在Ca2+或(和)Mg2+存在的情况下,CypA可以切割单链或双链DNA,切割产物中带3′-OH末端[25];另一方面,在神经细胞的研究中发现,当有外源因子或凋亡信号存在时,启动细胞凋亡信号的传导过程需要激活Bax或CypD,诱发凋亡诱导因子(AIF)从线粒体进入细胞质,与CypA结合成复合物,再共同转运进入细胞核,与DNA结合位点结合形成AIF-CypA-DNA复合物,进而引起染色体凝集和DNA呈大片段(约50kb)断裂,且AIF的促凋亡活性不受caspases抑制剂的影响,属于非caspases依赖性的凋亡途径(见图2)。与CypA类似,AIF也非常保守,是系统进化上很古老的一个凋亡效应分子,其促凋亡作用不依赖于caspases的存在[25~28]。

图2 CypA参与细胞凋亡信号通路模式图
但在肿瘤发生中,肿瘤细胞中会过度表达CypA,一方面通过隔离细胞色素C(cytochrome C,Cyt C),使下游的凋亡蛋白caspase 9不能被激活,从而使肿瘤细胞躲避细胞凋亡程序,帮助肿瘤细胞的存活[29];另一方面可能通过活化ERK1/2和p38MAPK信号途径,促进肿瘤细胞的增殖[30]。在过表达的CypA促进癌细胞增殖的过程中,主要通过细胞表面的CD147发挥信号传导的作用[22]。Yuan等[31]的研究显示,内皮细胞外的CypA可以激活Akt和NF-κB信号通路,提高下游抗凋亡蛋白Bcl-2的表达;当细胞内的CypA被沉默时,凋亡蛋白caspase 3的表达和细胞凋亡受到抑制。这些结果提示CypA在不同的细胞中发挥着不同的生理生化功能,甚至是功能相反的作用。
2.4参与病毒感染
一方面亲环蛋白可协助外源病毒对机体的感染,如CypA可与人类免疫缺陷病毒(HIV)gag基因编码的衣壳蛋白p24结合,促进HIV-1 病毒感染人体并在机体内复制,这被认为是HIV-1完全性感染中的一个必要环节。HIV 病毒衣壳蛋白的N 端的暴露部分连接到CypA 的袢环上,通过PPIase活性,促进HIV衣壳蛋白复合物分解。在该过程中,CypA还可以帮助HIV病毒衣壳蛋白逃脱人类细胞的抗病毒作用。CsA可以竞争性地抑制CypA与病毒衣壳蛋白的相互作用,从而阻断HIV病毒的感染,另一种可以阻止CypA与HIV病毒衣壳蛋白结合的是三模体蛋白5α (TRIM5α)[32,33]。另一方面,CypA可以通过抑制病毒的复制来阻止病毒感染。He等[34]的研究表明,CypA可通过促进宿主干扰素-β(INF-β)的分泌来抑制轮状病毒的复制,从而降低病感染的风险。上述结果说明,CypA针对不同细胞表现出显著不同的生化功能,可能对不同的病毒采取了差异化策略,因此不能简单地把CypA基因归纳为抗病毒基因或协助病毒感染的基因。
3 植物亲环素的功能
植物亲环素与其他生物亲环素的结构具有一定的相似性,但植物亲环素还含有植物特有的一个带正电荷的7个氨基酸插入序列(KS/MGKPLH)[35]。在功能上,植物亲环素也具有与其他生物类似的多种功能,如参与蛋白合成、参与生物胁迫与免疫反应。在蛋白合成方面,与亲环素在动物中的功能类似,主要体现在参与蛋白折叠,从而有助于蛋白质的迅速合成和稳定[35]。在胁迫环境中积累的植物亲环素是否参与了植物的免疫和防卫反应,目前研究显示植物亲环素也具有与动物类似的免疫功能。辣椒亲环素CaCyp1在病原菌感染时会被强烈诱导表达并积累[36];在蚕豆保卫细胞中,亲环素和环孢素A的复合物能够抑制免疫抑制剂靶物质钙调磷酸酶的活性[37],而钙调磷酸酶是参与免疫反应的一个重要蛋白。水稻亲环素因Cyp1能够抑制稻瘟病菌附着孢形成和菌丝生长[38]。大白菜亲环素C-Cyp具有抗真菌活性,可抑制真菌病原体生长,参与许多植物的防卫反应[39]。以上研究表明植物亲环素基因在受到病原刺激时也会大量表达,并能够抑制病菌的生长,从而提高植物的抗病和抗逆能力。
此外,植物Cyp还在环境胁迫应答中扮演重要角色。许多最新的研究表明,当植物处在不同的逆境环境或对植物进行胁迫处理时,亲环素基因会大量表达。如,当在干旱条件下,对棉花亲环素基因GhCyp1进行RT-PCR分析表明,该基因在叶片中的表达量在2 h内迅速升高[40];低氮胁迫诱导下,烟草叶片中大量表达亲环素基因[41];大豆和玉米的亲环素基因在各种逆境胁迫条件下出现mRNA的积累[42];盐、热激等条件可强烈诱导水芹亲环素基因ThCyp1表达[43]。这些结果表明亲环素作为一种植物胁迫应答蛋白,在应答胁迫的过程中,可能参与了多种生理生化反应,从而调节植物的抗逆性。
4 展望
作为在生物中广泛分布一种蛋白质,CypA具有多方面的功能,参与了分子伴侣、免疫抑制、炎症、细胞凋亡、病毒感染和胁迫应答等多方面的生理生化功能,此外,CypA还在介导胆固醇流出、调节细胞内胆固醇的动态平衡中发挥重要作用,与动脉粥样硬化发生有关[44]。亲环素基因非常保守,在动植物中的某些生物学活性也具有一定的相似性,如参与机体防御反应时上调表达。CypA参与动物炎症反应,能够介导免疫抑制,因此在医学上常常作为某些炎症疾病的诊断标记;植物亲环素在病原菌刺激下大量表达,能够抑制病菌生长,植物亲环素还可参与到环境胁迫因子的应答中以增强植物的抗逆性。目前研究发现的这些功能还存在碎片化的特点,要深入理解CypA的功能及其调控网络,还需要对其进行系统化的研究,这对于开发以CypA为分子靶标的新型药物,攻克病毒感染、免疫疾病,提升植物的抗逆性等具有重要意义。
[1]Handschumacher R E,Harding M W,Rice J,etal.. Cyclophilin:A specific cytosolic binding protein for cyclosporin A[J]. Science,1984,226:544-547.
[2]Wang P,Heitman J. The Cyclophilins[J]. Genome Biol.,2005,6(7):266-270.
[3]Ivery M T. Immunophilins:Switch on protein bingding domains[J]. Med. Res. Rev.,2000,20(6):452-484.
[4]Jackson K,Soll D. Mutations in a new A rabidopsis cyclophilin disrupt its interaction with protein phosphatase 2A[J]. Mol. Gen. Genet.,1999,262:830-838.
[5]Lee J. Role of cyclophilin a during oncogenesis[J]. Arch. Pharm. Res.,2010,33(2):181-187.
[6]Choi K J,Piao Y J,Lim M J,etal.. Overexpressed cyclophilin A in cancer cells renders resistance to hypoxia- and cisplatin-induced cell death[J]. Cancer Res.,2007,67(8):3654-3662.
[7]Horowitz D S,Lee E J,Mabon S A,etal.. A Cyclophilin functions in pre-mRNA splicing[J]. EMBO J.,2002,21 (3):470-480.
[8]Seizer P,Geisler T,Bigalke B,etal.. EMMPRIN and its ligand Cyclophilin A as novel diagnostic markers in inflammatory cardiomyopathy[J]. Int. J. Cardiol.,2013,163(3):299-304.
[9]Hogan P G,Chen L,Nardone J,etal.. Transcriptional regulation by calcium,calcineurin,and NFAT[J]. Genes Dev.,2003,17:2205-2232.
[10]Jabri B,Barreiro L B. Don’t move:LRRK2 arrests NFAT in the cytoplasm[J]. Nature Immunol.,2011,12(11):1029-1030.
[11]Li H M,Pink M D,Murphy J G,etal.. Balanced interactions of calcineurin with AKAP79 regulate Ca2+-calcineurin-NFAT signaling[J]. Nat. Struct. Mol. Biol.,2012,19:337-345.
[12]Bosco D A,Eisenmesser E Z,Pochapsky S,etal.. Catalysis of cis/trans isomerization in native HIV21 capsid by human cy clophilin A[J ]. Proc. Natl. Acad. Sci. USA,2002,99 (8):5247-5252.
[13]Christopher T W,Lynne D Z,Flank D M. Cyclosporin A,the cyclophilin class of peptidylprolyl isomerases,and blockade of T cell signal transduction[J]. J. Biol. Chem.,1992,267 (19):13115-13118.
[14]Liu L H,Li C Z,Cai C,etal.. Cyclophilin A (CypA) is associated with the inflammatory infiltration and alveolar bone destruction in an experimental periodontitis[J]. Biochem. Biophys. Res. Commun.,2010,391:1000-1006.
[15]Takapoo M,Chamseddine A H,Bhalla R C,etal.. Glutathione peroxidase-deficient smooth muscle cells cause paracrine activation of normal smooth muscle cellsviacyclophilin A[J]. Vasc.Pharmacol.,2011,55(5-6):143-148.
[16]Seizer P,Klingel K,Sauter M,etal.. Cyclophilin A affects inflammation,virus elimination and myocardial fibrosis in coxsackievirus B3-induced myocarditis[J]. J. Mol. Cell Cardiol.,2011,53:6-14.
[17]Coppinger J A,Cagney G,Toomey S,etal.. Characterization of the proteins released from activated platelets leads to localization of novel platelet proteins in human atherosclerotic lesions[J]. Blood,2004,103 (6):2096-2104.
[18]Kim H,Kim W J,Jeon S T,etal.. Cyclophilin A may contribute to the inflammatory processes in rheumatoid arthritis through induction of matrix degrading enzymes and inflammatory cytokines from macrophages[J]. Clin. Immunol.,2005,116(3):217-224.
[19]Dear J W,Leelahavanichkul A,Aponte A,etal.. Liver proteomics for therapeutic drug discovery:Inhibition of the cyclophilin receptor CD147 attenuates sepsis-induced acute renal failure[J]. Crit. Care Med.,2007,35(10):2319-2328.
[20]Seizer P,Geisler T,Bigalke B,etal.. EMMPRIN and its ligand Cyclophilin A as novel diagnostic markers in inflammatory cardiomyopathy[J]. Int. J. Cardiol.,2013,163(3):299-304.
[21]Hu R,Ouyang Q,Dai A,etal.. Heat shock protein 27 and cyclophilin A associate with the pathogenesis of COPD[J]. Respirology,2011,16 (6):983-993.
[22]Arora K,Gwinn W M,Bower M A,etal.. Extracellular cyclophilins contribute to the regulation of inflammatory responses[J]. J. Immunol.,2005,175(1):517-522.
[23]Jin Z G,Lungu A O,Xie L,etal.. Cyclophilin A is a proinflammatory cytokine that activates endothelial cells[J]. Arterioscler Thromb Vasc. Biol.,2004,24(7):1186-1191.
[24]Montague J W,Hughes F M,Cidlowski J A,etal.. Native recombinant cyclophilins A,B,and C degrade DNA independently of peptidylprolyl cis-trans-isomerase activity.Potential roles of cyclophilins in apoptosis[J]. J. Biol. Chem.,1997,272(10):6677-6684.
[25]Candé C,Vahsen N,Kouranti I,etal.. AIF and cyclophilin A cooperate in apoptosis-associated chromatinolysis[J]. Oncogene,2004,23:1514-1521.
[26]Zhu C L,Wang X Y,Deinum J,etal.. Cyclophilin A participates in the nuclear translocation of apoptosis-inducing factor in neurons after cerebral hypoxia-ischemia[J]. J. Exp. Med.,2007,204(8):1741-1748.
[27]Tanaka H,Shimazaki H,Kimura M,etal.. Apoptosis-inducing factor and cyclophilin A cotranslocate to the motor neuronal nuclei in amyotrophic lateral sclerosis model mice[J]. CNS Neurosci. Ther.,2011,17(5):294-304.
[28]Piao C S,Loane D J,Stoica B A,etal.. Combined inhibition of cell death induced by apoptosis inducing factor and caspases provides additive neuroprotection in experimental traumatic brain injury[J]. Neurobiol. Dis.,2012,46:745-758.
[29]Bonfils C,Bec N,Larroque C,etal.. Cyclophilin A as negative regulator of apoptosis by sequestering cytochrome C[J]. Biochem. Biophys. Res. Commun.,2010,393:325-330.
[30]Qi Y J,He Q Y,Ma Y F,etal.. Proteomic identification of malignant transformation-related proteins in esophageal squamous cell carcinoma[J]. J. Cell Biochem.,2008,104(5):1625-1635.
[31]Yuan W,Yan J C,Liang Y,etal.. Antiapoptotic and proapoptotic signaling of cyclophilin A in endothelial cells[J]. Inflammation,2013,36(3):567-572.
[32]Franke E K,Luban J. Inhibition of HIV-1 replication by cyclosporine A or related compounds correlates with the ability to disrupt the Gag-cyclophilin A interaction[J]. Virology,1996,222(1):279-282.
[33]Zhou D J,Mei Q,Li J T,etal.. Cyclophilin A and viral infections[J]. Biochem. Biophys. Res. Commun.,2012,424:647-650.
[34]He H Y,Zhou D J,Fan W P,etal.. Cyclophilin A inhibits rotavirus replication by facilitating host IFN-I production[J]. Biochem. Biophys. Res. Commun.,2012,422:664-669.
[35]Johnson J C,Bhave M. Characterisation and physical mapping of cycloph ilin A genes and identification of new classes of cycloph ilins in wheat[J]. J. Cereal Sci.,2004,40 (2):137-150.
[36]Kong H Y,Lee S C,Hwang B K. Expression of pepper cyclophilin gene is diferentially regulated during the pathogen infection and abiotic stress conditions[J]. Physiol. Mol. Plant Pathol.,2001,59 (4):189-199.
[37]Kinoshita T,Shimazaki K. Characterization of cytosolic cyclophilin from guard cells ofViciafabaL. [J]. Plant Cell Physiol.,1999,40 (1):53-59.
[38]Viaud M C,Balhadere P V,Talbot N J. AMagnaporthegriseacyclophilin acts as a virulence determinant during plant infection[J]. Plant Cell,2002,14 (4):917-930.
[39]Lee J R,Park S C,Kim J Y,etal.. Molecular and functional characterization of a cycloph ilin with antifungal activity from Chinese cabbage[J]. Biochem. Biophys. Res. Commun.,2007,353 (3):672-678.
[40]郭 芳,李艳军,张新宇,等. 棉花亲环素基因(GhCYP1)克隆及在干旱胁迫下的表达分析[J]. 分子植物育种,2010,8(2):265-270.
[41]杨惠娟,许 俐,史宏志,等. 低氮胁迫诱导烟草亲环素基因表达的研究[J]. 中国烟草学报,2012,18(3):93-96.
[42]Marivet J,Frendo P,Burkard G. Effects of abiotic stresses on cycloph ilin gene expression in maize and bean and sequence analysis of bean cyclophilin cDNA[J]. Plant Sci.,1992,84:171-178.
[43]Chen A P,Wang G L,Qu Z L,etal.. Ectopic expression ofThCYP1,a stress-responsive cyclophilin gene fromThellungiellahalophila, confers salt tolerance in fission yeast and tobacco cells[J]. Plant Cell Rep., 2007,26 (2):237-245.
[44]Nigro P,Satoh K,O'Dell M R,etal.. Cyclophilin A is an inflammatory mediator that promotes atherosclerosis in apolipoprotein E-deficient mice[J]. J. Exp. Med.,2011,208(1):53-66.

