盐穗木转录因子HcSCL13转录激活的体外鉴定及植物表达载体的构建
周莲洁 张富春 王艳
GRAS家族是一类植物特有的转录调控因子,由最初发现的3个家族成员GAI、RGA和SCR的特征字母命名[1-4]。根据对GRAS家族基因分析将该家族分成了8个分支,分别为SCL3、SHR、PAT1、LISCL、DELLA、SCR、LS 和 HAM[5,6]。GRAS 家族基因在植物的生长发育过程中起着重要的作用,且不同分支发挥不同的功能,其中SHR-SCR和LS、HAM、PAT1及DELLA分支蛋白分别在根及腋芽的发育[7-11]、分生组织的维持[12]、光敏色素信号通路[13-15]及GA信号通路[16-18]等生物代谢过程中发挥作用。此外,很多GRAS家族蛋白还在植物逆境胁迫中发挥重要作用,并且成为近年来研究的热点,如Torres-Galea等[14]检测拟南芥PAT1分支AtSCL13表达模式时发现,在盐、干旱、低温等非生物胁迫及植物激素刺激下均能诱导表达AtSCL13;同属PAT1分支的佛手GRAS基因,在低温胁迫下其表达明显上调[19];卷心菜BoGRAS(SCL13)积极响应热处理,可以作为卷心菜耐热品种的分子标记基因[20];水稻OsGRAS1基因在干旱、盐及外源ABA诱导下表达上调;通过过表达胡杨GRAS基因SCL7,可以显著提高转基因拟南芥的耐盐性和耐旱性[21]等。
盐穗木(Halostachys caspica)属藜科(Chnopodiaceo)盐穗木属(Halostachys),是盐生、旱生稀盐多汁半灌木,生长于荒漠地区盐碱地、盐湖边及河岸,绿期长,是具有重要生态价值的盐生植物[22,23],常常成为盐生植物群落的建群种或优势种[24]。HcSCL13是盐穗木中发现的第一个具有典型C端保守结构域的GRAS转录因子家族基因,隶属该家族PAT1分支,我们前期试验发现该基因能够积极响应盐胁迫[25],推断其可能在盐穗木耐盐机制中发挥重要作用。
本研究将HcSCL13与酵母GAL4转录因子DNA结合域融合,构建重组质粒pGBKT7-HcSCL13,并将其转化酵母Y2HGold,检测HcSCL13诱饵蛋白对酵母细胞有无毒性作用和自激活活性,同时构建该基因的植物过表达载体和亚细胞定位载体,旨在为阐述HcSCL13的耐盐功能和作用机制奠定基础。
1 材料与方法
1.1 材料
以本实验室保存的pMD18-T-HcSCL13为模板。PCR回收纯化试剂盒购自TIANGEN公司;Ex Taq酶和限制性内切酶购自TaKaRa公司;酵母双杂交系统(MatchmakerTMGold Yeast Two-Hybrid System)、同源重组酶(In-Fusion Advantage PCR Cloning Kit)、X-α-Gal、AureobasidinA(以下简称 AbA)、缺陷性培养基购自Clontech公司;PCR引物均由上海生工生物技术有限公司合成。
1.2 方法
1.2.1 酵母诱饵表达载体pGBKT7-HcSCL13的构建及鉴定 以测序正确的质粒pMD18-T-HcSCL13为模板,利用 DNAman软件设计特异性引物,并分别在上游引物和下游引物的5' 端引入EcoR I和BamH I酶切位点,引物HcSCL13 baitP1:5'-CATGGAGG CCGAATTCATGCAAACATCTCAGCATGATTGC-3';HcSCL13 baitP2:5'-GCAGGTCGACGGATCCTCACCT CCACGCAGAGGAAGATGA-3'。下划线部分为同源重组序列。
PCR 扩增体系(20μL):Ex Taq Buffer 2μL,dNTP Mix(2.5mmol/L)2μL,HcSCL13 baitP10.35μL,HcSCL13 baitP20.35μL,Ex Taq 聚合酶 0.3μL,ddH2O 14μL,cDNA 1μL。反应程序为 94℃ 5min;94℃ 30s,62℃ 30s,72℃ 2min,35个循环;72℃ 10min。1%琼脂糖凝胶电泳进行检测PCR回收产物。取纯化后的PCR产物和线性化的质粒pGBKT7/EcoR I+BamH I进行同源重组,构成pGBKT7-HcSCL13,转化至大肠杆菌DH5α,在含Kan的LB平板上筛选阳性克隆,酶切鉴定正确后送北京华大公司测序。
1.2.2 诱饵表达载体pGBKT7-HcSCL13转化酵母细胞Y2HGold 参考Clontech公司Gold yeast twohybrid system标准的操作方法制备酵母感受态细胞。取 0.1μg的重组质粒 pGBKT7-HcSCL13,加入 50μg yeast carrier DNA与50μL Y2HGold感受态细胞混匀,再加入0.5mL PEG/LiAc溶液并混匀。30℃培养30min,加入 20μL DMSO,42℃水浴热激 15min,离心后用1mL YPD plus medium重悬,30℃培养45min,离心并用1mL 0.9% NaCl重悬,涂布在SD/-Trp固体培养基上,30℃倒置培养3-5d。
1.2.3 诱饵蛋白的表达检测 挑取阳性克隆,并接种于SD/-Trp液体培养基中至OD值达到0.8,离心沉淀酵母细胞,用抽提Buffer(0.1mol/L Tris-HCl,0.2mol/L NaCl,0.01mol/L β-巯基乙醇,20% 甘油,5mmol/L EDTA,1mmol/L PMSF)重悬细胞,加入融壁酶(终浓度0.1U/mL)后于30℃、150r/min孵育30min,超声破碎细胞,提取酵母蛋白。以c-Myc Monoclonal Antibody作为一抗(1∶1000稀释),辣根过氧化物酶结合的羊抗小鼠IgG作为二抗(1∶5000稀释),使用5%浓缩胶,12%分离胶进行Western blot检测诱饵蛋白表达情况。
1.2.4 诱饵蛋白HcSCL13对酵母Y2HGold毒性的检测 参照Clontech公司Gold yeast two-hybrid system标准的操作方法,将已转化成功的酵母pGBKT7-HcSCL13/Y2HGold和空载酵母pGBKT7/Y2HGold分别涂在SD/-Trp固体培养基上,30℃倒置培养3-5d,观察菌落的大小,如果诱饵菌株的菌斑比对照组小,说明pGBKT7-HcSCL13对酵母Y2HGold有毒性;反之,说明没有毒性。
1.2.5 转录激活活性的鉴定 将鉴定正确的阳性克隆接种于SD/-Trp液体培养基中至OD值达到0.3,离心沉淀酵母细胞,用1mL 0.9% NaCl重悬细胞。用酶标仪(Benchmark Plus,美国Bio Rad公司)测定菌液OD值,调整至OD值一致,以1、1/10和1/100倍比稀释后分别涂布在SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/AbA 和 SD/-Trp/-His/-Ade固体平板上,30℃培养3-4d,观察酵母生长情况以及菌落的颜色变化,同时设立阴性对照pGBKT7-Lam/pGADT7-T/Y2HGold和阳性对照pGBKT7-53/pGADT7-T/Y2HGold。
1.2.6 植物表达载体的构建及鉴定 用BamH I和Pst I双酶切含有这两个酶切位点的HcSCL13PCR产物,将回收的酶切产物与经相同内切酶回收的植物表达载体pCAMIA1301-1连接,使其上游连有花椰菜花叶病毒35S启动子,下游连有NOS终止子,构建成植物表达载体pCAMIA1301-1-HcSCL13,连接产物转化大肠杆菌感受态细胞DH5α,在含有Kan(50mg/L)的LB培养基上进行筛选,挑取单菌落提取质粒,进行BamH I和Pst I双酶切鉴定。酶切正确的克隆送华大有限公司北京分公司进行测序,测序正确后,采用冻融法将pCAMIA1301-1-HcSCL13导入农杆菌EHAl05,为后续花序浸染拟南芥奠定基础。
为使HcSCL13基因融合于GFP的N端,在HcSCL13基因上下游引物中分别添加了Nco I酶切位点(下游引物去除密码子)。PCR产物用Nco I酶切后,连接到以相同酶切含有GFP基因的pCAMBIA1302载体上,构建成HcSCL13目的基因C端连有mGFP的融合表达载体pCAMBIA1302-HcSCL13-mGFP。连接产物的转化和筛选同上,挑取单菌落提取质粒,进行NcoI酶切鉴定,同时再以Sph I和Hind III对重组质粒pCAMIBA1302-HcSCL13-mGFP进行双酶切,鉴定正向插入的克隆。以上酶切正确的克隆送华大有限公司北京分公司进行测序。
2 结果
2.1 重组质粒pGBKT7-HcSCL13的鉴定
根据HcSCL13基因已知全长序列,设计特异性引物,将扩增纯化后的PCR产物与线性化的pGBKT7载体进行同源重组,获得重组质粒pGBKT7-HcSCL13。用引物HcSCL13baitP1和HcSCL13baitP2进行菌液PCR,得到了约1700bp的目的片段(图1)。小量提取菌液PCR鉴定正确的质粒,由于HcSCL13基因序列内部含有EcoR I限制性内切酶位点,故选用载体上游的Nco I和基因内部的BamH I两个限制性内切酶消化重组质粒,获得了预期大小的目的片段(图1)。
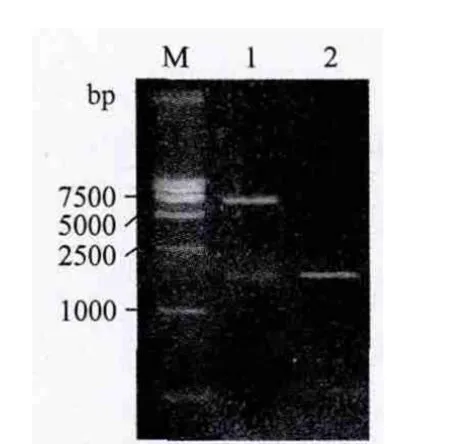
图1 重组质粒pGBKT7-HcSCL13的鉴定
2.2 pGBKT7-HcSCL13/Y2HGold酵母菌株的鉴定
将测序正确的 pGBKT7-HcSCL13/DH5α菌株提取质粒后转化Y2HGold感受态细胞,在SD/-Trp固体培养基上30℃倒置培养3-5d,挑选单克隆在SD/-Trp液体培养基中震荡培养2d,用Easy Yeast Plasmid Isolation Kit提取酵母质粒,通过质粒PCR鉴定阳性克隆,结果(图2)显示,已成功获得含重组质粒的诱饵蛋白菌株。
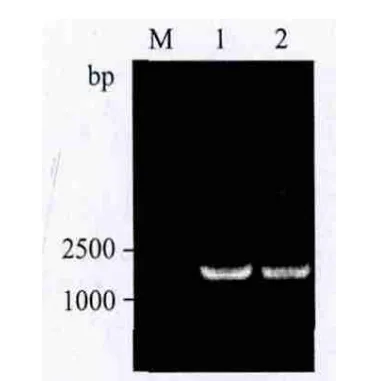
图2 阳性酵母克隆的质粒PCR
2.3 诱饵蛋白的表达及毒性检测
对鉴定正确的pGBKT7-HcSCL13/Y2HGold酵母菌株进行培养表达,经Western blot检测,结果(图3-A)显示,该菌株表达出80kD左右(理论大小79kD)的融合蛋白。将阳性重组菌株pGBKT7-HcSCL13/Y2HGold和空载对照pGBKT7/Y2HGold稀释调整至相同的OD值,涂布在同一个的SD/-Trp平板上,培养3 d后平板上出现大小一致的菌落(图3-B),因此认为表达的融合蛋白对酵母Y2HGold没有毒性作用。
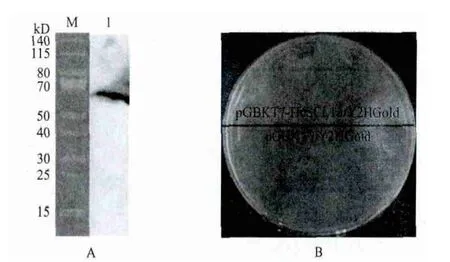
图3 诱饵蛋白的表达(A)和毒性检测(B)
2.4 诱饵蛋白的自激活检测
将试验重组菌株pGBKT7-HcSCL13/Y2HGold、阳性对照菌株pGBKT7-53/pGADT7-T/ Y2HGold和阴性对照菌株pGBKT7-Lam/pGADT7-T/Y2HGold稀释调整至相同OD600值,分别涂布于SD/-Trp、SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/ AbA平板上进行自激活检测,结果(图4)显示,含诱饵蛋白HcSCL13的菌株在SD/-Trp培养基上呈乳白色,而在SD/-Trp/X-α-Gal、SD/-Trp/X-α-Gal/AbA培养基上呈现蓝色菌落,在SDO/-His/-Ade培养基上也有菌落生长,与阳性对照表型一致,表明诱饵蛋白具有转录自激活活性。
2.5 植物表达载体的构建及鉴定
将HcSCL13构建至植物表达载体pCAMBIA13-01-1中,酶切鉴定片段大小正确(图5泳道1),构建成植物表达载体pCAMBIA1301-1-HcSCL13(图6-A),经测序HcSCL13读码框正确,将重组质粒转入农杆菌EHA105中。通过设计特异性引物扩增HcSCL13基因,使其融合于GFP的N端构建成融合表达载体pCAMBIA1302-HcSCL13-mGFP(图6-B),酶切鉴定片段大小正确(图5泳道3)。为进一步确定目的基因连接方向的正确性,采用限制性内切酶Sph I和Hind III切出了与预计大小一致的目的片段(图5泳道2)。
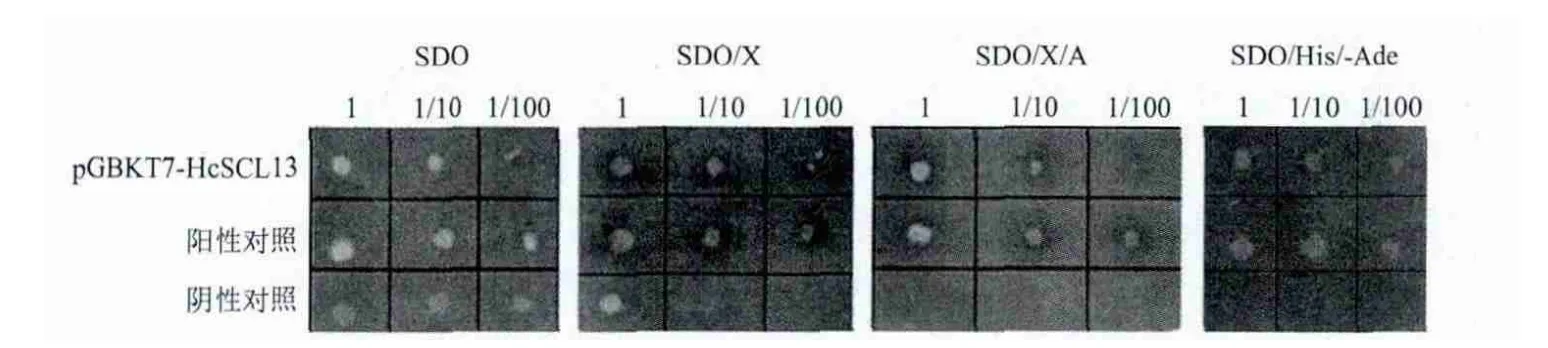
图4 HcSCL13诱饵蛋白自激活检测
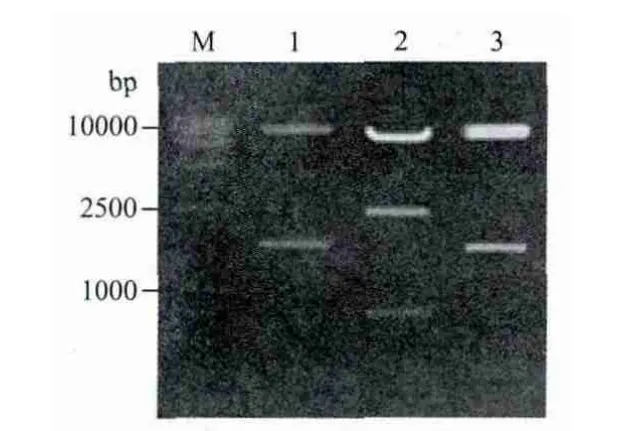
图5 HcSCL13植物表达载体的酶切鉴定
3 讨论
转录因子又称反式作用因子,是能与位于转录起始位点上游 50-5000bp的顺式作用元件、沉默子或增强子结合并参与调节靶基因转录效率的一组蛋白,能将来自细胞表面的信息传递至细胞核内[26],通过与DNA序列及与其他蛋白间的相互作用激活或抑制转录。
GRAS家族是一类植物特有的转录调控因子,GRAS家族蛋白间及与其他蛋白间的相互作用在植物多种生长代谢和逆境胁迫中发挥重要作用。其中,GRAS家族的DELLA分支蛋白在赤霉素(GA)信号转导途径中可以通过与GA受体GID1蛋白结合形成GA-GID1-DELLA 三联复合体[27-29],之后与SCFSLY1/GID2/SNE蛋白复合体中的F-box蛋白SLY1特异性结合,解除DELLA 蛋白的抑制作用,使植株表现出正常的 GA 反应和生长发育状态[17,29,30]。而GRAS家族的另一分支蛋白SHR在根内皮层的细胞层中与SCR相互作用,并在细胞核中形成复合物,阻止SHR运输到皮质细胞层[31];储存在细胞核内的复合物激活更多的SCR产生以保证足够的SCR捕获SHR到内皮层的细胞层,从而使植物形成单层内皮层。SCL21作为GRAS家族蛋白可以与PAT1相互作用,共同作用于光敏色素phyA的信号转导[32]。苜蓿中,GRAS家族NSP1和NSP2能形成同源和异源多聚体并结合在早期结瘤素基因ENOD11启动子上,调控早期结瘤素基因的表达[33]。此外,SCL13可与EFR5 结合并相互作用调节下游基因表达,在植物防御中发挥着重要作用,负调控植物的几丁质信号通路和真菌防御系统,而在水杨酸(SA)信号通路和细菌防御中起到正调控的作用[34]。以上结果表明GRAS家族转录因子通过与其他蛋白相互作用在植物的生长发育和逆境防御中起重要调控作用。
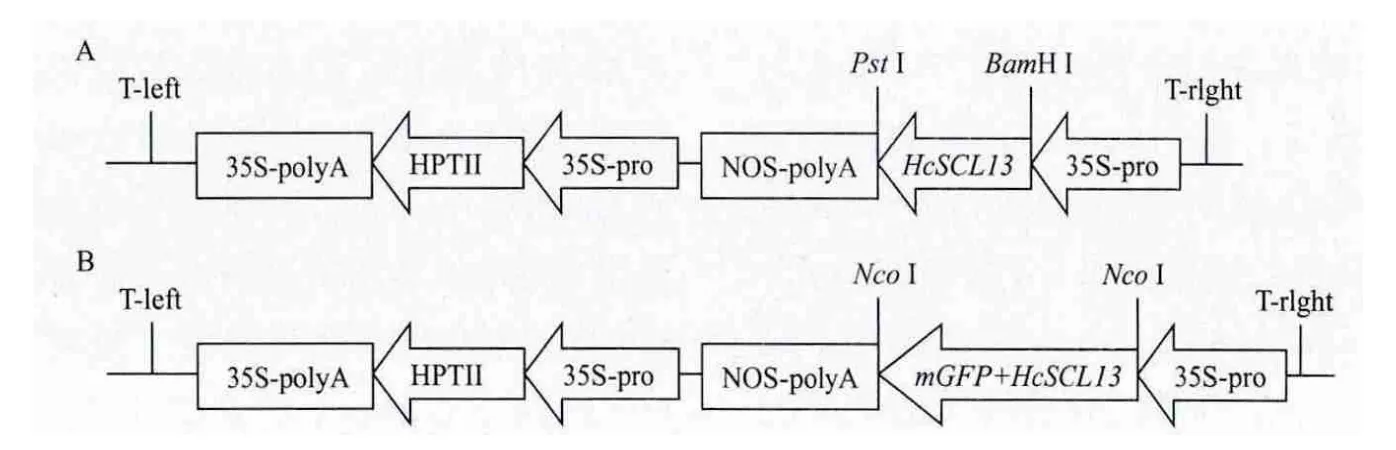
图6 HcSCL13植物表达载体pCAMBIA1301-1-HcSCL13(A)和pCAMIBA1302-HcSCL13-mGFP(B)构建示意图
本试验所用的酵母菌株Y2HGold 带有4个报告基因AUR1-C、MEL1、HIS3、ADE2。在酵母双杂交GAL4系统基础上构建了盐穗木GRAS家族蛋白基因HcSCL13的重组诱饵表达载体pGBKT7-HcSCL13,并将其转染酵母菌Y2HGold中。通过X-α-Gal和金担子素(AbA)筛选,pGBKT7-HcSCL13/Y2HGold和阳性对照pGBKT7-53/pGADT7-T/Y2HGold生长出蓝色菌落,而阴性对照pGBKT7-Lam/pGADT7-T/Y2HGold无菌落出现,表明HcSCL13蛋白可作为转录因子激活报告基因AUR1-C和MEL1的表达。进一步使用His、Ade营养缺陷性培养基筛选,pGBKT7-HcSCL13/Y2HGold和阳性对照生长出菌落,而阴性对照无菌落出现,说明重组质粒表达的蛋白也激活了下游报告基因HIS3、ADE2的表达。经毒性检测,pGBKT7-HcSCL13/Y2HGold菌株能够在SD/-Trp培养基上正常生长,表明表达的重组融合蛋白对酵母菌株Y2HGold无毒性作用。由此可得出,HcSCL13重组蛋白对Y2HGold生长无毒性作用且具有转录自激活能力,表明HcSCL13具有转录激活域,是一类转录因子。
现阶段,虽然已在拟南芥、水稻、佛手、胡杨、烟草等多种植物中发现了响应低温、干旱、渗透和激素等逆境胁迫的GRAS家族基因。但对GRAS家族基因在植物抗逆过程中的具体作用机制尚不清楚,该家族在植物抗逆途径中如何发挥作用还有待研究。从盐穗木盐抑制差减文库中克隆得到的HcSCL13是GRAS家族成员,前期研究结果显示,该基因能够积极响应盐胁迫,故推测HcSCL13可能在盐穗木耐盐途径中发挥重要作用。而植物表达载体和亚细胞定位载体的成功构建,为进一步利用农杆菌介导法进行基因转移、基因表达定位和功能研究奠定了基础。此外,本试验通过对HcSCL13诱饵蛋白载体的构建和自激活检测,验证了该转录因子的自激活特性,为后续寻找HcSCL13转录激活域、筛选互作蛋白提供良好依据,同时为阐明HcSCL13蛋白在盐穗木耐盐途径中发挥的作用奠定基础。
4 结论
本试验通过同源重组的方法成功构建诱饵表达载体并获得阳性酵母菌株pGBKT7-HcSCL13/Y2HGold,将其涂布在不同筛选培养基上,研究其转录激活活性,结果发现HcSCL13重组蛋白对Y2HGold生长无毒性作用,并且能够激活四种报告基因的表达。以上结果说明HcSCL13具有转录激活域,是一类转录因子。而植物表达载体和亚细胞定位载体的成功构建,为进一步在体内研究该基因功能奠定了基础。
[1]Pysh LD, Wysocka-Diller J, Camilleri C, et al. The GRAS gene family in Arabidopsis:sequence characterization and basic expression analysis of SCARECROW-LIKE genes[J]. Plant J,1999, 18(1):111-119.
[2]Bolle C. The role of GRAS proteins in plant signal transduction development[J]. Planta, 2004, 218(5):683-692.
[3]Laurenzio LD, Wysocka-Diller J, Malamy JE, et al. The SCARECROW gene regulates an asymmetric cell division that is essential for generating the radial organization of the Arabidopsis root[J]. Cell, 1996, 86(3):423-433.
[4]Silverstone AL, Ciampaglio CN, Sun T. The Arabidopsis RGA gene encodes a transcriptional regulator repressing the gibberellin signal transduction pathway[J]. Plant Cell, 1998, 10(2):155-169.
[5]Sibylle H, Giles EDO. GRAS-domain transcription factors that regulate plant development[J]. Plant Signal Behav, 2009, 4(8):698-700.
[6]Tian CG, Wan P, Sun SH, et al. Genome-wide analysis of the GRAS gene family in rice and Arabidopsis[J]. Plant Mol Biol, 2004, 54(4):519-532.
[7]Stuurman J, Jaggi F, Kuhlemeier C. Shoot meristem maintenance is controlled by a GRAS-gene mediated signal from differentiating cells[J]. Gene Dev, 2002, 16(17):2213-2218.
[8]Sole A, Sanchez C, Vielba JM, et al. Charaterization and expression of a Pinus radiata putative ortholog to the Arabidopsis SHORTROOT gene[J]. Tree Physiol, 2008, 28(11):1629-1639.
[9]Levesque MP, Vernoux T, Busch W, et al. Whole-genome analysis of the SHORT-ROOT developmental pathway in Arabidopsis[J].PloS Biology, 2006, 4(5):739-752.
[10]Sassa N, Matsushita Y, Nakamura T, Nyunoya H. The molecular characterization and in situ expression pattern of pea SCARECRO W gene[J]. Plant Cell Physiol, 2001, 42(4):385-394.
[11]Helariutta Y, Fukaki H, Wysocka-Diller J, et al. The SHORTROOT gene controls radial patterning of the Arabidopsis root through radial signaling[J]. Cell, 2000, 101(5):555-567.
[12]Stuurman J, Jaggi F, Kuhlemeier C. Shoot meristem maintenance is controlled by a GRAS-gene mediated signal from differentiating cells[J]. Gene Dev, 2002, 16(17):2213-2218.
[13]Bolle C, Koncz C, Chua NH. PAT1, a new member of the GRAS family, is involved in phytochrome A signal transduction[J].Gene Dev, 2000, 14(10):1269-1278.
[14]Torres-Galea P, Huang LF, Chua NH, Bolle C. The GRAS protein SCL13 is a positive regulator of phytochrome-dependent red light signaling, but can also modulate phytochrome A responses[J].Mol Genet Genomics, 2006, 276(1):13-30.
[15]Achard P, Cheng H, Grauwe LD, et al. Integration of plant responses to environmentally activated phytohormonal signals[J]. Science,2006, 311(5757):91-94.
[16]Aleman L, Kitamura J, Abdel-mageed H, et al. Functional analysis of cotton orthologs of GA signal transduction factors GID1 and SLR1[J]. Plant Mol Biol, 2008, 68(2):1-16.
[17]Zhang ZL, Ogawa M, Fleet CM, et al. SCARECROW-LIKE 3 promotes gibberellin signaling by antagonizing master growth repressor DELLA in Arabidopsis[J]. Proc Natl Acad Sci, 2011, 108(5):2160-2165.
[18]Liao WB, Ruan MB, Cui BM, et al. Isolation and characterization of a GAI/RGA-like gene from Gossypium hirsutum[J]. Plant Growth Regul, 2009, 58(1):35-45.
[19]石瑞, 曹诣斌, 陈文荣, 郭卫东. 佛手GRAS基因的克隆及表达分析[J]. 浙江师范大学学报, 2011, 34:446-451.
[20]Park HJ, Jung WY, Lee SS, et al.Use of heat stress responsive gene expression levels for early selection of heat tolerant cabbage(Brassica oleracea L.)[J]. Int J Mol Sci, 2013, 14:11871-11894.
[21]Ma HS, Liang D, Shuai P, et al. The salt- and drought-inducible poplar GRAS protein SCL7 confers salt and drought tolerance in Arabidopsis thaliana[J]. J Exp Bot, 2010, 61:4011-4019.
[22]曾幼玲, 蔡忠贞, 马纪, 等. 盐分和水分胁迫对两种盐生植物盐爪爪和盐穗木种子萌发的影响[J]. 生态学杂志, 2006,25:1014-1018.
[23]蔡伦, 张富春, 马纪, 等. 新疆3种藜科盐生植物NHX基因的克隆与序列分析比较[J]. 植物生理学通讯, 2005, 41(3):383-387.
[24]郗金标, 张福锁, 毛达如, 等. 新疆盐生植物群落物种多样性及其分布规律的初步研究[J]. 林业科学, 2006, 42(10):6-12.
[25]周莲洁, 杨中敏, 张富春, 王艳. 新疆盐穗木GRAS转录因子基因克隆及表达分析[J]. 西北植物学报, 2013, 33(6):1091-1097.
[26]刘强, 张贵友, 陈受宜. 植物转录因子的结构与调控作用[J].科学通报, 2000, 45(14):1465-1474.
[27]Sun TP. Gibberellin-GID1-DELLA :a pivotal regulatory module for plant growth and development[J]. Plant Physiol, 2010, 154:567-570.
[28]Sun XL, Jones WT, Harvey D, et al. N-terminal domains of DELLA proteins are intrinsically unstructured in the absence of interaction with GID1/gibberellic acid receptors[J]. J Biol Chem, 2010,285:11557-11571.
[29]Willige BC, Ghosh S, Nill C, et al. The DELLA domain of GAI NSENSITIVE mediates the interaction with the GA INSENSITIVE DWARF1A gibberellin receptor of Arabidopsis[J]. Plant Cell,2007, 19:1209-1220.
[30]Hirano K,Ueguchi-Tanaka M, Matsuoka M. GID1-mediated gibberellin signaling in plants[J]. Trends Plant Sci, 2008, 13:192-199.
[31]Cui HC, Levesque MP, Vernoux T, et al. An evolutionarily conserved mechanism delimiting SHR movement defines a single layer of endodermis in plants[J]. Science, 2007, 316:421-425.
[32]Torres-Galea P, Hirtreiter B, Bolle C. Two GRAS proteins,SCARECROW-LIKE21 and PHYTOCHROME A SIGNAL TRANSDUCTION1, function cooperatively in phytochrome A signal transduction[J]. Plant Physiol, 2013, 161:291-304.
[33]Hirsch S, Kim J, Muñoz A, et al. GRAS proteins form a DNA binding complex to induce gene expression during nodulation signaling in Medicago truncatula[J]. Plant Cell, 2009, 21:545-557.
[34]Son GH, Wan J, Kim HJ, et al. Ethylene-responsive elementbinding factor 5, ERF5, is involved in chitin-induced innate immunity response[J]. Mol Plant Microbe In, 2012, 25(1):48-60.

