室温固相法制备纳米Fe2O3的工艺研究
李 锋,王桂萍,滕慧奇
(1.沈阳大学 师范学院,辽宁 沈阳110044;2.沈阳理工大学 装备工程学院,辽宁 沈阳110159)
室温固相法制备纳米Fe2O3的工艺研究
李 锋1,王桂萍2,滕慧奇2
(1.沈阳大学 师范学院,辽宁 沈阳110044;2.沈阳理工大学 装备工程学院,辽宁 沈阳110159)
以FeCl3·6H2O和NaOH为原料,Tween-80为分散剂,在室温下通过固相反应制备前驱物,然后煅烧前驱物制得纳米氧化铁。研究了表面活性剂的用量、前驱物的煅烧温度、煅烧时间对产物的影响。利用XRD对制备的纳米氧化物进行表征。结果表明,制备的产物为纳米α-Fe2O3。表面活性剂Tween-80可使产物的产率明显提高,粒径减小;随煅烧温度的提高,煅烧时间的延长,产物的粒径先减小,再增大。煅烧温度500℃,煅烧时间2h,制得的α-Fe2O3的平均粒径为21nm。
固相法;纳米氧化铁;α-Fe2O3
纳米氧化铁与块体材料相比具有独特的物理和化学性质,如更大的比表面积、更高的导电性,良好的耐候性、耐光性、化学稳定性、磁性。另外,纳米氧化铁对紫外线具有良好的吸收和屏蔽效应,可被应用在闪光涂料、油墨、塑料、皮革、汽车面漆、电子、高磁记录材料、催化剂及生物医学工程等方面,因此成为研究热点[1-3]。目前报道的纳米氧化铁的制备方法概括起来有液相法,气相法和固相法[4]。纳米氧化物的固相制备方法一般有机械粉碎法和固相化学反应法,机械粉碎法很难制得粒径小于100nm的产物。近些年发展起来的室温固相法因工艺简单、成本低,并克服了由于中间步骤及高温反应所引起的诸如粒子团聚、晶化时间长、产物不纯、产率低等弊端,而且不使用溶剂、污染少、节省能源,正逐步成为一种重要的制备纳米材料的方法[5-9]。本文以FeCl3·6H2O和NaOH为原料,以Tween-80为分散剂,研究纳米Fe2O3的室温固相法的制备工艺。
1 实验部分
1.1 药品与仪器
六水三氯化铁(沈阳化学试剂厂)、氢氧化钠(天津市大茂化学试剂厂)、Tween-80(沈阳化学试剂厂)、无水乙醇、三氯化铁,以上试剂均为分析纯,用水为去离子水。SHB-Ⅲ循环水式多用真空泵,DHG-9030A高温恒温试验箱(无锡博奥试验设备有限公司),SX2-8-I3箱式电阻炉,Rigaku Ultima IV X射线衍射仪(日本理学北京事务所),马弗炉,BG-01超声波清洗机(广州邦洁电子产品有限公司)。
1.2 纳米Fe2O3的制备
称取定量的FeCl3·6H2O和NaOH固体,分别置于研钵中进行研磨,直至无明显颗粒。将预研磨后的FeCl3·6H2O和NaOH固体粉末以物质的量比1∶3混合于研钵中,搅拌,加入定量的表面活性剂Tween-80,于室温下研磨一定时间,得粘稠状产物,用去离子水超声洗涤,真空抽滤,直至水溶液的pH值小于8,并检验无Cl-存在。对抽滤所得固相产物用无水乙醇洗涤三次,离心分离。将沉淀物置于蒸发皿中,在80℃干燥2h,得前驱体Fe(OH)3。将干燥后的前驱体研磨,装入坩锅,放入马弗炉,在一定温度下锻烧一定时间得目标产物。
1.3 纳米Fe2O3的表征
利用日本株式会社理学北京事务所生产的Rigaku Ultima IV型X射线衍射仪进行XRD表征。测试主要参数为:工作电压40kV,工作电流40mA;步长扫描,步长0.02°;扫描范围10°~80°(2θ);采用Cu靶Kα辐射(λ=1.54056Å)。测得数据利用Jade 5.0衍射数据分析软件分析。
2 实验结果与讨论
2.1 低热固相反应的机理初探
当将FeCl3·6H2O(s)和NaOH(s)混合,加入适量Tween-80,在室温下研磨时,很快就发生反应,同时释放出热量,反应方程式如下:
FeCl3·6H2O (s)+3NaOH(s)→Fe(OH)3(s)+3NaCl(s)+6H2O
研磨可以增加分子接触的机会,是缩短反应时间、促进反应发生的重要手段。经过研磨可使反应物粒径减小,反应体系的总自由能增加而活化,从而引发固相反应。固体中离子被束缚于晶格中,在不同的晶面上暴露不同的结构部位,造成某些部位易于受到其它反应物的进攻,故固相反应呈现出一定的选择性。一般认为,固相反应过程经历四个阶段:扩散→反应→成核→生长,当产物成核速率大于生长速率时,有利于生成纳米微粒;若生长速率大于成核速率,则形成大粒径晶体。当有微量水存在时,形成湿固相反应,则更有利于扩散和反应,从而有利于生成纳米微粒。实验中分别使用带结晶水的氯化铁和不带结晶水的氯化铁与固体氢氧化钠反应,结果发现带结晶水的氯化铁与固体氢氧化钠反应更剧烈,速率明显更快。在含结晶水的化合物中,结晶水已成为晶格成分,由于研磨而使晶体表面微粒活化,发生反应,并放出热量,使晶体中的结晶水被释放出来,在反应物表面形成液膜并使部分反应物溶解,溶解了的反应物具有较快的传质速率,因而加快反应速率;另一方面,部分脱水的晶体具有不饱和配位,从而增强了固体的反应性。加入非离子型亲水表面活性剂Tween-80,使反应中释放出的结晶水快速润湿固体表面,使反应迅速发生,最终使产物的成核速率大于生长速率,从而有利于纳米微粒的形成。
2.2 表面活性剂用量的影响
分别称取5.406g(0.02mol)FeCl3·6H2O和2.500g的NaOH,表面活性剂Tween-80的用量分别取0mL、10mL、20mL、30mL、40mL、50mL;工艺条件:温度:室温;预研磨时间:60min;前驱体干燥温度:90℃;前驱体干燥时间:30min;煅烧温度:500℃;煅烧时间:120min。实验所得目标产物的产率与表面活性剂用量的关系见图1,部分产物的XRD图见图2。

图1 目标产物产率与表面活性剂用量的关系

图2 不同表面活性剂用量产物的XRD图谱
由图1可见,使用Tween-80,可使目标产物的产率明显提高;随着Tween-80用量的增加,目标产物的产率无明显变化。Tween-80用量增加,给后续的洗涤带来困难且造成原料浪费。由图2与标准卡片(JCPDS-82-1533)对比,可知产物均为α-Fe2O3,通过jade5.0软件计算粒径,不用表面活性剂的产物的平均粒径为36nm,用10mL、20mL、50mL所得产物平均粒径分别为21nm、19nm、19nm。由此可知,表面活性剂的用量对产物粒径的影响不是很大。本实验表面活性剂的用量取20mL为宜。
2.3 煅烧温度的影响
按照2.1的条件制备前驱体,将干燥后的前驱体置于6组坩埚中,分别在200℃、300℃、400℃、500℃、600℃和700℃下煅烧120min,得到目标产物氧化铁粉体。所得产物的外观形貌和粒径见表1,部分产物的XRD图见图3。

表1 不同煅烧温度产物的外观形貌和平均粒径
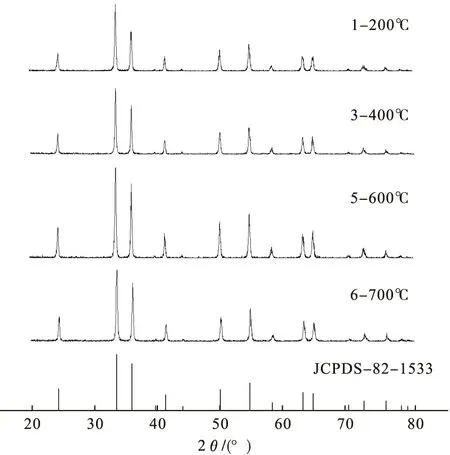
图3 不同煅烧温度产物的XRD图谱
由图3可见,所得产物均为纯的α-Fe2O3。试验发现,锻烧时间短(小于120min),产品颜色不好,并且粉体粒径较大;锻烧温度越高生成的产物颜色越鲜艳,锻烧温度超过600℃,生成的产物颜色加深。锻烧温度在600℃以下,产品粒径随着锻烧温度的升高而减小;600℃下有不同程度的颗粒,700℃下锻烧,产物为小块状,说明600℃煅烧温度下产品分散性能开始下降。超过700℃后,α-Fe2O3微小颗粒相互粘结在一起,颗粒粒径增大,其原因有:在前驱体高温分解过程中,由于刚分解得到的纳米粉体颗粒表面原子活性很高,容易使颗粒表面的原子扩散到相邻颗粒表面并与其对应的原子键合,形成稳定的化学键,从而形成永久硬团聚。500℃下,产物的粒径较小,本试验选取锻烧温度为500℃为宜。
2.4 煅烧时间的影响
将制得的前驱体干燥后置于5组坩埚中,在500℃下分别煅烧30min、60min、90min、120min、150min,所得产物的外观形貌和粒径见表2,部分产物的XRD图见图5。

图4 不同煅烧温度产物照片

表2 煅烧时间对产品性能的影响
由图5可见,所得产物均为纯的α-Fe2O3。开始时,随着锻烧时间的延长,粒子粒径逐渐减小,但120min后又逐渐增大;实验发现锻烧时间短,产物颜色较浅,随着时间的延长,产物颜色加深,超过120min,出现不同程度的团聚结块。锻烧时间过长,粒子由于产生烧结和过烧而团聚。综合考虑,锻烧时间120min为宜。

图5 不同煅烧时间产物的XRD谱
3 结论
(1)以三氯化铁和氢氧化钠为原料,室温固相法制备纳米α-Fe2O3,表面活性剂tween-80的加入可以减小产物的粒径,提高产率。
(2)前驱物的煅烧温度和煅烧时间对产物的粒径和颜色有影响,随煅烧温度的升高,煅烧时间的延长,产物的粒径先减小再增大,颜色加深。
(3)表面活性剂Tween-80用量为20mL/(0.02mol三氯化铁),研磨时间90min,煅烧温度为500℃,煅烧时间为2h,制得的纳米氧化铁的平均粒径为21nm。
[1]孟哲,魏雨,贾振斌.非晶态液相合成纳米级粉体历程研究[J].化学学报,2004,62(5):485-488.
[2]沙菲,宋宏昌.纳米α-Fe2O3的制备方法及应用概况[J].江苏化工,2003,31(5):12-15.
[3]刘建勋,李凤生,陈爱四,等.纳米Fe2O3的制备及其对AP热分解的催化作用[J].推进技术,2006,27(4):381-384.
[4]缪应菊,刘潍涓,刘刚,等.纳米氧化铁的制备工艺综述[J].材料开发与应用,2009,(2):73-75.
[5]邱春喜,姜继森,赵振杰,等.固相法制备α-Fe2O3纳米粒子[J].无机材料学报,2001,16(5):957-960.
[6]Li F,Zheng H,.Jia D,et al.Syntheses of perovskite-type composite oxides nanocrystals by solid-state reactions[J].Mater Lett,2002,(53):282-286.
[7]金春飞,景苏,忻新泉.低热固态化学反应与材料合成[J].无机化学学报,2002,18(9):859-870.
[8]杨翠.低温固相法制备金属纳米氧化物[D].上海:华东师范大学,2007.
[9]王桂萍,周建辉.室温固相法制备纳米Fe2O3[J].沈阳理工大学学报,2013,32(1):8-10.
StudyonNanocrystallineFe2O3byRoomTemperatureSolid-stateReaction
LI Feng1,WANG Guiping2,TENG Huiqi2
(1.Normal College,Shenyang University,Shenyang 110044,China;2.Shenyang Ligong University,Shenyang 110159,China)
Using FeCl3·6H2O and NaOH as the starting materials and surfactant Tween-80 as the dispersing agent,the precursor was prepared by solid-state reaction at room temperature,then Nanocrystalline Fe2O3were obtained by calcining the precursor.The effects of Tween-80 content,calcining temperature and time on the products were investigated.The product nanopowders were characterized by X-ray diffraction (XRD).The experimental results indicated that the product is Nanocrystalline α-Fe2O3.By using Tween-80,the yield of Nanocrystalline α-Fe2O3increased and the particle size of the product decreased.The particle size of the product nanocrystalline α-Fe2O3depends on calcining temperature and time.Nanocrystalline α-Fe2O3with 21nm in the size is obtained by calcining the precursor at 500℃ for 2h.
solid-state reaction;nanocrystalline iron oxide;α-Fe2O3
2013-08-09
李锋(1974—),男,讲师,研究方向:纳米材料.
1003-1251(2014)01-0032-04
O614.8
A
马金发)

