化学沉淀法去除废水中高浓度氨氮研究*
宋玮华 尹冬俏 刘邵博
(吉林建筑大学城建学院,长春 130111)
水环境中氮主要以氨氮形式存在,是水体的主要污染物质之一,也是引起水体富营养化的主要原因之一.目前我国大部分受污染水域中,氨氮都是主要污染物.由氨氮值过高导致的污染,已经使农业、渔业及旅游产业产生巨大的影响,甚至饮水卫生安全和食品安全也面临着巨大的威胁.高浓度氨氮还抑制微生物活性,限制了后续生物处理.
从废水处理的应用技术上,针对氨氮废水的处理技术有:活性炭吸附[1]、沸石吸附[2]、空气碱性吹脱法、生物脱氮法[3-4]等.上述方法因受到种种因素的限制,在实际工程应用中都有其各自适用范围和局限性.
基于水体系中的NH4+,PO43-及Mg2+可化合生成MgNH4PO4沉淀,从而可同时除去水体中的氨氮和磷酸盐,研究者们把这种通过沉淀同时除去废水中高浓度氨氮和高浓度磷酸盐的方法称作磷酸铵镁(MAP)技术[5].MAP技术应用广泛,可用于处理高浓度氨氮废水、磷酸盐废水或同时含有高浓度氨氮和高浓度磷酸盐的废水.通过该技术除去废水中的氨氮或磷酸盐生成的沉淀几乎不吸收重金属,再利用时不会对农作物造成危害,可作为一种优质高效的缓释肥料.与传统加碱后进行吹脱的处理方法相比,此法氨氮处理效率高,与生化处理相比,不受水温及水中限制生物活性的影响,设计、运行简单,无二次污染物产生,且不会对后续生物处理造成影响.
1 实验材料与方法
1.1 实验材料
实验采用仪器主要有:烧杯若干、控温磁力搅拌器、pH计、751紫外-可见分光光度计、电子分析天平等.
实验采用的主要药品包括MgCl2·6H2O,KH2PO4,98%H2SO4,NaOH等,均为分析纯试剂.
原水采用实验室模拟高浓度氨氮废水,以(NH4)2SO4配置.原水NH3-N浓度测得为1 981mg/L.
实验参数分析方法:纳氏试剂比色法.
1.2 实验方法
在室温条件下向盛有200mL高浓度氨氮溶液的烧杯中,按照不同物质的量比(摩尔比)投加MgCl2·6H2O和KH2PO4,反应进行后,测定反应过程中pH值,由读数不再变化可判断反应达到平衡,静置10min,使生成的结晶沉淀充分下沉,取上清液测定其吸光度值.以不同pH值条件下进行此反应,分别测定反应沉淀后上清液中NH3-N浓度.
2 结果与讨论
2.1 pH值对氨氮去除的影响
MAP的形成机理如下:
Mg2++HPO42-+NH4++6H2O→MgNH4PO4·6H2O↓+H+
(1)
Mg2++PO43-+NH4++6H2O→MgNH4PO4·6H2O↓
(2)
Mg2++H2PO4-+NH4++6H2O→MgNH4PO4·6H2O↓+2H+
(3)
当溶液中反应物Mg2+,NH4+和PO43-的活度之积大于MAP的溶度积(25℃下Ksp=2.5×10-13)时,反应正向进行,即向沉淀生成的方向进行.离子强度、温度和水中杂质都会影响对上述3种离子活度,从而影响沉淀过程与沉淀物品质[6].

图1 pH值对NH3-N去除率的影响
设定三种离子的量的比值为Mg2+∶NH4+∶PO43-=1.5∶1∶1.5的条件下,考察pH值对NH3-N去除率的影响.结果如图1所示.
由图1所示,pH值的升高NH3-N去除率逐渐增大,当pH值为8时,NH3-N去除率可达到95%,但pH>10以后,NH3-N去除率又有所下降.根据化学反应平衡方程,H+浓度增大,反应逆向方向进行;H+浓度减小,反应正向进行.在中、强碱体系中,Mg2+和OH-生成Mg(OH)2沉淀(Ksp=1.8×10-11),使原水中Mg2+的浓度大幅度降低,反应物的减少使之不利于生成MAP沉淀,不利于NH3-N的去除,会出现NH3-N去除率有所下降的现象.而当pH值上升到更高的10~11之间时,固定氨会从沉淀MgNH4PO4中游离出来,生成更难溶的Mg3(PO4)2(Ksp=9.8×10-25).
因此从处理效果和对后续处理反应条件要求上考虑,MAP法回收废水中NH3-N的适宜pH值为8~10之间.根据废水的性质选取pH在8~9之间最为适宜.
2.2 反应物配比对去除NH3-N的影响
根据沉淀的形成原理,理论上Mg2+∶NH4+∶PO43-三者之间的摩尔比为1∶1∶1,本试验中选取Mg2+∶NH4+∶PO43-三者间的比值如表1所示.
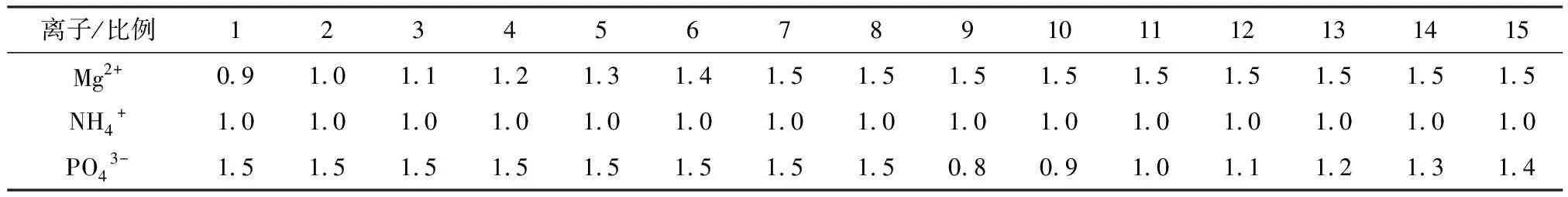
表1 各离子摩尔比

图2 不同离子摩尔比对NH3-N去除的影响
调节废水pH值为8,改变Mg2+∶NH4+∶PO43-的比例(摩尔比),探讨改变摩尔比对NH3-N去除率的影响.结果由图2所示,随着三者摩尔比的增加,NH3-N的去除率不断升高.结果表明,随着Mg2+和PO43-投加量增加,沉淀量不断增大,从而降低了体系中NH3-N的浓度.当三者的摩尔比达到Mg2+∶NH4+∶PO43-=1.5∶1∶1.5时,NH3-N的去除率高达95%,而当三者比值Mg2+∶NH4+∶PO43-达到2∶1∶2时,NH3-N的去除率为95.3%,与前面结果相比变化不明显.考虑到后续处理的条件要求,尤其是生化处理,过低的NH3-N浓度会引起C/N比值偏高,对生物处理有一定的限制.同时,考虑到经济造价,适宜的Mg2+∶NH4+∶PO43-的摩尔比为1.5∶1∶1.5.
2.3 反应时间对氨氮去除率的影响
Bonurophoulos等[7]研究表明,晶体的生成与反应物浓度有关,而与反应时间无关.反应时间对NH3-N去除率的影响很小.在原水pH值为8,反应物三者比值Mg2+∶NH4+∶PO43-为1.5∶1∶1.5的条件下,考察了反应时间对废水中NH3-N去除率的影响.实验数据表明,随着反应的进行,NH3-N去除率逐渐升高,当反应至20min时,NH3-N去除率达到最高值,但当反应时间超过20min以后,NH3-N去除率的变化并不明显.反应初期,由于反应物NH3-N浓度高反应正向进行,NH3-N去除效果明显,随着反应物NH3-N浓度的降低,NH3-N去除率呈现下降的趋势.从沉淀理论上来讲,主要是由于随着反应的进行,生成的沉淀增加,减少了反应物之间接触的机率,且沉淀吸附了部分氨氮,使反应物浓度减少,从而破坏了MAP的沉淀体系,使体系中NH3-N浓度有上升的趋势.因此,反应时间也不宜过长,选择最适宜反应时间为20min.
2.4 工艺经济分析
MAP沉淀性能好,在沉淀过程中极易实现固液分离,且对重金属无吸收,对有机物吸附作用较小,对环境影响小,是一种高效肥料,可改善土壤性能、增产增收.理论上,采用沉淀法处理NH3-N废水回收氨氮,按照化学反应机理,投加1.71kg镁、2.21kg磷,在适宜的酸碱条件下可回收1kg氨氮,生成7.59kg MAP沉淀[8].使用磷酸二氢钾和氯化镁作为反应沉淀剂,则分别需要9.71kg和6.79kg,生成17.5kg MAP沉淀.其市场售价分别为5 200元/t和550元/t,则每1Kg氨氮的处理成本约为54.22元.MAP可作缓释肥,市场理论价格约为198美元/t~330美元/t.因此,生成的MAP沉淀可产生一定的经济效益[9].
3 结论
(1) 采用MAP结晶沉淀法去除废水中NH3-N,有较好的处理效果.实验条件设定为pH=8,Mg2+∶NH4+∶PO43-=1.5∶1∶1.5,搅拌反应时间为20min,废水中氨氮浓度可由初始1 981mg/L沉淀降低到5mg/L,去除率达95%,大幅度降低了原污水中的氨氮浓度,为后续生物处理创造了有利的条件.
(2) 鉴于经济成本考虑和后续处理条件要求,沉淀法回收污水中NH3-N的pH值定为8~10之间.pH<7时,反应向逆反应方向进行,不利于生成沉淀;pH>10时,即在强碱性环境中,晶体结构遭到破坏,会导致固定氨从MAP中游离出来,生成更难溶的磷酸镁沉淀,从而降低了NH3-N去除率.
(3) MAP沉淀法有效回收了NH3-N,生成的MAP结晶体对重金属和有机物无吸附,重金属含量远低于《农用污泥中污染物控制标准》(GB 4284-1984)中的限值;同时,结晶中富含氮、磷2种营养元素,有极高的回收价值.
参 考 文 献
[1] El-Nabarawy Th,Fagal G A,Khalil L B.Removal of ammonia from aqueous solution using activated carbons[J].Adsorption .Science and Technology,1996,13(1):7-13.
[2] 张 曦,吴为中,温东辉.氨氮在天然沸石上的吸附与解吸[J].环境化学,2003,22(2):16-171.
[3] 陈 红,李昊翔.强化序批式活性污泥工艺脱氮除磷的实验研究[J].浙江大学学报(工学版),2004,38(9):1235-1238.
[4] Obaja D,Mace S,Mata-Alvarez J.Biological nutrient removal by a sequencing batch reactor(SBR)using an internal organic carbon source in digested piggery wastewater[J].Bioresource technology,2005,96(1):7-14.
[5] 汤 琪,罗固源.磷酸铵镁技术的应用研究[J].水处理技术,2007,3(3):1-5.
[6] 姚 涛,蔡伟民,李龙海.磷酸胺镁法处理含氮磷废水的研究进展[J].中国给水排水,2005, 21(2): 31-33.
[7] 霍守亮,席北斗,刘鸿亮,宋永会,何连生.磷酸铵镁沉淀法去除与回收废水中氮磷的应用研究进展[J].化工进展,2007, 26(3):371-376.
[8] 徐 远,蒋京东,马三剑,刘 峰.鸟粪石结晶沉淀法处理氨氮废水的应用研究[J].污染防治技术,2006,19(6): 26-30.
[9] 仝武刚,王继徽.磷酸铵镁除磷脱氮技术[J].工业用水与废水,2002,33(5):4-6.

