KRAS基因遗传变异对结直肠癌患者预后评估的价值
刘学伟 程龙伟 柴淑梅 李 泽
(吉林省肿瘤医院结直肠外科,吉林 长春 130012)
结直肠癌是十分常见的恶性肿瘤,其发生发展、侵袭转移及预后已经被证明是多种癌基因、抑癌基因及错配修复基因突变共同参与调控的结果。表皮生长因子受体(EGFR)信号通路在结直肠癌发生及进展中起到至关重要的作用。KRAS基因属于Ras原癌基因家族中的一员,KRAS基因突变以点突变为主,90%多集中于12、13密码子,且12密码子的突变率高于13密码子〔1〕。研究发现转移性结直肠癌KRAS基因野生型患者可在接受西妥昔单抗治疗中受益,因此研究KRAS基因突变为结直肠癌的预后及治疗提供了参考依据。目前关于结直肠癌KRAS基因突变的报道较少,本研究应用PCR-SSCP方法检测78例结直肠癌患者KRAS基因突变表达谱情况与临床病理因素及预后之间的相关性。
1 资料与方法
1.1组织标本 78例石蜡包埋组织标本取自吉林省肿瘤医院,患者手术时间为2008年1月至2010年8月,其中男43例,女35例;年龄60~87〔平均(54±6)〕岁。术前均未行放化疗,术后根据国际抗癌联盟(UICC)制定第7版肿瘤TNM分期进行术后分期,并明确病理诊断。患者年龄、性别、一般状况无明显差异。组织标本采集获得我院伦理委员会批准研究。78例患者由肿瘤研究委员会追踪随访至2011年7月。
1.2方法 样本DNA的提取:选择经苏木素-伊红(HE)染色证实存在癌组织并占60%以上的蜡块,切取3张10 μm厚组织,装入1.5 ml已消毒离心管,常规脱蜡处理后,加入蛋白酶K至终浓度1 mg/ml,十二烷基硫酸钠(SDS)至2%。孵育24~36 h后,离心处理(15 000 r/min,15 min,4℃)。抽取石蜡层下的液体。按照QIAamp DNA FFPF Kit试剂盒(Qiagen公司)步骤提取石蜡组织DNA,最后以30 μl洗脱液洗脱DNA,DNA产物用紫外分光光度计检测DNA浓度,调节到100 μg/ml,-20℃保存备用。
KRAS基因的PCR扩增及测序:根据Jhawer等〔2〕文献所述,选择扩增12/13号密码子所需特异性引物,引物序列为:5':AGGCCTGCTGAAAATGACTGAATA-3'(正义);5':CTGTATCAAAGAATGGTCCTGCAC-3 '(反义)。PCR反应体系50 μl,包含2 μl模版DNA,10 μmol/L正、反各1 μl,25 μl Premix(含1.5 U TaKaRa Taq;10×PCR Buffer,3.0 mmol/L Mg2+;0.4 mmol/L dNTP Mix),引物及Premix PCR检测试剂盒均购自宝生物工程(大连)有限公司。
PCR 反应条件:94℃ 5 min,94℃ 30 s,60℃ 30 s,72℃ 40 s,循环30次,循环结束4℃保持,PCR产物用1.5%琼脂糖凝胶电泳,凝胶成像分析系统观察和分析结果。选取PCR阳性DNA凝胶条带作为目的片段,采用QIAquick PCR Purification Kit 对PCR产物进行回收(Qiagen公司产品),后送上海基因技术有限公司测序。
1.3统计学方法 应用SPSS19.0软件行χ2检验Kaplan-Meier生存曲线评价KRAS基因突变与患者生存期的关系,显著性检验采用Log-rank检验分析,Cox回归模型进行多变量生存分析。
2 结 果
2.1KRAS基因突变结果 78例结直肠癌患者中,KRAS基因突变26例(33.3%)。KRAS基因12号密码子突变19例(73.1%);13号密码子突变7例(26.9%)。KRAS基因突变均为单个碱基的点突变,未检测出两个或以上的碱基突变或其他形式的突变(图1)。其中G-A突变发生频率最高,共20例(76.9%);其次G-T突变5例(19.2%);G-C突变仅1例(3.9%)。KRAS基因12号密码子突变19例,共有3种不同突变方式:GGT-GAT突变13例(50%),导致甘氨酸Gly替换为天冬氨酸Asp;GGT-GTT突变5例(19.2%),导致甘氨酸Gly替换为缬氨酸Val;GGT-GCT突变1例(13.9%),导致甘氨酸Gly替换为丙氨酸Ala。13号密码子突变7例(26.9%),均为GGC-GAC突变,导致甘氨酸Gly替换为天冬氨酸Asp。在氨基酸替换中,Gly替换为Asp发生频率最高,占76.9%(20/26);其次Gly替换为Val占19.2%(5/26);Gly替换为Ala发生频率最低,仅占3.8%(1/26)。
2.2KRAS基因突变表达谱与临床病理因素的关系 KRAS基因突变与结直肠癌分化程度、肝转移具有统计学意义(P<0.05)。KRAS基因突变与其他病理学参数如性别、年龄、肿瘤大体类型、肿瘤原发部位、淋巴结转移、TNM分期均无统计学意义(P>0.05)。78例患者追踪随访发现,KRAS基因野生型患者平均生存时间35.05个月,突变型患者是25.72个月,有统计学意义,(χ2=5.13,P= 0.023)。KRAS基因12号密码子突变患者平均生存时间是25.69个月,13号密码子突变患者是20.67个月,两组无统计学意义(P>0.05)。单变量分析显示KRAS基因突变与结直肠癌患者预后不良关系密切(P=0.023),多变量分析显示肝脏转移、KRAS基因突变、肿瘤低分化是预后的独立危险因素(P=0.001,0.007,0.026)。见表1,图2。

a.KRAS基因12、13密码子野生型基因序列;b.KRAS基因12密码子GGT→GAT突变;c.KRAS基因12密码子GGT→GTT突变;d.KRAS基因13密码子GGC→GAC突变
表1KRAS基因突变表达与结直肠癌临床病理学因素的关系〔n(%)〕

临床病理因素n野生型突变型χ2值P值性别 男4326(60.5)17(39.5)1.66>0.05 女3526(74.3)9(25.7)年龄(岁) ≤603828(73.7)10(26.3)1.64>0.05 >604024(60.0)16(40.0)大体类型 隆起型1712(70.6)5(29.4)0.15>0.05 溃疡型6140(65.6)21(34.4)部位 右半结肠209(45.0)11(55.0)5.72>0.05 左半结肠1813(72.2)5(27.8) 直肠4030(75.0)10(25.0)分化程度 中分化5943(55.8)16(27.1)4.21<0.05 低分化199(47.7)10(52.6)淋巴结转移 有5035(70.0)15(30.0)0.7>0.05 无2817(60.7)11(39.3)肝转移 无4836(75.0)12(25.0)3.90<0.05 有3016(53.3)14(46.7)TNM Ⅰ+Ⅱ3828(75.0)10(25.0)1.642>0.05 Ⅲ+Ⅳ4024(53.3)16(46.7)
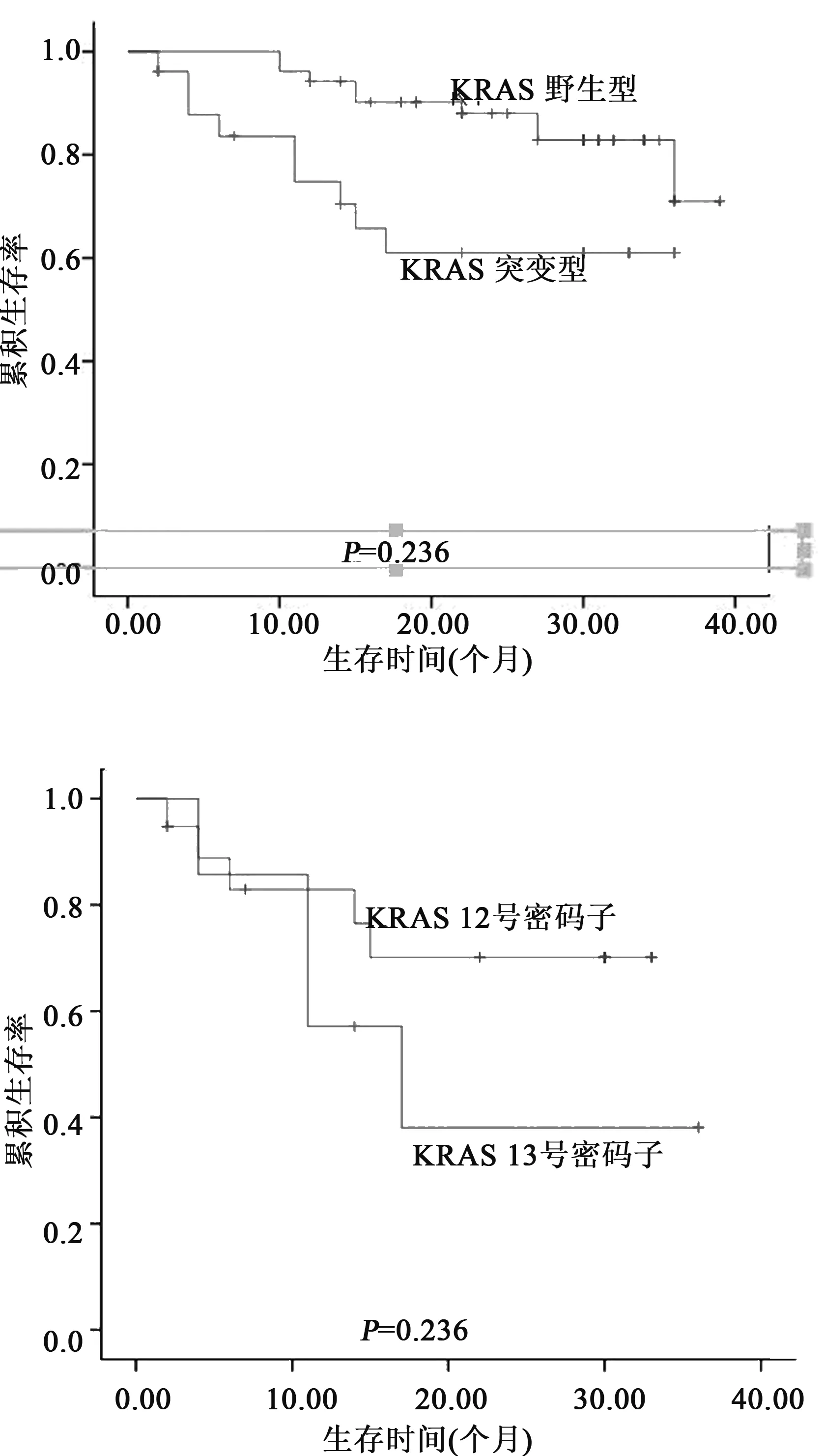
图2 78例大肠癌患者KRAS基因野生型与突变型的Kaplan-Meier生存曲线
2.3患者多因素的COX模型分析与预后相关独立危险因素 见表2。

表2 78例大肠癌患者的多因素COX模型分析与预后相关的独立危险因素
3 讨 论
KRAS基因在结直肠癌患者突变率发生较高,本研究中KRAS基因突变率、特点的结果符合目前各研究机构所报道KRAS基因突变的一般情况〔3,4〕。结直肠癌发生是多步骤过程,从肠道黏膜增生到良性腺瘤最后到结直肠癌的恶性转变都与KRAS基因突变有关,因此KRAS基因突变被认为是结直肠癌发生的启动因子,尤其是G-A碱基突变被认为在结直肠癌发生中起到重要作用。本研究发现G-A突变频率发生最高,这说明G-A突变是KRAS基因突变中的普遍现象。
目前对KRAS基因突变表达谱与结直肠癌临床病理因素关系的报道不尽相同。有研究称KRAS基因突变与结直肠癌患者年龄、性别、肿瘤分化程度、TNM分期等病理学因素无任何关系〔5〕。不同研究机构发现KRAS基因突变与某些临床病理因素之间存在联系〔6,7〕。Yunxia等〔8〕发现结直肠肿瘤分化程度可能与KRAS基因突变存在潜在的关系,本研究结果高于2008年ASCO会议上报道转移性结直肠癌患者35% 的KRAS 基因突变率。这可能由于本研究中样本量受限所致或是本研究中只包括结直肠癌肝脏转移,而没有包括结直肠癌肺转移或者其他远处转移的患者。结直肠癌分化程度差,恶性程度高,转移能力强,KRAS基因突变发生可能性越高,但仍需要大样本临床数据来证实中国人结直肠癌患者的KRAS基因突变情况。
关于KRAS基因突变与结直肠癌的预后,仍然存在不同观点。研究发现Dukes C期结直肠癌患者12号密码子Gly突变为Val预后差、13号密码子G突变为A,预后差,生存期短〔9〕。KRAS基因野生型可受上游EGFR信号通路的调控,KRAS基因发生点突变时,该基因编码P21蛋白的空间结构发生变化,不受上游EGFR信号影响。KRAS基因突变亚型不同,可能导致该基因空间构象不同,调节细胞内信号通路不同,对化疗药物的结合位点存在差异,这就可能导致不同突变亚型对化疗药物敏感性不同,而造成预后生存期明显不同。
综上所述,中国结直肠癌患者的KRAS基因突变率符合目前国际各研究机构的报道。KRAS基因的遗传变异在结直肠癌的发生、进展中起重要作用。分析KRAS基因不同亚型突变表达谱有助于评估结直肠癌患者预后。
4 参考文献
1Kislitsin D, Lerner A, Rennert G,etal.Kiras mutations in sporadic colorectal tumors in lsrael: unusual high frequency of codon 13 mutations and evidence for nonhomogeneous representation of mutation subtypes〔J〕.Dig Dis Sci,2002;47(5):1073-9.
2Jhawer M, Goel S, Wilson AJ,etal.PIK3CA mutation/PTEN expression status predicts response of colon cancer cells to the epidermal growth factor receptor inhibitor cetuximab〔J〕.Cancer Res, 2008;68(6):1953-61.
3Lee WS,Baek JH,Lee JN,etal.Mutations in Kiras and epidermal growth factor receptor expression in korean patients with stages Ⅲ and Ⅳ colorectal cancer〔J〕.Int J Surg Pathol,2011;19(2):145-51.
4Jeon CH, Lee HI, Shin IH,etal.Genetic alterations of APC, Kiras,p53, MSI, and MAGE in Korean colorectal cancer patients〔J〕.Int J Colorectal Dis,2008;23(1):29-35.
5Zlobec I, Bihl MP,Schwarb H,etal.Clinicopathological and protein characterization of BRAF- and Kiras-mutated colorectal cancer and implications for prognosis〔J〕.Int J Cancer,2010;127(2):367-80.
6Naguib A, Mitrou PN, Rodwell SA,etal.Dietary, lifestyle and clinicopathological factors associated with BRAF and Kiras mutations arising in distinct subsets of colorectal cancers in the EPIC Norfolk study〔J〕.BMC Cancer,2010;10(1): 99.
7Shen H,Yuan Y,Zheng S.Clinical significance of Kiras and BRAF mutations in Chinese colorectal cancer patients〔J〕.World J Gastroenterol,2011;17(6):809-16.
8Yunxia Z, Jun C, Jin L,etal.Mutations in epidermal growth factor receptor and Kiras in Chinese patients with colorectal cancer〔J〕.BMC Med Genet,2010;11(1):34.
9Andreyev HJ, Norman AR, Urosevic N,etal.Kirsten ras mutations in patients with colorectal cancer: the ‘RASCAL Ⅱ’ study〔J〕.Br J Cancer,2001;85(5):692-6.

