房颤大鼠心房肌组织结构及KV1.5蛋白和 mRNA表达的变化
丁绍祥 柳 茵 刘维军 李 琳
(青海大学医学院,青海 西宁 810000)
心房颤动(AF)是最常见的持续性室上性心律失常,随年龄增大其发病率逐渐增加〔1〕。目前我国人群的平均患病率为0.77%,随老年人口数量的增多,患病率有增加的趋势〔2〕。AF时不仅有心房结构重构,也有心肌电重构,因此,研究AF时心房肌细胞膜上离子通道的改变对揭示AF的发生机制及治疗无疑有重要意义〔3〕。超速延迟整流钾通道(Kur)在人类仅存在于心房肌,是重要的复极电流〔4〕。它在-30 mV时激活,激活时间常数为2~18 ms(25℃),快通道开放时间约50 ms,因此,主要作用在心房肌细胞平台期,使2相动作电位时程(APD)缩短,并缩短心房有效不应期(AERP)。然而,在人类慢性AF研究中发现IKur明显减少,由其所致的动作电位时程的延长无法终止心AF动,引起人们对AF治疗的思考〔5〕。大鼠AF时IKur蛋白密度改变目前意见尚不一致,其改变是促进AF抑或抑制AF尚未见相关明确报道。在目前 “AF促AF”的理论中,心房肌细胞膜离子通道电重构的表达尚存在较大争议。大鼠AF时IKur的改变及心房结构的改变以及二者之间的关系将有助于人们对AF发病机制的认识,并促进人们对AF发病机制的进一步研究。
1 材料与方法
1.1材料 SD大鼠由兰州大学动物实验中心提供,动物合格证号:SCXK(甘)2008-0012;引物合成(上海捷瑞:KV1.5-正义链5'-GCTTCATCAAGGAAGAGGAGAA-3',KV1.5-反义链5'-CACGAGCAACTCAAAAGTGAA C-3',371 bp;β-actin-正义链 5'-CGTGCGTGACATTAAAGAGAAG-3',β-actin-反义链5'-GGCATAGAGGTCTTTACGGATG-3',262 bp);RT-PCR试剂盒(北京天根);KV1.5多克隆抗体(一抗,山羊抗鼠,美国Santa Cruz);兔抗山羊多克隆抗体(二抗,北京中杉金桥);生物心电图记录仪(澳大利亚ML818);生物组织自动脱水机(湖北亚光ZT-12P);PCR扩增仪(德国 Biometra);石蜡包埋机(德国LEICA EG1150H);IMAGE-PRO plus 6.0软件(美国Media Cybernetics);Quantity one v4.62 software(Bio-Rad 图像分析软件)。实验次日因麻醉意外致对照组雄1号和雌4号死亡;AF组雄性大鼠12号于实验第6天尾静脉注射药物后数分钟内死亡。
1.2方法
1.2.1AF大鼠造模 用20%乌拉坦按0.8 ml/100 g体重腹腔注射进行麻醉,行心电图检查并记录。实验组按0.1 ml/100 g体重于尾静脉注射混合药物(CaCl210 mg/ml,Ach 66 μg/ml),1次/d,共1 w。1 w后用相同的方法对所有大鼠进行麻醉后注射药物,同时分别再次行心电图检查并记录;对照组按同样的方法和剂量注射生理盐水并按同样的方法行心电图检查并记录。
1.2.2逆转录聚合酶链式反应 1 w后处死大鼠,取适量左心房组织提取总RNA后用紫外光分光光度计测定其含量和纯度并行电泳质量检测。严格按说明操作;剩余心房组织备制切片及免疫组化分析。合成cDNA后用已设计的引物扩增相应目的基因片段。琼脂糖凝胶电泳检测目的基因片段并绘好区带电泳图,使用Bio-Rad图像分析软件,对目的基因和内参基因的扩增条带进行灰度扫描所得灰度值(即光强度),减去所定义的背景灰度值,得到各条带的灰度值,再经内参矫正后,得一相对比值,记录后用统计学软件处理。
1.2.3病理切片和免疫组化 从20%甲醛浸泡液中取小块心房组织,置全自动脱水机自动处理后行石蜡包埋,将蜡包埋的心房肌组织按3 μm厚度切片,每一标本组织切6片,行免疫组化染色及病理切片制作。
1.3统计学方法 采用SPSS17.0软件行t检验。
2 结 果
2.1心电图检查结果 对照组大鼠尾静脉注射生理盐水前后心电图无明显变化:P波明显,基线稳定,R-R间期匀齐(见图1)。实验组大鼠于尾静脉注射药物后即刻出现房颤:P波消失,出现形态大小不一的小“f”波,R-R间期不等(见图2)。
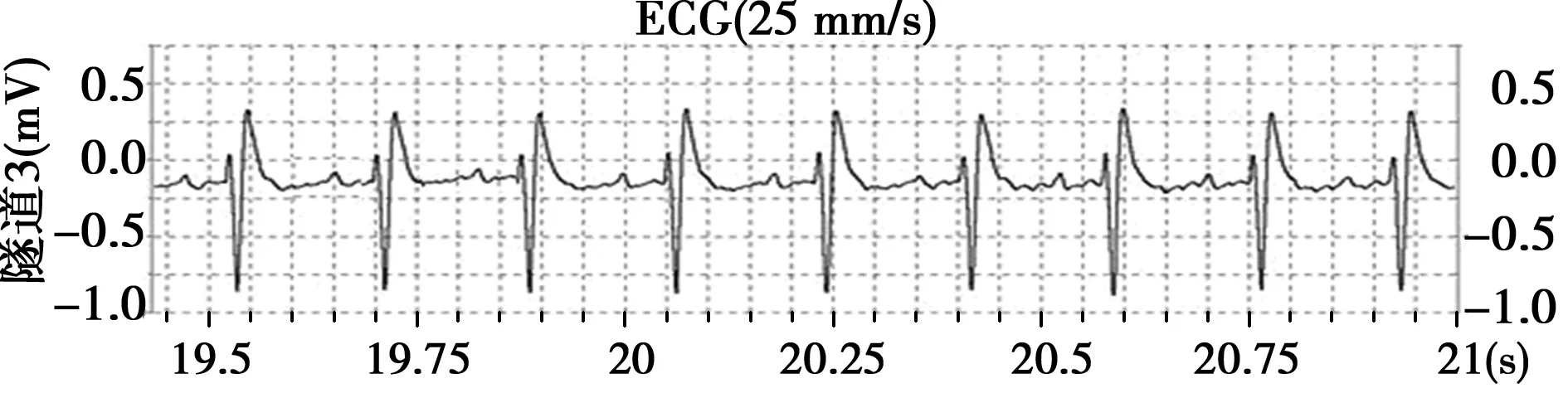
图1 正常大鼠心电图
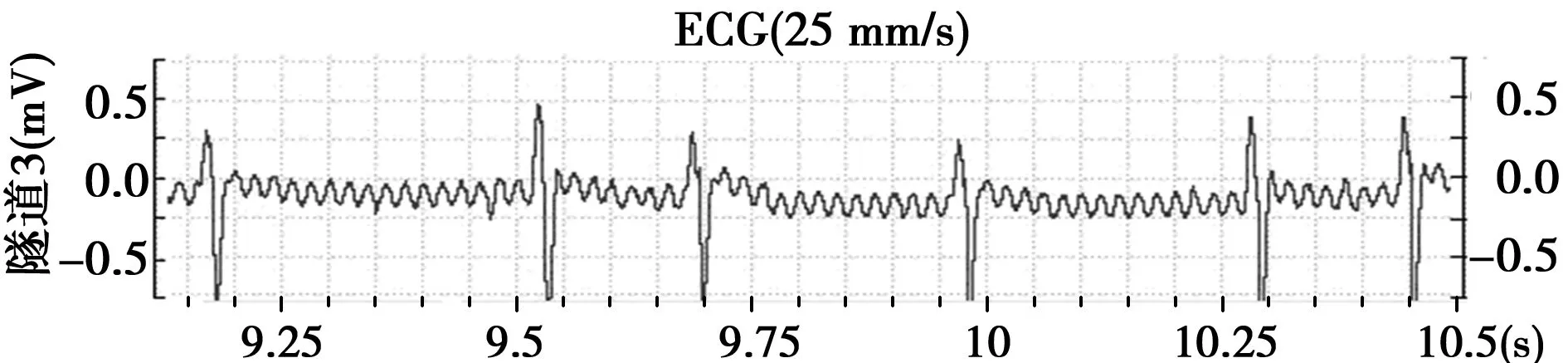
图2 大鼠AF时心电图
2.2大鼠心房肌组织KV1.5 mRNA表达 对照组:0.848±0.036;AF组:0.613±0.040。两组差异显著(t=13.777,P<0.01)。
2.3大鼠心房肌组织KV1.5蛋白表达 所有免疫组化切片平均光密度值,对照组:0.110 9±0.003 3,AF组:0.090 5±0.004 8。两组差异显著(t=10.626,P<0.01)。
2.4大鼠心房组织切片染色结果 对照组大鼠心房组织标本切片镜检显示:心外膜不厚,心肌纤维清晰,无肌凝、肌溶,心肌细胞间质间隙略增宽,心内膜未见异常。AF大鼠心房组织标本切片镜检显示:心肌出现不同程度的心肌断裂、肌溶、细胞肥大、炎性细胞浸润、灶性坏死、纤维组织增生等病理性改变。见图3。
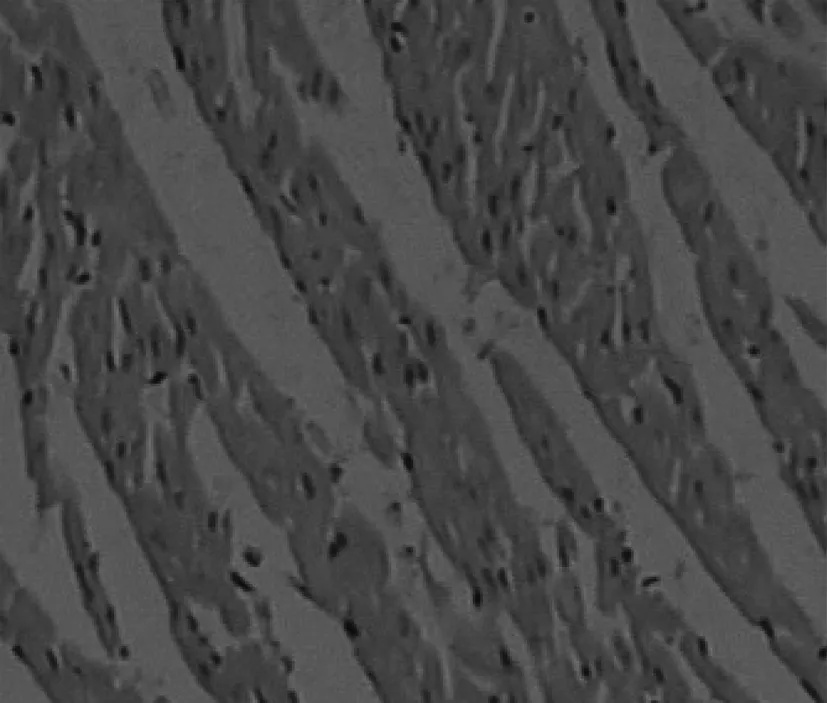
对照组

AF组
3 讨 论
近年来,人们认识到心房电重构和结构重构是AF发生和维持的重要基础〔6〕。前者是指与生理条件比较,相应离子通道的数目表现为上调或下降,而离子通道的结构和功能并不发生明显的改变;后者是指心肌间质组织增生或纤维化增多,细胞膜稳定性下降,部分细胞器的结构、形态及数量出现改变。AF时,心房肌离子通道出现电重构,使心房肌动作电位时程缩短,兴奋频率增加,但各离子通道在此过程中的变化并不一致〔7〕。在目前AF的发病机制尚未完全明确的情况下,各离子通道的变化与AF发生及维持的关系无疑是研究的重点〔8〕。
本实验大鼠AF模型,其电生理学的病理变化与临床AF相似,适用于化合物抗AF活性筛选研究〔9〕。实验发现,AF组大鼠KV1.5 mRNA及相应蛋白的表达均较对照组减低,且有统计学意义,提示AF时其表达下调延长心房肌APD。同样,在人类慢性AF研究时发现,其表达明显下降,延长AERP〔10〕,说明这种变化是抑制AF折返形成。而心房肌1相离子流Ito和主要2相离子流IKr、IKs于慢性AF时也明显下降,使AERP延长,均不利于AF折返的形成〔11〕;IK1、IKAch主要在3相,对AF的发生和维持有双重作用:它虽能缩短心肌动作电位时程,但也同时增大心肌的舒张电位,使心肌的兴奋性减低,也不利于AF的形成。因此,AF时心房电重构是抑制AF的形成抑或促进AF的形成尚需进一步研究。而从AF时各离子通道总体变化分析,各离子通道的变化可能并非为适应AF而改变,相反,更可能是机体的一种代偿机制以抑制AF形成,只是抑制心律失常在某种程度上也能导致心律失常,它取决于脏器受累的病变程度及机体自身的代偿范围。
脏器结构决定并反映其功能,脏器功能虽能诱导其结构改变,但受制于脏器的结构特征,因此,AF时心房肌电重构是继发于心房结构重构〔12〕。本实验中,AF大鼠心房肌组织均出现不同程度的结构重构,而对存在较多移行区域的心肌组织,其结构重构无疑将进一步加重心房除复极的非同步性,诱导心肌电紊乱〔13〕。研究表明,慢性AF也多合并心脏器质性病变〔14〕。
AF本身是心房肌心肌电的紊乱,若其心肌电重构是促进AF形成,也就是说,AF时心肌电紊乱促进心肌电进一步紊乱以适应AF,则从AF发生起,在没有外界因素干预下,AF不可能自行停止,这相当于机体的正反馈机制。而AF电重构是可逆的〔15〕,说明这种心肌电自身促进机制本身就与事实不太相符。与实验现象最可能的解释是:人工诱发的AF造成心房肌组织损伤,损伤的心房肌组织利于AF的发生和维持,这也是动物AF造模时多次反复予以刺激后AF易于发生并趋于稳定的原因所在,本文实验也不例外:即心肌电紊乱是继发于人工刺激或心房肌组织损伤后的改变,AF的逆转与心房的被动刺激消除和心房肌受损的可逆性有关。因此,AF促AF的本质是心房肌心肌电紊乱诱发AF所启动的损伤因素进一步加重心房组织结构的损伤,若机体不能逆转其损伤效应,则减低心房自身代偿储备功能,反复发作致结构重构;心房结构重构又诱导心肌电的紊乱,导致持续性或永久性AF。因此,AF促AF只是其结构重构促进AF的发生和维持,而心肌电重构更多的是抑制AF、回归生理功能的需求。
因本研究均为半定量表达,反映相应指标的总体趋势,难免有不足,需更为精确实验检测。
4 参考文献
1Olesen JB,Lip GY,Lane DA.An epidemic of atrial fibrillation〔J〕? Europace,2011;3(8):1059-60.
2黄从新,张 澍,马长生,等.心房颤动:目前的认识和治疗建议—2012〔J〕.中华心律失常学杂志,2012;6(4):346-89.
3Camm AJ,Al-Khatib SM,Calkins H,etal.A proposal for new clinical concepts in the management of atrial fibrillation〔J〕.Am Heart J,2012;164(3):292-302.
4Ravens U,Wettwer E.Ultra-rapid delayed rectifier channels:molecular basis and therapeutic implications〔J〕.Cardiovasc Res,2011;89(4):776- 85.
5Almquist J,Wallman M,Jacobson I,etal.Modeling the effect of Kv1.5 block on the canine action potential〔J〕.Biophys J,2010;99(9):2726-36.
6Xu Y,Sharma D,Li G,etal.Atrial remodeling:new pathophysiological mechanism of atrial fibrillation〔J〕.Med Hypotheses,2013;80(1):53-6.
7Caballero R,de la Fuente MG,Gómez R,etal.In humans,chronic atrial fibrillation decreases the transient outward current and ultrarapid component of the delayed rectifier current differentially on each atria and increases the slow component of the delayed rectifier current in both〔J〕.Am Coll Cardiol,2010;55(21):2346-54.
8Grunnet M,Bentzen BH Sorensen US,etal.Cardiac ion channels and mechanisms for protection against atrial fibrillation〔J〕.Rev Physiol Biochem Pharmacol,2012;(162):1-58.
9陈春林,巩甜甜,汤依群,等.SD大鼠房颤模型的建立〔J〕.动物实验科学,2009;26(3):1-4.
10Nattel S,Maguy A,Le Bouter S,etal. Arrhythmogenic ion-channel remodeling in the heart:heart failure,myocardial infarction,and atrial fibrillation〔J〕.Physiol Rev,2007;87(2):425- 6.
11Oh S,Kim KB,Ahn H,etal.Remodeling of ion channel expression in patients with chronic atrial fibrillation and mitral valvular heart disease〔J〕.Korean J Intern Med,2010;25(4):377-85.
12Chimenti C,Russo MA,Carpi A,etal.Histological substrate of human atrial fibrillation〔J〕.Biomed Pharmacother,2010;64(3):177-83.
13丁绍祥.J波和2相折返形成离子流机制研究进展〔J〕.中国老年学杂志,2012;32(12):2676-8.
14Lardizabal JA,Deedwania PC.Atrial fibrillation in heart failure〔J〕.Med Clin North Am,2012;96(5):987-1000.
15Pang H,Ronderos R,Pérez-Riera AR,etal.Reverse atrial electrical remodeling:a systematic review〔J〕.Cardiol J,2011;18(6):625-31.

