LY-294002对人宫颈癌细胞株Bcl-2表达的影响
董莹莹 李 威
(辽宁省妇幼保健院妇产科,辽宁 沈阳 110005)
磷脂酰肌醇3激酶(PI3K)是一种胞内磷脂酰肌醇激酶,它介导的下游多种信号转导通路的激活调节细胞的多种生理过程,包括细胞的增生、分化、凋亡。研究发现,PI3K/Akt参与了细胞的正常生理活性的调节,且只在细胞恶性转化时表达是增加的,其过度表达对肿瘤的发生发展起着至关重要的作用〔1~3〕,但是,在宫颈癌的病理过程中,PI3K/Akt能否通过调节Bcl-2的表达参与肿瘤细胞的凋亡过程尚不清楚,需进一步研究。本研究采用Western 印迹和RT-PCR方法,检测经不同浓度的PI3K抑制剂(LY-294002)处理的人宫颈癌细胞株的Bcl-2的表达变化,探讨PI3K在宫颈癌的病理作用机制。
1 材料与方法
1.1材料 人宫颈癌Hela细胞购自中国科学院细胞所;RPMI-1640培养基购自Gibco BRL公司;PI3K抑制剂LY294002购自碧云天生物技术研究所,分子量307.3;鼠抗人单克隆Bcl-2购于美国Santa Cruz公司。
1.2细胞培养 人宫颈癌Hela细胞置于37 ℃,饱和湿度,5%CO2恒温培养箱中常规消化传代。以含10%小牛血清、100 U/ml青霉素和100 U/ml链霉素的培养液RPMI-1640培养,根据细胞生长状态每2~3 d传代1次。取生长状态稳定,呈对数生长期细胞用于实验。
1.3实验分组 实验使用细胞均为接种24 h后处于对数生长期细胞,分为对照组和LY294002干预组,干预组再细分为4个亚组,分别以终浓度为 5、10、20、40 μmol/L 的PI3K抑制剂LY294002处理人宫颈癌Hela细胞,作用48 h。
1.4Western印迹方法检测各实验组Bcl-2蛋白的表达 用蛋白裂解液RIPA(50 mmol/L Tris-base、1.0 mmol/L EDTA、150 mmol/NaCl、 0.1%SDS、1%TritonX-100、1% Sodium deoxycholate)及蛋白酶抑制剂(USA)提取细胞蛋白,用考马斯亮蓝G250结合法,测定蛋白浓度,计算加样量。加入样品缓冲液,沸水浴中加热5 min使蛋白质变性,制备12%分离胶,4%浓缩胶,电泳,5%脱脂奶粉TTBS缓冲液4 ℃过夜。一抗鼠抗人单克隆Bcl-2、β-actin (1∶200) 室温孵育2 h,洗膜,辣根酶标记羊抗鼠IgG-HRP (1∶5 000)室温孵育2 h,洗膜后, ECL发光,暗室曝光显影,凝胶成像分析系统上摄像分析,计算出各组样品鼠抗人单克隆Bcl-2目标带的光密度值与内参照β-actin 光密度值的比值。
1.5RT-PCR方法检测各实验组Bcl-2 mRNA的表达 按照Trizol(Gibco,USA)剂盒说明书的操作步骤进行总mRNA提取,然后以逆转录(RT法)先合成cDNA,再进行PCR扩增;Bcl-2的上、下游引物分别为:上游5′-TGAGTTCGGTGGGGTCAT-3′;下游为:5′-GGAGAAATCAAACAGAGGC-3′,扩增产物全长187 bp。β-actin的上游引物:5′-GAGACCTTCAACACCCAGCC-3′;下游引物为:5′- GCGGGGCATCGGAACCGCTCA-3′,扩增产物全长374 bp。扩增产物进行1.5%琼脂糖电泳,UVP凝胶显像仪扫描并进行图像分析。以目的基因与β-actin光密度的比值代表目的基因的相对表达含量。
1.6统计学处理 采用SPSS13.0软件行方差分析。
2 结 果
2.1Western 印迹检测Bcl-2蛋白表达 对照组宫颈癌细胞株有大量的Bcl-2阳性表达(0.43),在以终浓度为 5 μmol/L的LY294002处理48 h后,宫颈癌细胞株的Bcl-2阳性表达迅速降低(0.32),与对照组相比差异显著(P<0.05),而且随着LY294002终浓度的升高,宫颈癌细胞株的Bcl-2阳性表达也随之降低(0.25,0.23,0.2)。见图1。

1~5:对照组、5、10、20、40 μmol/L LY294002干预组,下图同
2.2RT-PCR检测Bcl-2 mRNA表达 Bcl-2 mRNA在对照组宫颈癌细胞株即有大量的表达(0.8),与对照组相比在经终浓度为5 μmol/L的LY294002处理后,实验组宫颈癌细胞株的Bcl-2 mRNA的表达迅速降低(0.5,P<0.05),而且随着处理宫颈癌细胞株的抑制剂LY294002终浓度的升高,实验组宫颈癌细胞株的Bcl-2 mRNA的表达也随之降低(0.4,0.35,0.3)。见图2。
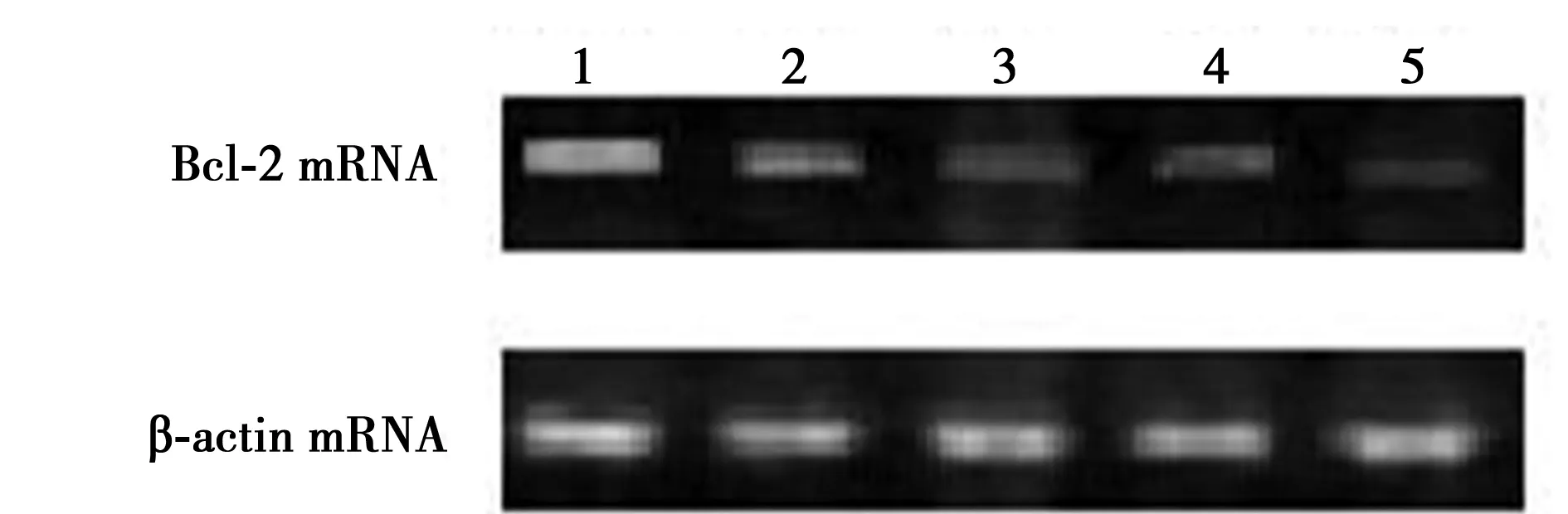
图2 RT-PCR检测Bcl-2 mRNA表达
3 讨 论
PI3K是由催化亚单位(p110)和调节亚单位(PIK3R1)组成的异源二聚体,PI3K负责下游作用底物磷酸磷脂酰肌醇肌醇环上的3'羟基进行磷酸化,从而使4,5-二磷酸磷脂酰肌醇转变为3,4,5-三磷酸磷脂酰肌醇,这是许多细胞外生长因子刺激的关键活化步骤。磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶B(P13K/Akt)信号转导通路广泛存在于细胞中,对细胞的生存起着至关重要的调节作用〔4〕。P13K/Akt信号转导通路通过以下几种机制发挥抗凋亡调节作用:①下调R-RAS信号通路,抑制细胞凋亡〔5〕;②Akt磷酸化凋亡前体蛋白BAD,抑制其促凋亡作用,并促进Bcl-2发挥抗凋亡作用③ARt通过激活NF-kB信号通路,促进细胞存活〔6〕;④通过下调p53蛋白表达,阻断P53介导的促凋亡转录反应;⑤诱导c-fos转录,发挥抗凋亡作用;⑥磷酸化forkhead蛋白,阻止其发挥调节凋亡相关基因转录功能〔7〕。研究发现,PI3K/AKT信号通路调节恶性肿瘤细胞的生长,侵袭转移凋亡和血管形成等,与肿瘤的发生和发展密切相关〔8~10〕,研究发现,P13K蛋白的高表达和Akt蛋白的高表达与宫颈癌细胞的增殖、浸润和转移有一定的相关性,但是,在宫颈癌的病理过程中,PI3K/Akt参与肿瘤细胞的凋亡过程尚不十分清楚〔11〕。
Bcl-2家族在调节线粒体途径中发挥了至关重要的作用,家族中的抗凋亡蛋白成员包括Bcl-2、Bcl-XL和Mcl-1等。促凋亡蛋白包括Bax、Bik、Bad和仅有BH3结构域的Bid、Bim、PUMA等BH3蛋白。这些蛋白多定位于细胞内的膜结构上,尤其是线粒体膜上。Bcl-2是线粒体凋亡通路中主要的调节蛋白, 其作用是抑制Caspase的激活底物, 如细胞色素C、凋亡诱导因子等从线粒体释放到细胞质,抑制细胞凋亡,其在肿瘤细胞的凋亡过程中发挥着重要作用。研究发现,在宫颈癌Hela细胞凋亡过程中,Bcl-2基因表达下降,同时伴随Bax、Bad等促凋亡基因表达的上调〔12~14〕,但是,在宫颈癌的病理过程中,PI3K/Akt能否通过调节Bcl-2的表达参与肿瘤细胞的凋亡过程尚需进一步研究。本研究结果提示上调Bcl-2的表达可能是PI3K/Akt信号通路调节宫颈癌的发生发展的重要环节之一。
4 参考文献
1赵闻雨,徐泽宽,朱 毅,等.渥曼青霉素对胰腺癌细胞增殖和生存的影响〔J〕.中华实验外科杂志,2006;23(12):1563-4.
2陈剑英,张 波,王国斌,等.抑癌基因PTEN在乳腺癌激素耐受细胞中的表达〔J〕.中华实验外科杂志,2005;22(10):429-31.
3Zhang XY,Zhang HY.Elevated phosphatidylinositol 3-kinase activation and its clinicopathological signi ficance in cervlcal cancer〔J〕.Eur J Obstet Gynecol Reproduc Biol,2008;139(2):237-44.
4张丽丽,吴素慧,高燕燕,等. 磷脂酰肌醇-3-激酶抑制剂对人宫颈癌细胞株生长的影响〔J〕.中国医疗前沿,2011;6(2):40-1.
5Park JK,Cho CH,Ramachandran S,etal.Augmentation of sodium butyrate-induced apoptosis by phosphatidylinositol 3-kinase inhibition in the human cervical cancer cell-line〔J〕.Cancer Res Treat,2006;38(2):112-7.
6黄秀兰,崔国辉,周克元.P13K-Akt信号通路与肿瘤细胞凋亡关系的研究进展〔J〕.癌症,2008; 27(3):331-6.
7Reuben J,Shaw LC,Cantley M.Ras,PI3K/AKT and mTOR signalling controls tumour cell growth〔J〕.Nature,2006;441(3):424-30.
8韩 静,张庆瑜,康春生,等. LY294002 抑制PI3K/AKT 信号通路对胃腺癌SGC-7901 细胞的影响〔J〕.中国肿瘤临床,2011;38(5):255-8.
9Samuels Y,Ericson K. Oncogenic PI3K and its role in cancer〔J〕.Curr Opin Oncol,2006;18(1): 77-82.
10Han Z,Wu K,Shen H,etal.Akt1/protein kinase B alpha is involved in gastric cancer progression and cell proliferation〔J〕.Dig Dis Sci,2008;53(7): 1801-10.
11姚婷婷,戴玉珍,李胜泽. 磷脂酰肌醇3激酶和蛋白激酶B在宫颈癌组织中的表达及意义〔J〕.癌症,2008;27(5):525-30.
12刘风仙,宋 扬.刺参酸性黏多糖对宫颈癌Hela 细胞凋亡及Bax,Bcl-2基因表达的影响〔J〕. 实用医学杂志,2010;26(12):2089-91.
13Ho GK,Heesang S,Deok HY,etal.Cordyceps pruinosa extracts induce apoptosis of Hela cells by a caspase dependent pathway〔J〕.J Ethnopharmacol,2010;128(2): 342-51.
14周 希,吕洁玉,龚宝兰.下调CDl47通过Bcl-2途径诱导宫颈癌细胞SiHa细胞凋亡的研究〔J〕.南方医科大学学报,2010;30(7):1695-8.

