人脂肪干细胞体外培养及细胞载体复合物诱导培养
杨 震 李 波 周焯家 简月奎 赵伟峰 田晓滨
(贵州省人民医院骨科,贵州 贵阳 550002)
脂肪间充质干细胞(ADSCs)是一种具有自我更新和多向分化潜能的多能干细胞〔1〕,是组织工程中常用的一种成体干细胞,在一定条件下可以分化成脂肪细胞、成骨细胞、骨细胞、肌细胞、神经细胞等〔2~4〕。ADSCs与骨髓间充质干细胞(BMSCs)有相似的生物学特性,同时具有来源丰富、取材容易、对机体损伤小、体外增殖迅速和生物学性状稳定等优点〔5〕,是理想的组织工程和再生治疗的种子细胞,具有不可多得的优势和前景〔6〕。在体外试验中,可通过多种方式进行ADSCs成软骨的诱导,ADSCs 在软骨修复领域的巨大潜能〔7〕。本文成功分离和培养人(hADSCs),并通过细胞载体复合物成功诱导hADSCs成软骨细胞分化。
1 材料和方法
1.1材料和试剂 脂肪组织来自贵州省人民医院手术提供,捐赠者无重大疾病史,经捐赠者同意,并经医院伦理委员会通过。Ⅰ型胶原酶购于美国Sigma公司;DMEM 培养基和胎牛血清(FBS)购于美国Gibco公司;鼠抗人CD29-PE、CD34-PE 、CD45-FITC购于美国BD公司,CD90-异氰硫酸荧光束(FITC)、CD105-FITC购于美国Sigma公司;兔抗骨唾液酸蛋白(BSP)、骨桥蛋白(OPN)、骨连接蛋白(ON)多克隆抗体、鼠抗人Collagen Ⅱ购于英国Abcam公司。
1.2方法
1.2.1hADSCs分离和培养 原代hADSCs分离:无菌条件收集脂肪组织, 磷酸盐缓冲液(PBS)冲洗3遍,剔除肉眼可见的血管及结缔组织,组织尽量剪碎至约1 mm3颗粒。加入2倍体积的1 mg/mlⅠ型胶原酶消化液(Sigma,美国),置于摇床上,37℃消化30 min后加入等体积DMEM培养基终止消化。静置5 min后吸去上层成熟脂肪细胞, 1 200 r/ min离心5 min,留取下层片状沉淀,用DMEM重悬后200 目筛网过滤。将细胞以3×104个/cm2密度接种至培养瓶中,37℃、5%CO2孵箱内培养。24 h后用PBS缓冲液冲洗,除去未贴壁的细胞和细胞碎片。2~3 d更换1次完全培养基(含10%FBS)。待细胞生长至90%融合时进行常规细胞传代培养。显微镜下观察细胞生长情况。
1.2.2hADSCs细胞表面分子标志检测 第3代hADSCs用0.25%胰蛋白酶常规消化并收集细胞,制成单细胞悬液,调整细胞密度为1 × 106个/ml,分别与鼠抗人CD29-PE、CD34-PE、CD45-FITC、CD90-FITC、CD105-FITC4 ℃避光孵育30 min,PBS清洗2次后重悬,进行流式细胞仪检测。并使用同型对照单克隆抗体确定背景标记。
1.2.3hADSCs生长曲线测定 第3代对数期hADSCs,常规消化并收集细胞,按1 × 104个/孔密度接种于96孔板中。分别于第2~8天每隔24 h用噻唑蓝(MTT)法、酶标仪上测定450 nm处吸光度值。每组3个复孔,同时设置调零孔。
1.2.4hADSCs多分化潜能测定检测 第3代hADSCs生长至90%融合时,用0.25%胰蛋白酶常规消化并收集细胞,制成单细胞悬液,调整细胞密度为1 × 105个/孔密度接种于铺有盖玻片的6孔板中。当细胞生长至60%融合时进行诱导分化。
1.2.4.1hADSCs成脂诱导分化与检测 将培养基更换为成脂培养基,成脂培养基成分:10%FBS、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤、0.5 μmol/L地塞米松、10 μmol/L胰岛素、50 μmol/ L吲哚美辛;每2~3天换液。以未加诱导培养基(仅用完全培养基)的细胞培养孔作为空白对照。诱导培养14 d后将盖玻片上的细胞进行油红O染色鉴定。
1.2.4.2hADSCs成骨诱导分化 将培养基更换为成骨培养基,成骨培养基成分:10%FBS、10 mmol/L β甘油磷酸、100 nmol/L地塞米松、50 μmol/L抗坏血酸。以未加诱导培养基(仅用完全培养基)的细胞培养孔作为空白对照,诱导培养21 d。通过免疫荧光检测BSP、OPN、ON的表达。
1.2.4.3hADSCs成软骨诱导分化 将培养基更换为成骨培养基,成软骨培养基成分:10%FBS、2 mg/L 胰岛素、3 mg/L 转铁蛋白、1 mmol/L 丙酮酸、100 nmol/L 地塞米松、10 μg/L 转化生长因子 β。将盖玻片上的细胞进行甲苯胺蓝染色以及免疫组化检测Ⅱ型胶原蛋白表达。
1.2.5hADSCs细胞载体复合物诱导培养 第3代hADSCs制成单细胞悬液,调整细胞密度为1 × 106个/ml。按细胞悬液∶FBS∶5倍浓缩DMEN∶胶原纤维蛋白溶液=2∶1∶2∶5(体积比)快速混匀形成hADSCs-胶原混悬液,立即加入12孔板,2ml/孔,置37℃培养箱内孵育20 min后形成凝胶状,加入完全培养基1 ml进行培养。根据胶原纤维蛋白溶液分为三组: A组:Ⅰ胶原纤维蛋白20%+Ⅱ胶原纤维蛋白60%+Ⅲ胶原纤维蛋白20%。;B组:Ⅱ胶原纤维蛋白;C组:Ⅰ胶原纤维蛋白。另一组无胶原溶液,进行常规培养作为对照组,即为D组。每组3个复孔。2~3 d换液一次,培养14 d后将凝胶固定、包埋,切片后进行甲苯胺蓝染色以及免疫组化检测Ⅱ型胶原蛋白表达。
2 结 果
2.1hADSCs的形态学特点 原代细胞24 h后开始贴壁,2 d后细胞贴壁伸展生长,呈短梭型或是不规则三角形、四边形或多边形,见图1A。3 d 后观察可以看到细胞渐渐呈现梭型或长梭型,培养5~7 d后细胞开始增殖。传代培养后4~6 h贴壁,细胞融合时呈漩涡状或放射状生长排列,细胞形态较均一,呈纤维细胞样生长。见图1B。
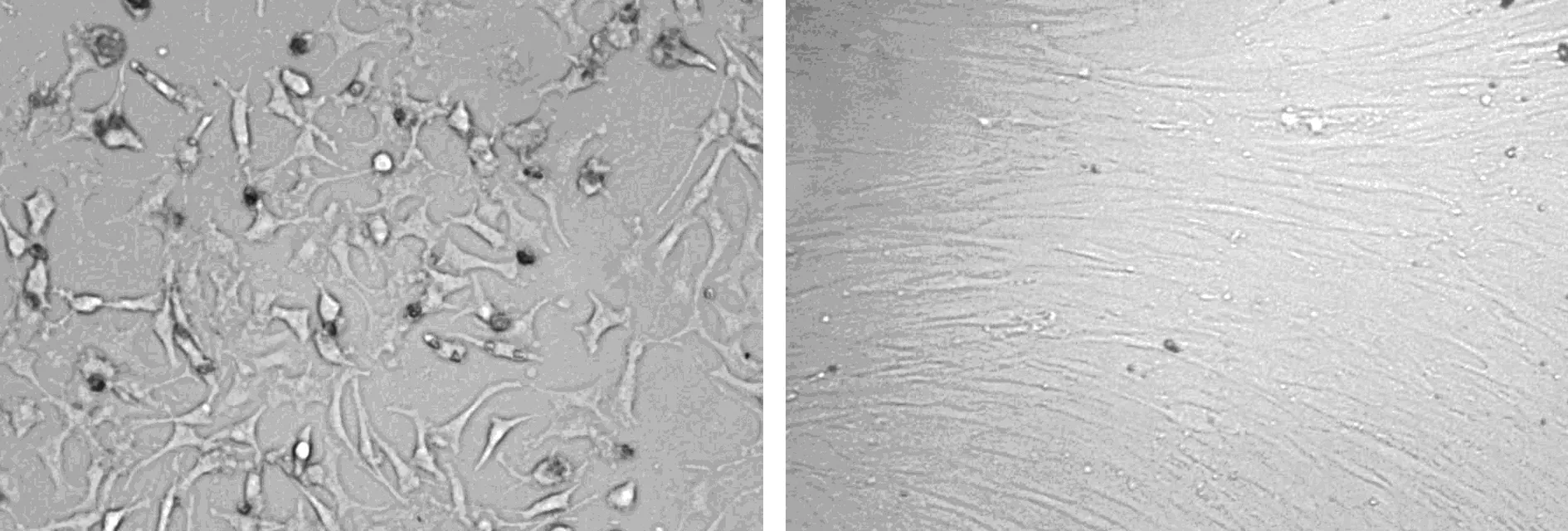
A.原代hADSCs 2 d B.第三代hADSCs 融合
2.2hADSCs生长曲线 细胞传代后,增殖曲线呈S形,经过2~3 d的潜伏期,5~6 d进入指数生长期,7 d后出现平台期,此时细胞己达到近90%的融合。见图2。
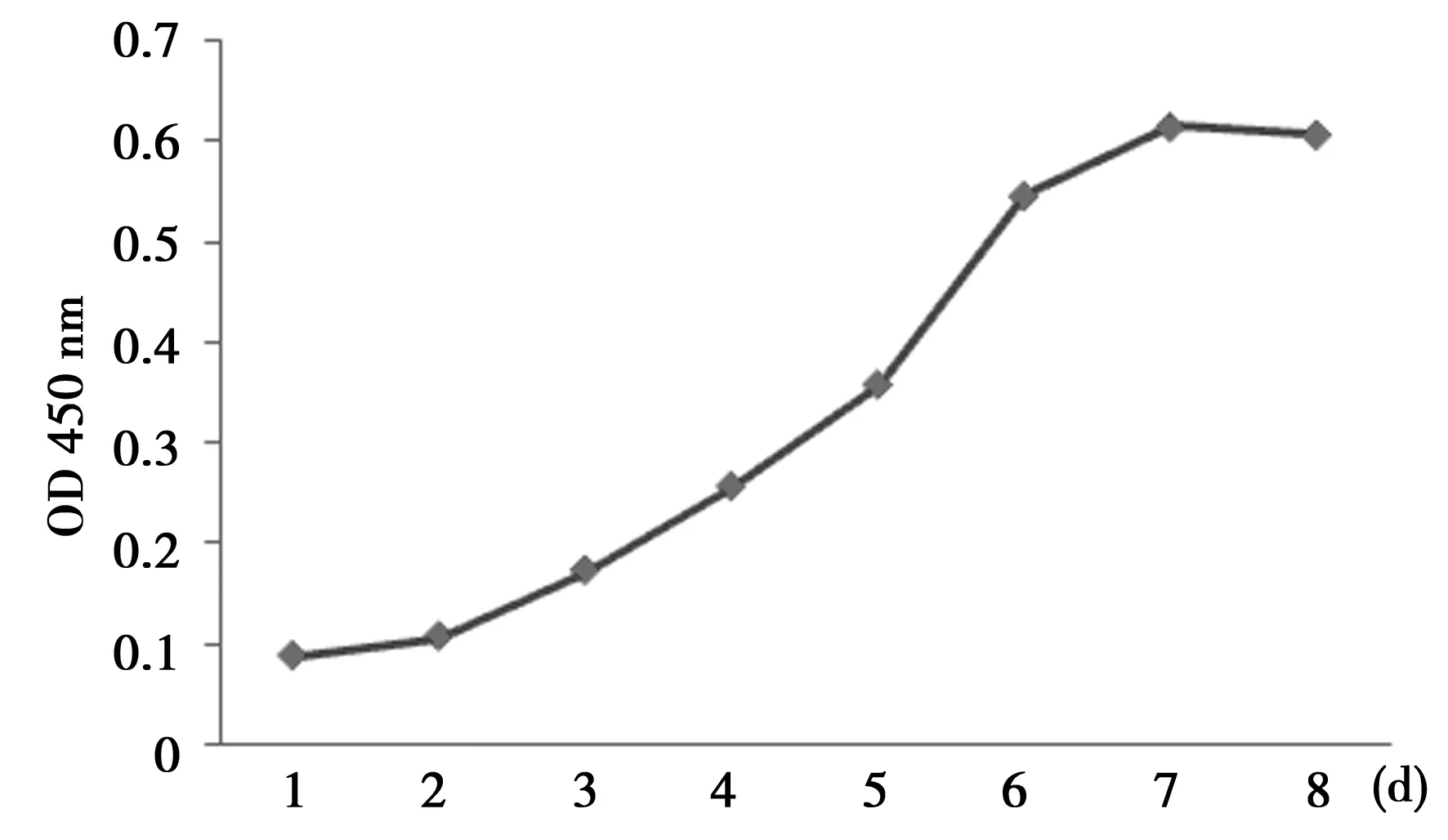
图2 脂肪干细胞增殖曲线
2.3hADSCs细胞表面抗原标志分析 流式细胞仪检测结果显示,第3代hADSCs CD29、CD90、CD105呈阳性表达;而CD34、CD45呈阴性表达。
2.4hADSCs多分化潜能测定 hADSCs成脂诱导后光镜下观察发现细胞形态由长梭形变成类圆形,在细胞质内有透亮的脂滴出现(图3B),随着诱导时间延长而逐渐增多,14 d 结束诱导时油红O染色脂滴呈鲜红色(图3C),未经诱导的细胞无明显变化(图3A)。hADSCs成骨诱导后部分细胞胞体增大,梭形转化为不规则多角形或立方形,免疫荧光检测结果发现细胞不同程度表达BSP、OPN、ON,见图4。hADSCs成软骨诱导后,镜下可见细胞形态变为铺路石样,甲苯胺蓝染色,细胞周围有蓝色基质染色,经Ⅱ型胶原免疫组化染色结果呈阳性。见图5。
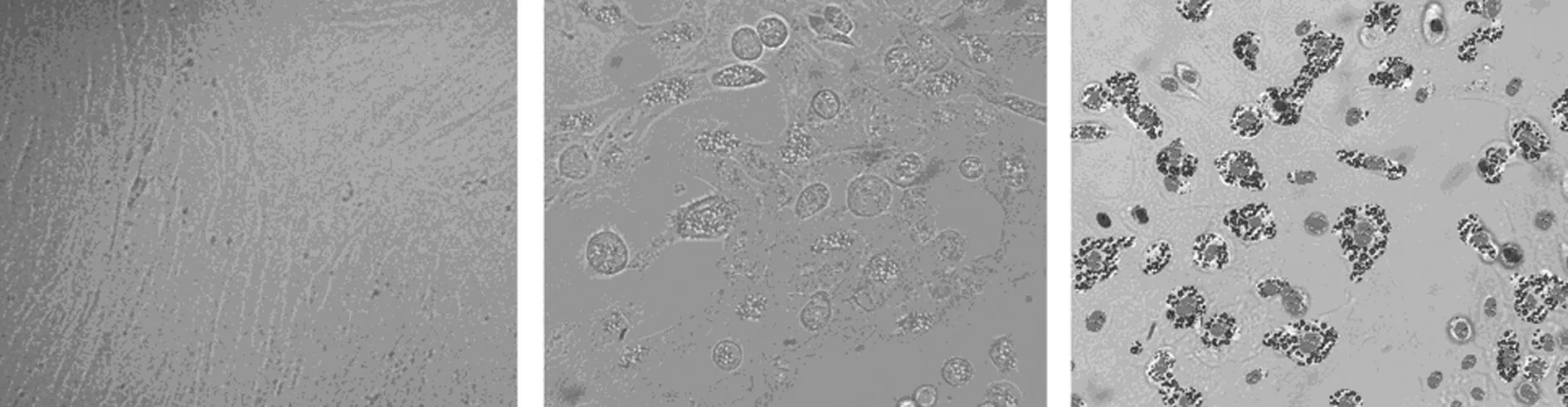
A.未经诱导 B.诱导后 C.诱导后油红O染色
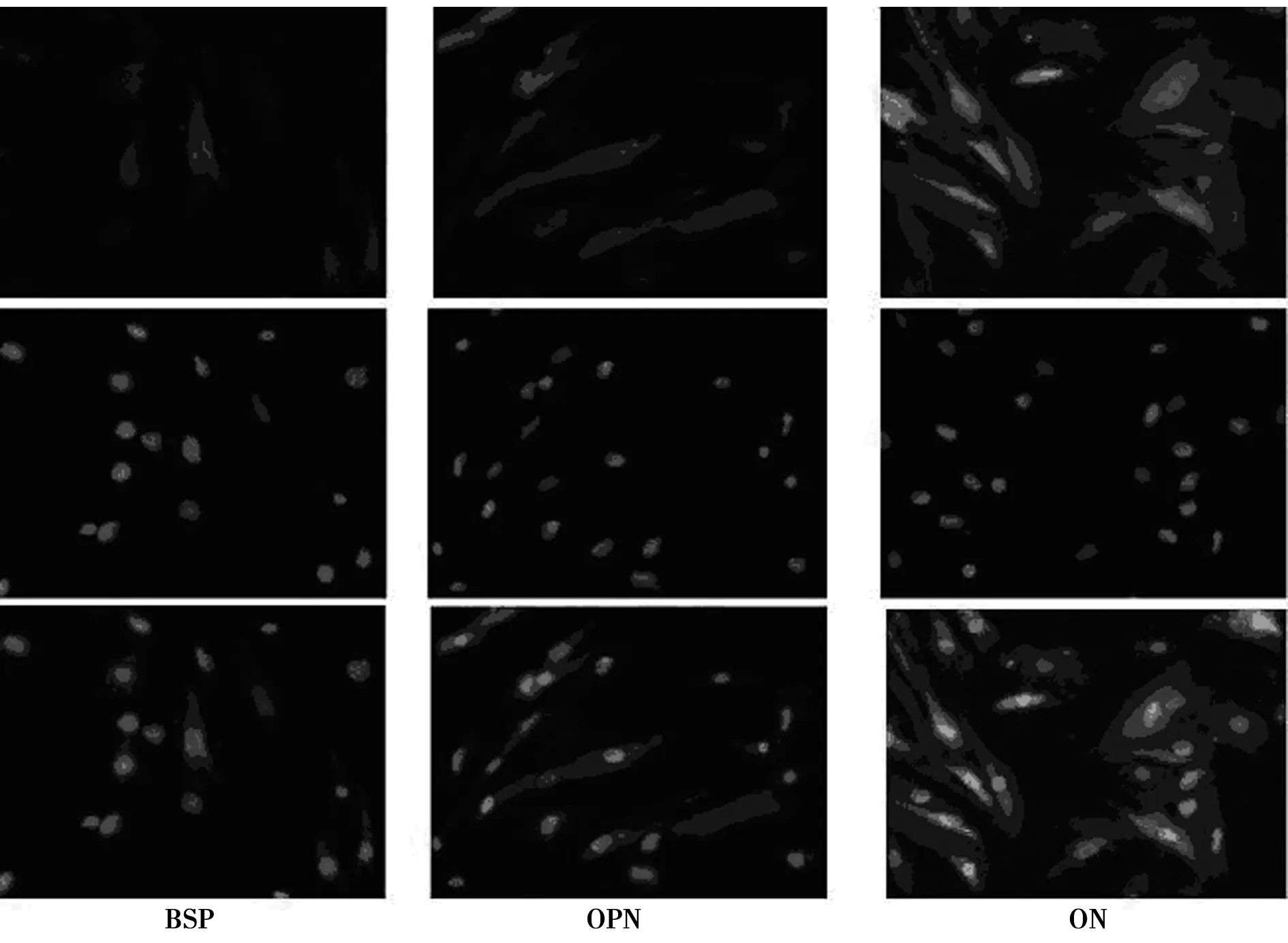
图4 hADSCs成骨诱导分化(×200)
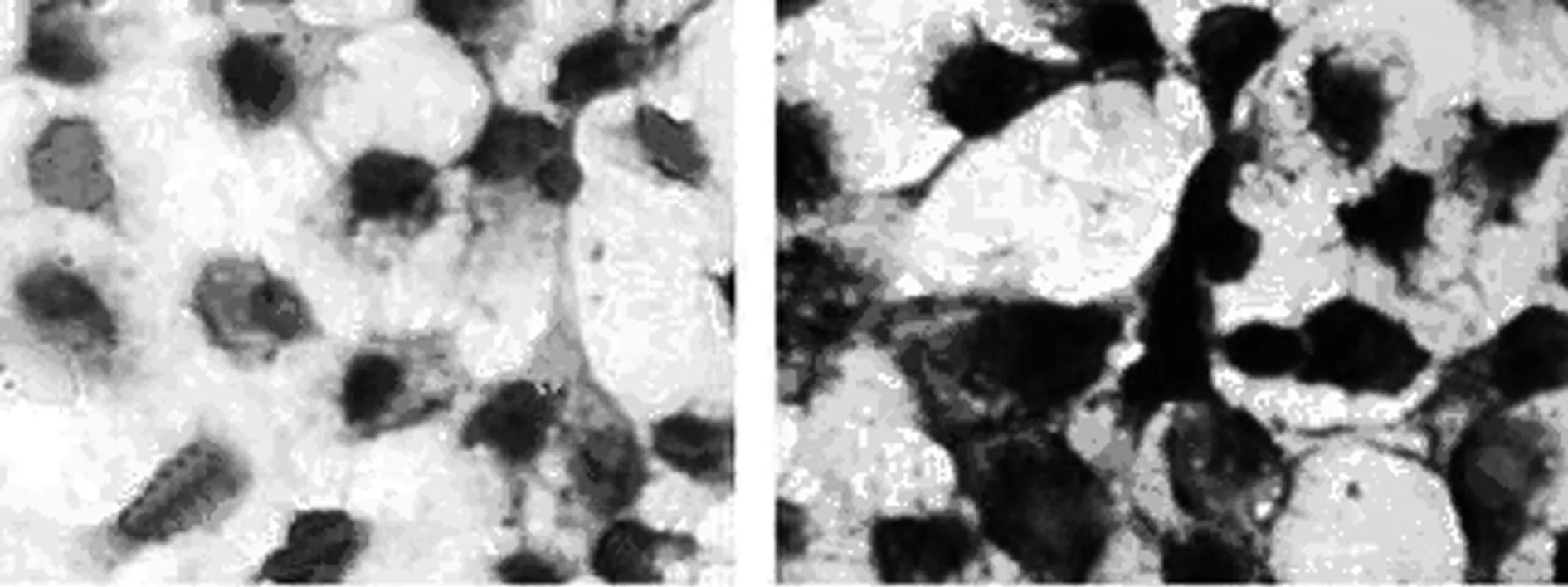
阿利新蓝染色 免疫组化检测Ⅱ型胶原蛋白
2.5细胞载体复合物的成软骨诱导鉴定结果 A、B、C组细胞均有不同程度的阿利新蓝染色。对照组无明显染色。免疫组化检测Ⅱ型胶原蛋白结果显示,A组阳性表达(), B、C组弱阳性表达(+),D组阴性表达。
3 讨 论
急慢性软骨组织损伤造成的关节炎在全世界有极高的发病率,尤其是在老年患者中有极高的发病率。因关节软骨没有血管、神经及淋巴组织,自身修复能力非常有限,其治疗一直是骨科领域的一个难题。目前利用组织工程技术进行软骨修复是软骨疾病治疗的主要研究方向之一。其中种子细胞的来源及培养,细胞载体材料的研究开发以及组织培养中各种因子的调控作用是研究的重要内容。近年来将BMSCs作为骨和软骨组织工程种子细胞的研究很多〔8〕,而研究发现,ADSCs凭借其特有的优势,可作为构建骨与软骨组织工程中的种子细胞〔9〕。
研究显示ADSCs有各种分离纯化方法〔2,10〕,但仍缺乏标准化的分离、培养、纯化、鉴定方法。本研究成功分离出易于体外培养、并能稳定增殖的hADSCs,通过细胞活性检测发现获得细胞活性高,增殖速度快,为后续研究提供高了质量的细胞。
目前尚未有ADSCs公认的特异标志物,本研究通过流式细胞术检测多种表面抗原,结果显示hADSCs表达间充质干细胞相对特异性分子如CD105、CD90〔11〕。CD29识别整合素亚单位的蛋白,广泛存在于除了红细胞外的各种组织及细胞中,本研究分离的细胞CD29阳性表达表明是基质类细胞〔12〕。而不表达造血干细胞和内皮细胞标记CD34、白细胞标记CD45,排出了血细胞和内皮细胞污染的可能性〔13〕。以上联合鉴定的结果表明,本实验分离所得的细胞是hADSCs,且细胞纯度较高。
hADSCs在成脂诱导的过程中细胞形态成类圆形,胞质中脂滴的出现以及经油红O染色结果证明该细胞具有成脂分化的能力。在成骨诱导分化中,细胞不同程度表达BSP、OPN、ON间接证明hADSCs在一定的条件下可诱导分化为成骨细胞。hADSCs成软骨诱导后,从细胞形态以及甲苯胺蓝染色和Ⅱ型胶原免疫组化结果均提示该细胞有分化成软骨细胞的能力。
通过与不同浓度的胶原纤维蛋白的结合,形成细胞hADSCs载体凝胶复合物,鉴定检测结果发现,Ⅰ胶原纤维蛋白20%+Ⅱ胶原纤维蛋白60%+Ⅲ胶原纤维蛋白20%的混合胶原纤维蛋白组hADSCs成软骨细胞分化更明显,其分化程度高于独一种类的胶原纤维蛋白组。提醒人们,复合胶原蛋白可能具有一定成软骨诱导作用。同时研究显示胶原蛋白是作为软骨支架材料,在组织工程软骨研究中有重要地位。胶原蛋白作为载体,与细胞相容性好且具有较低的抗原性,承重性、可降解性等均较好〔14〕。于洪宇等〔8〕将来源于骨髓的间充质细胞包埋在"壳聚糖-胶原蛋白"凝胶里,将移植物移植到骨软骨缺损区承重兔关节表面,观察到可以修复关节软骨缺损。提示胶原蛋白作为支架材料,同时诱导hADSCs诱导成软骨细胞分化,有可能作为修复关节软骨缺损的理想支架材料。
综上所述,本研究成功分离出hADSCs,体外定向诱导细胞成脂、成骨和成软骨分化,为组织缺损的再生修复提供了丰富的种子细胞。复合胶原纤维蛋白载体诱导细胞成软骨细胞分化,为修复关节软骨缺损支架材料的研究提供实验依据。
4 参考文献
1Zuk PA,Zhu M,Ashjian P,etal.Human adipose tissue is a source of multipotent stem cells〔J〕.Mol Biol Cell,2002;13(12):4279-95.
2朱艳霞,刘天庆,宋克东,等.人脂肪组织来源干细胞生物学特性研究〔J〕.大连理工大学学报,2010;50(5):649-55.
3Mizuno H,Tobita M,Uysal AC.Concise review: adipose-derived stem cells as a novel tool for future regenerative medicine〔J〕. Stem Cells,2012;30(5):804-10.
4王文加,焦 平,许天敏,等.脂肪来源基质细胞的扩增及多分化潜能研究〔J〕. 中国老年学杂志, 2007;27(5):423-6.
5Yoshimura H, Muneta T, Nimura A,etal.Comparison of rat mesenchymal stem cells derived from bone marrow,synovium, periosteum, adipose tissue, and muscle 〔J〕.Cell Tissue Res, 2007;327(3): 449-62.
6Lindroos B,Suuronen R,Miettinen S.The potential of adipose stem cells in regenerative medicine 〔J〕.Stem Cell Rev,2011;7(2):269-91.
7Feng G, Wan Y, Balian G,etal.Adenovirus-mediated expression of growth and differentiation factor-5 promotes chondrogenesis of adipose stem cells〔J〕.Growth Factors,2008;26(3):132-42.
8于洪宇,马春雨.壳聚糖-胶原凝胶复合骨髓间充质干细胞修复兔关节软骨缺损的组织学变化〔J〕.中国组织工程研究与临床康复,2010;14(25):4581-4.
9刘兆杰,胡永成.外源性生长因子修饰脂肪组织来源干细胞成骨与成软骨表达的研究进展〔J〕.中国矫形外科杂志,2013;21(3):250-5.
10殷莉波,赵文秀,尹震宇.人脂肪间充质干细胞的分离培养及其鉴定〔J〕.中国组织工程研究与临床康复,2010;14(32):5997-6000.
11Ning H, Liu G, Lin G,etal.Identification of an aberrant cell line among human adipose tissue-derived stem cell isolates〔J〕.Differentiation,2009;77(2):172-80.
12田 霖,孙筱放,刘海波.人脂肪干细胞的分离培养与生物学特性〔J〕 .中国组织工程研究,2012;16 (32):5946-52.
13Neupane M,Chang CC,Kiupel M,etal.Isolation and characterization of canine adipose-derived mesenchymal stem cells〔J〕.Tissue Eng Part A,2008;14(6):1007-15.
14王宏亮,韩 东.生物材料复合支架与运动性关节软骨缺损的修复〔J〕.中国组织工程研究与临床康复,2011;15 (8):1475-8.

