儿内科住院患者营养风险筛查与血液营养指标的关系
车千红,徐静,孙灿
(1.中国医科大学附属盛京医院 临床营养科,辽宁 沈阳 110004; 2.中国人民解放军沈阳军区总医院 营养科,辽宁 沈阳 110016)
近年来,营养支持对临床结局影响的研究得到广泛关注。营养不良状况如得不到及时的纠正,患者机体免疫能力将下降,从而增加患者并发症及感染发生的风险。营养风险筛查是营养管理的第一步,通过筛查以便对存在营养风险的儿童进行早期有效的营养治疗,促进疾病康复并改善其临床预后[1]。对高营养风险住院患儿进行干预和管理后,患儿高营养风险检出率明显下降[2]。目前营养治疗的应用尚不规范,这一现象在儿科领域更为普遍[1]。本研究以2013年2月至2013年10月中国医科大学附属盛京医院收治的668例1个月~14岁儿内科住院患者为研究对象,应用2010年修正的欧洲营养学会推荐使用的儿科营养不良评估筛查工具(Screening Tool for the Assessment of Malnutrition in Pediatrics,STAMP)[3]来评估患儿营养状况,探讨不同系统疾病间血液营养指标的变化及异常值比例,并对营养指标与高营养风险的相关性进行分析,以期及早了解患儿营养状况,为住院患儿营养干预和临床治疗提供参考意见。
1 对象与方法
1.1 研究对象
选择2013年2月至2013年10月我院儿内科的新住院患儿共668例,男398例,女270例;年龄1个月~14岁,平均(4.5±0.2)岁。纳入标准:住院天数>1d的非ICU患儿。排除标准:(1) 年龄< 1个月或>14岁;(2) 拒绝参加评定者;(3) 肾病、水肿等不能准确获得体重者。所有研究对象的监护人均签署知情同意书。
1.2 STAMP评分方法
患儿采用STAMP于入院48h内进行评分。STAMP总评分由患儿疾病因素、营养摄入情况和生长情况三者评分相加构成,以STAMP总分0~1分为无或低发生营养不良风险,2~3分为有中度发生营养不良风险,4~5分为提示有发生营养不良的高风险[3]。
1.3 儿童营养不良评价指标
0~5岁(不包含5岁)患儿参照2006年WHO的儿童生长标准Weight- for- age Z- score(WAZ) <-1为营养不良,<-2为消瘦;≥5岁患儿参照2007年WHO 5~19岁儿童青少年生长标准,BMI- for- age Z- score(BAZ) <-1为营养不良, <-2为消瘦[4]。
1.4 研究方法
入院次日于空腹状态下抽取静脉血,常规检测患者白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)、血红蛋白(hemoglobin,HGB)、血清肌酐(serum creatinine,Scr)、C反应蛋白(C- reactive protein,CRP)。贫血诊断参考WHO及我国营养性贫血诊断依据,1~59个月龄组HGB<110g·L-1,5~12岁组HGB<115g·L-1[5]。体质量采用标准的测量儿童身高体重仪器测量,体质量精确至0.1kg,身长或身高精确至0.1cm。询问近3个月体质量变化及近1周饮食情况。
1.5 统计学处理
本次所有研究资料均采用SPSS 18.0统计学软件处理,先进行正态性分布检验,计量资料使用均数±标准差表示,采用方差分析;计数资料使用例数、百分比表示,采用χ2检验,P<0.05为差异具有统计学意义。单因素分析采用Pearson单因素进行分析。
2 结 果
2.1 各系统疾病营养不良发生率
668例患儿中呼吸系统疾病占48.2%(322/668),消化系统疾病占19.0%(127/668),神经系统疾病占24.9%(166/668),其它疾病占7.9%(53/668)。总的营养不良发生率为19.5%(130/668),各系统疾病中营养不良发生率差异有统计学意义(χ2=15.284,P=0.013),其中以消化系统疾病营养不良发生率最高,为29.1%。见表1。

表1 各系统疾病患儿营养不良发生情况比较 例
注:括号中为所占百分比
2.2 营养风险评分
668例患儿中,呼吸、消化、神经系统疾病无或低营养风险率均明显低于其他疾病,差异有统计学意义(χ2=10.359,P=0.003)。有高营养风险的患儿占28.1%(188/668),其中以消化系统疾病高营养风险率最高为39.4%,差异有统计学意义(χ2=9.047,P=0.014)。见表2。
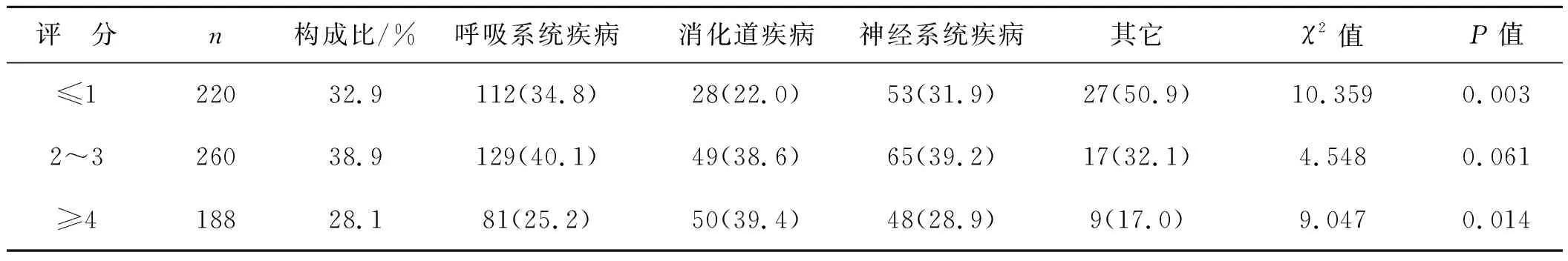
表2 各系统疾病患儿的STAMP评估情况 例
注:括号中为在各系统疾病中所占百分比
2.3 血液营养指标分析
668例患儿中,PA以消化系统疾病最低,Scr以呼吸系统疾病最低。各系统疾病间的PA、Scr水平比较差异有统计学意义(P<0.01),ALB、HGB水平比较差异无统计学意义(P>0.05)。见表3。
表3各系统疾病患儿血液营养指标比较

疾病种类nALB/g·L-1PA/g·L-1HGB/g·L-1Scr/μmol·L-1呼吸系统疾病32238.9±6.70.129±0.051123.8±18.426.8±8.4消化道疾病12740.4±5.20.127±0.062117.0±15.630.1±7.6神经系统疾病16644.5±3.80.160±0.068124.4±10.235.9±12.5其它5343.8±2.60.162±0.036123.1±11.931.9±8.2F值0.72312.8012.9459.177P值0.85400.1510
2.4 各项指标含量异常分布的比例
营养指标异常在各系统疾病中均存在,其中以Scr、PA降低比例最高,分别为96.6%、81.4%。PA以呼吸、消化系统疾病降低比例最高,为92.6%、96.1%。低蛋白血症、贫血总体比例不高,分别为6.1%、17.0%。呼吸系统疾病CRP升高比例最高,为71.7%。见表4。
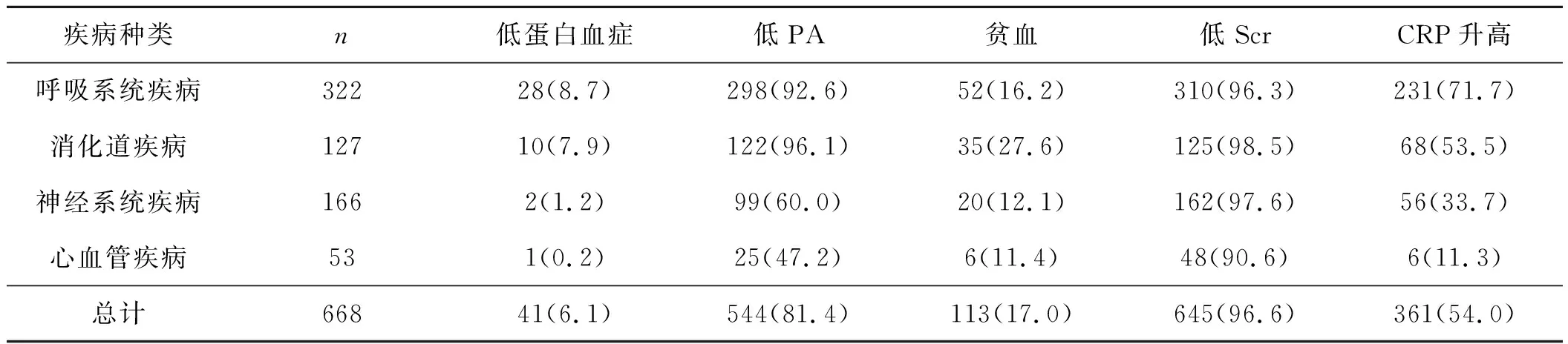
表4 不同系统疾病患儿营养指标含量异常的分布比例 例
注:括号中为所占百分比
2.5 Pearson单因素分析
患儿营养风险发生率与PA、Scr值呈负相关,而与CRP值呈正相关。见表5。
3 讨 论
住院患儿营养不良的发生已十分常见,营养不良可降低机体免疫功能,减弱对疾病应激反应的抵抗能力,最终影响患儿预后[6]。目前,我国儿科临床营养规范化远落后于发达国家。营养风险筛查是营养管理的第一步,是为了避免院内营养不良的发生和发展、减少并发症和疾病不良预后的工具,需在入院24~48h内完成,一旦发现营养风险须行进一步营养评估和干预。
表5营养风险与各指标相关性分析

指 标r值P值ALB0.1470.085PA-0.4830.012Scr-0.5140.007CRP0.5230.005HGB0.1280.071
目前国际上推出的住院儿童营养筛查工具较多,但各种筛查工具利弊共存,仍需进一步大样本调查研究的验证与比较[7]。STAMP是2008年由欧洲营养学会提出的儿科营养不良评估筛查工具,其临床操作简便、实用性强[1]。2011年广西3所医院采用STAMP对1个月~18岁儿科住院患儿进行营养风险评估,结果认为STAMP评分能够相对客观地发现住院患儿营养风险,可为儿科患者进行营养支持提供依据,具有临床推广的价值[2]。
本研究中所有入选患儿均完成筛查。此次结果显示668例儿内科住院患儿高营养风险发生率为28.1%(188/668),与国内谢琪等[2]报道的住院患儿高营养风险发生率26.56%相比略高,其原因可能是我院为三级甲等综合医院,收治辽宁省及周边省区的重症患儿较多,因其病情较重而更易发生高营养风险。此外,在其报道中显示儿心胸外科高营养风险率(32.8%)显著高于儿内科(23.7%),而本次研究是以儿内科患者为研究对象,并未纳入儿外科患者,提示相对于营养风险管理备受关注的儿外科,儿内科营养风险发生状况同样不容乐观。
血清ALB水平是反映机体营养状况的指标之一,是目前评价蛋白营养状况的最常用生化指标。但由于其半衰期较长,因此,不能发现边缘性蛋白营养不良。本研究结果显示,各系统疾病患儿ALB值并无明显差异(P>0.05),低蛋白血症在患儿中的发生比例只有6.1%,且与高营养风险发生率无相关性。提示ALB敏感性低,不能及早预示高营养不良发生风险。PA半衰期短,能更灵敏地反映体内蛋白质的储备。本研究发现PA水平降低在住院患儿中的发生比例高达81.4%,各系统疾病间的PA水平比较,差异有统计学意义(P<0.01),以消化系统疾病PA值最低,呼吸系统疾病次之,高营养风险发生率与PA值呈负相关。提示PA反映体内蛋白储存的敏感性好,可作为早期预示高营养风险发生的指标。PA作为有效反映营养状态的指标,对于指导营养干预措施的制定有较高的临床价值。Scr浓度主要受机体肌肉蛋白代谢的影响,如患者Scr浓度下降则说明患者存在营养不良现象。表4可见住院患儿Scr水平下降总体比例为96.6%,而以呼吸系统疾病Scr水平下降最为明显。表明呼吸、消化系统疾病患儿更易发生高营养风险,其原因可能与呼吸系统疾病能量代谢较高,消化系统疾病能量摄入减少、排出增加有关。神经内科患儿因呕吐、纳差也有一定比例的高营养风险存在,应及早发现给予干预。
本研究结果发现住院患儿贫血总体比例不高,且多发生在3岁以下婴幼儿。其原因可能是婴幼儿期较其他年龄段生长发育相对更快,造血原料一旦消耗增加、外供不足,很易发生缺铁导致贫血。重度贫血者的ALB、PA值会明显降低[8]。贫血可引起细胞免疫功能下降,因此,应关注并及早治疗婴幼儿缺铁。
营养不良可分为单纯性营养不良及炎症性营养不良,单纯性营养不良主要与患者饮食受限以及社会等因素有关,而炎症性营养不良则可能与炎症状态导致患者蛋白合成减少、增加基础能量消耗、减少主动活动等因素有关。机体持续性炎症状态是导致患者营养不良的主要原因,微炎症状态与营养不良相互促进,相互作用。CRP 其灵敏性及特导性较高,是人体中众多蛋白的一种[9],若患者发生各种急性或慢性感染以及体内出现组织损伤,则CRP含量将会发生显著上升现象[10]。本研究结果显示各系统疾病间CRP升高比例差异较大,以呼吸、消化系统CRP升高较为明显,提示两大系统疾病除食物摄入减少外还主要存在炎症性营养不良,共同作用影响患儿的营养状态。
营养风险筛查并不是指“发生营养不良的风险”,而是指与营养因素有关的不良结局参数(包括并发症、住院时间和住院费用等)增加的风险。本研究结果显示,住院患儿均以消化系统疾病营养不良发生率及高营养风险发生率最高,表明营养风险高的患儿发生营养不良的风险增加,与周云等[11]研究结论相符。表4可见低PA、低Scr的比例也以消化系统疾病最高(P<0.01),Pearson单因素分析显示营养风险发生率与PA、Scr呈负相关,提示PA、Scr水平可作为住院患儿更准确、更敏感的营养指标。因此,对高营养风险患儿应尽早给予营养干预,以减少营养不良的发生几率。同时提示临床医护人员,随着PA、Scr水平的降低,患儿营养不良的风险也在加大,应通过PA、Scr水平及时预测患者营养不良风险,采取有效的营养干预手段,从多方面改善患者预后。
有研究显示,新生儿营养风险及营养不良的检出率分别高达38.6%和25.0%[11],患儿年龄越小,其营养状态越易受外界因素的影响。本研究中未把年龄作为统计学因素,对于儿科住院患者的血液营养指标准确性还需进一步的探讨。本研究营养不良检出率略低于相关文献报道的住院患儿营养不良患病率24.1%[12],其原因可能与本研究样本量较少,而且未把儿普通外科、儿骨外科、儿心胸外科等更易发生营养不良的患儿纳入统计范围有关。
综上所述,高营养风险的住院患儿可能是营养不良发生的高危人群,临床医生应关注患儿营养风险管理,积极推广临床营养观念,及时对患儿进行营养支持。希望本研究可为尽早发现住院患儿营养风险提供参考依据,以促进患儿康复并保障其正常成长。
[1] 彭璐婷.住院儿童营养风险筛查和营养治疗的研究现状[J].中国循证儿科杂志,2012,7(2):155- 159.
[2] 谢琪,洪莉,林媛,等.儿科住院患者营养状况及营养风险调查[J].临床儿科杂志,2013,31(8):748- 751.
[3] MCCARTHE H,MCNULTY H,DIXON M,et al.Screening for nutrition risk in chidren:the validation of a new tool[J].J Hum Nutr Dirt,2008,21(4):395- 396.
[4] 潘建平.评价儿童生长与营养不良的指标选择[J].中华儿科杂志,1996,34(2):88- 92.
[5] 杨晓亮,叶荣伟,郑俊池,等.中国21县(市)3~6岁儿童贫血与体格发育的关系研究[J].卫生研究,2009,38(6):688- 691.
[6] 孙志慧,胡若梅,万津颖.营养风险筛查2002的临床应用和分析[J].中华临床营养杂志,2009,17(6):332- 334.
[7] 刘攀.住院儿童营养风险筛查工具介绍[J].儿科药学杂志,2013,19(12):48- 50.
[8] 李小民.再生障碍性贫血患者治疗前后血液生化指标的变化研究[J].现代医学,2012,40(2):212- 215.
[9] JAYE D L,WARES K B.Clinical applications of C- reactive protein in pediatrics[J].Pediatr Infect Dis,2012,16(8):735- 747.
[10] 吴捍卫.C反应蛋白在感染性肺炎中的辅助诊断作用[J].检验医学与临床,2013,3(1):21- 22.
[11] 周云,杜明红,陈长玲,等.681例住院患儿的营养风险筛查[J].重庆医学,2011,40(18):1791- 1792.
[12] TAO Y X,XU Y F,TANG Q Y,et al.Nutrition assessment in hospitalized children[J].Chinese Journal of Clinical Nutrition,2007,15(4):214- 217.

