糖基化终产物对人血管平滑肌细胞表达及分泌甲状旁腺激素相关肽和血管钙化的影响
张琴,刘乃丰
(1.东南大学 医学院,江苏 南京 210009; 2.东南大学附属中大医院 心血管内科,江苏 南京 210009)
甲状旁腺激素相关肽(PTHrP)是一种促进钙离子病理性沉积的体液调节因子[1],该蛋白与甲状旁腺激素有相似的氨基末端,可与其共同受体相互作用,以促进骨吸收、抑制钙离子分泌[2],然而,PTHrP与血管钙化之间的关系是有争议的。Jono等通过构建体外血管钙化模型观察到,PTHrP在牛血管平滑肌细胞钙化进程中的表达水平下降,外源性PTHrP(1- 34)呈剂量依赖的方式抑制血管平滑肌细胞的钙化[3]。Liu等研究发现,PTHrP可激活骨形成蛋白2/核心结合因子α亚单位1(BMP- 2/cbfα1)信号通路,进而引起血管钙化的发生[4]。研究表明,患者血清晚期糖基化终末产物(AGEs)水平升高与动脉硬化的发生发展相关联[5],细胞实验进一步证实了AGEs是通过诱导主动脉平滑肌细胞的成骨分化而促进糖尿病血管钙化发生的[6],目前尚缺乏有关糖尿病血管钙化与PTHrP之间相互关系的信息。由此作者假设:AGEs可影响人血管平滑肌细胞分泌及表达PTHrP,进而促进细胞钙化的发生。
1 材料和方法
1.1 材料
人血管平滑肌细胞株(产品:人肺动脉平滑肌细胞)由南京医科大学呼吸内科研究所馈赠。牛血清白蛋白(BSA)、胰蛋白酶及DEPC均为Sigma公司产品,胎牛血清为Gibco公司产品,细胞钙含量检测试剂盒和碱性磷酸酶(alkaline phosphatase, ALP)试剂盒购自南京建成生物工程研究所,甲状旁腺激素相关肽(PTHrP)酶联免疫分析试剂盒购自上海士锋生物科技有限公司,BCA蛋白检测试剂盒购自碧云天生物试剂研究所。引物由南京金斯瑞生物科技有限公司合成,Trizol、逆转录试剂盒、SYBR Green预混试剂均产于Takara公司。荧光定量PCR仪(Roche公司)。
1.2 AGEs的制备及鉴定
将BSA与葡萄糖共溶于0.2mol·L-1PBS溶液中,使BSA终浓度为10g·L-1,过滤除菌后于37℃恒温箱中无菌避光孵育90d,取出后将制备的AGE- BSA及其对照物装入透析袋,0.02mol·L-1PBS中充分透析72h,去除未结合葡萄糖。对照组BSA除不加葡萄糖外,余操作同上。荧光分光光度计激发波长370nm、发射波长440nm对AGE- BSA行鉴定,并用BSA蛋白含量检测AGE- BSA最终浓度。
1.3 人血管平滑肌细胞培养及实验分组
用DMEM完全培养基(含10%胎牛血清的DMEM培养基)培养人血管平滑肌细胞,每3d换1次液,5~7d细胞生长至融合状态,用胰酶消化后行传代培养。实验用第8代细胞,选取对数生长期细胞,按每孔5×104个将细胞均匀接种于12孔板中,细胞生长5~6d后铺满板底约90%,此时对细胞行饥饿处理:各孔细胞弃上清,每孔加入1ml 含2%胎牛血清的DMEM培养基后于37℃孵育箱中继续培养24h。行AGEs干预处理:分别在基础培养基中加入50、100、200、400mg·L-1终浓度的AGE- BSA及浓度为400mg·L-1的BSA作为对照,同时设空白对照组,连续培养 48h。
1.4 细胞内钙含量检测
方法同前,将分组干预后的细胞用PBS液洗3次,加入0.6mmol·L-1HCl在37℃恒温箱中脱钙24h,盐酸悬液中的钙含量用钙测定试剂盒检测,按试剂盒操作说明加入碱性溶液及甲基百里香酚蓝(MTB)试剂混匀后静置5min,于酶标仪上测定610nm处的吸光度,并以钙标准液的吸光度绘制标准曲线。脱钙后的细胞用PBS清洗3次后加0.1mmol·L-1NaOH/0.1% SDS(十二烷基硫酸)溶解,以BCA法检测其蛋白含量,并以蛋白含量标化钙含量。每组实验重复3次。
1.5 ALP活性及其含量检测
方法同前,细胞干预后吸去培养基,用冷PBS清洗3次,每孔加入0.1% Triton X- 100溶液,4℃冰箱内放置12h,充分裂解后收集于离心管中超声破碎10s。按照试剂盒操作说明加入基质液及缓冲液充分混匀,37℃温育15min,加入显色剂振荡混匀,测定各孔520nm处的吸光度。用BCA法检测配制底物中的蛋白含量,用蛋白含量标化ALP含量。每组实验重复3次。
1.6 PTHrP分泌量检测
分组同前,根据人副PTHrP免疫分析试剂盒操作说明每孔加入待测样品后温育30min,充分洗涤后加入酶标试剂,重复上述的温育、洗涤步骤后加入显色剂,避光显色15min,最后加入终止液终止反应,以空白孔调零,450nm波长依序测定各孔的吸光度,同时以稀释为不同浓度的标准品测定的OD值绘制标准曲线,根据标准曲线计算样品中PTHrP的浓度,每次实验重复4次。
1.7 实时荧光定量PCR检测细胞中PTHrP、cbfα1、BMP- 2的基因表达量
细胞分组同方法1.6,干预后用RNAiso Plus提取各组细胞的总RNA,用Nanodrop 2000(Thermo,USA)测定总RNA的浓度及纯度,选择260/280nm处的吸光度比值在1.8~2.0的样品为可用样品。将选取的RNA样品逆转录合成cDNA,用特异性引物及SYBR Green预混液对逆转录产物进行荧光定量PCR检测。扩增反应条件:预变性94℃ 30s,变性94℃ 20s,延伸60℃ 20s,退火72℃ 30s,45个循环。以人的GAPDH为内标,以2- ΔΔCt法对目的基因进行定量分析。ΔΔCt=(目的基因ct- 管家基因ct)实验组-(目的基因ct- 管家基因ct)对照组。每组细胞设3个复孔,每次实验重复3次以上。用于基因序列扩增的引物序列见表1。
表1用于基因序列扩增的引物序列
Tab1PrimersequenceofGAPDH,PTHrP,Cbfα1andBMP- 2
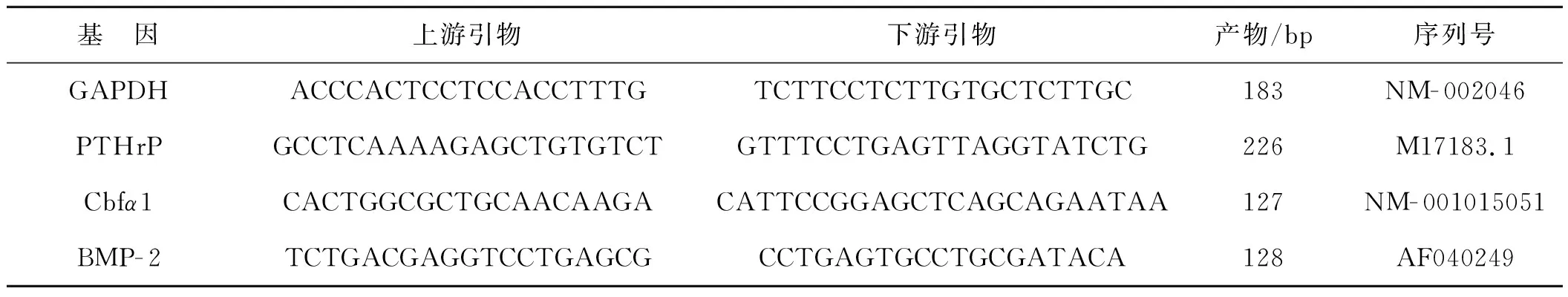
基 因上游引物下游引物产物/bp序列号GAPDHACCCACTCCTCCACCTTTGTCTTCCTCTTGTGCTCTTGC183NM-002046PTHrPGCCTCAAAAGAGCTGTGTCTGTTTCCTGAGTTAGGTATCTG226M17183.1Cbfα1CACTGGCGCTGCAACAAGACATTCCGGAGCTCAGCAGAATAA127NM-001015051BMP-2 TCTGACGAGGTCCTGAGCGCCTGAGTGCCTGCGATACA128AF040249
1.8 统计学处理
所有数据均为定量资料,以均数±标准差表示,用SPSS13.0统计软件包处理,组间分析采用方差分析,多重比较采用LSD-t检验,检验水准α=0.05。
2 结 果
2.1 不同浓度AGEs对人血管平滑肌细胞钙含量的影响
我们首先观察了不同浓度AGEs对人血管平滑肌细胞钙化的影响,所有细胞在同等条件下干预48h,与空白对照组细胞相比,400mg·L-1BSA处理组细胞的钙含量无明显变化,差异无统计学意义;而50、100、200、400mg·L-1AGE- BSA干预组细胞的钙含量与对照组相比,差异有统计学意义,且随着干预浓度的增加细胞钙含量逐渐增加,呈浓度依赖性(表2)。
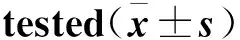

细胞分组钙含量/kg prot·L-1ALP/g prot·L-1空白组0.10±0.0118.63±2.71400mg·L-1BSA组0.46±0.1321.34±4.85a50mg·L-1AGE-BSA组0.91±0.08a28.13±1.87a100mg·L-1AGE-BSA组1.15±0.12ab31.48±0.82ab200mg·L-1AGE-BSA组3.46±0.07ab32.80±2.26ab400mg·L-1AGE-BSA组3.66±0.28ab34.35±1.65ab
a与空白对照组比较,P<0.05; b与400mg·L-1BSA组比较,P<0.05
2.2 不同浓度AGEs对人血管平滑肌细胞内ALP活性的影响
用不同浓度BSA及AGE- BSA与人血管平滑肌细胞在同等条件下共孵育48h,并设立细胞空白对照组,我们观察到:400mg·L-1BSA处理组细胞的ALP活性与空白对照组相比,差异无统计学意义;而与空白组及400mg·L-1BSA阴性对照组相比,50、100、200、400mg·L-1不同浓度AGE- BSA处理组细胞的ALP活性均明显增高,且AGE- BSA对细胞ALP活性的影响呈浓度依赖性(表2)。
2.3 AGEs对人血管平滑肌细胞分泌PTHrP的影响
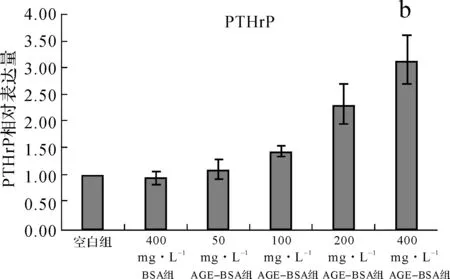
与空白组相比,400mg·L-1BSA对人血管平滑肌细胞分泌PTHrP的量无明显影响(P>0.05),而AGE- BSA在浓度为100、200、400mg·L-1时能够明显抑制细胞PTHrP的分泌量(P<0.05),且随AGE- BSA浓度的增加细胞分泌PTHrP的量逐渐减少,至400mg·L-1时达最少。见图1。
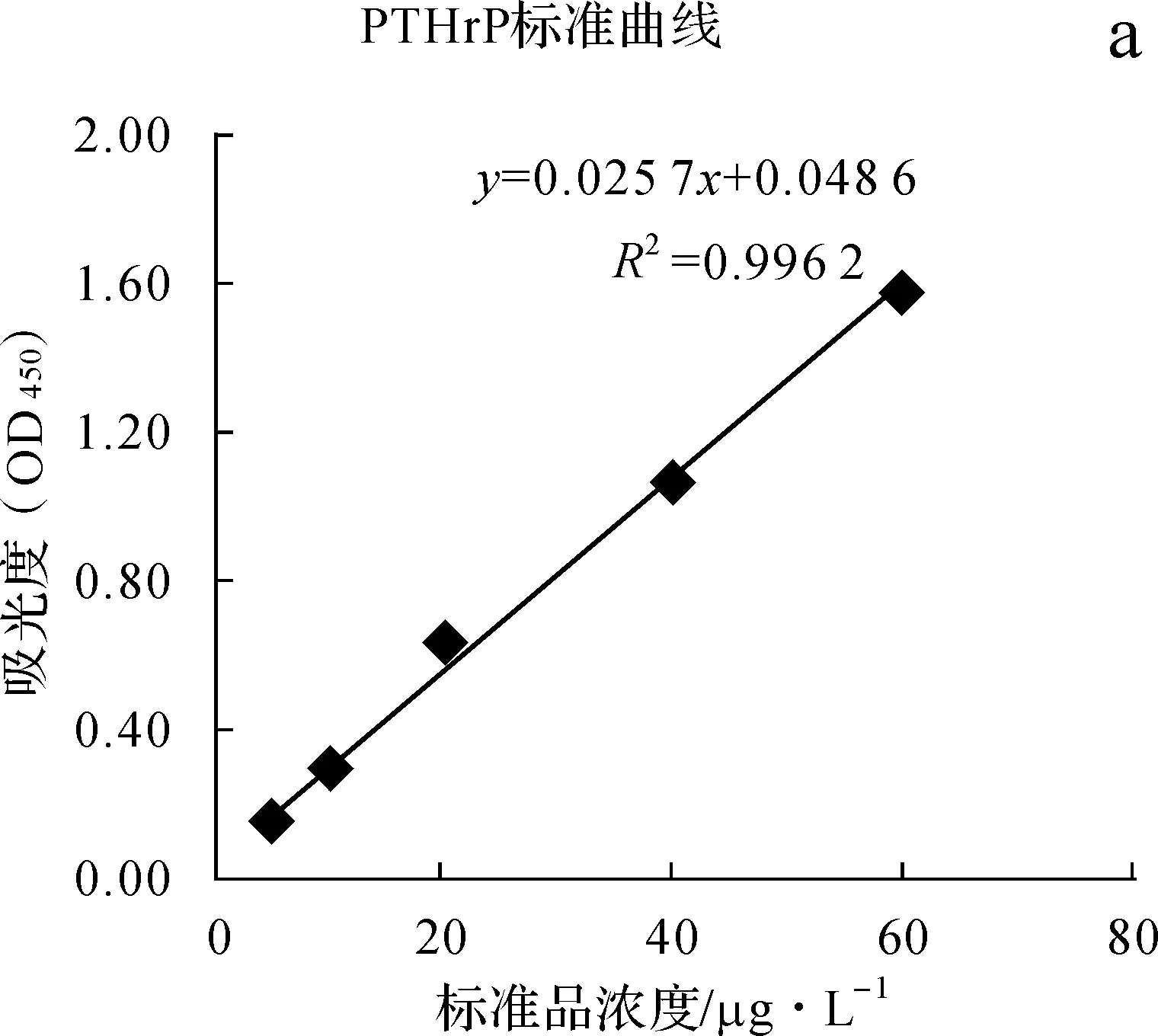

a.标准品浓度分别为5、10、20、40、60μg·L-1时在450nm处测得的吸光度值,并以浓度为横坐标、吸光度值为纵坐标所绘制的PTHrP标准曲线;b.各组细胞上清中的PTHrP含量比较
图1各组细胞PTHrP分泌量的比较
Fig1Comparisonoftheparathyroidhormonerelatedpeptideindifferentgroups
2.4 细胞内PTHrP、cbfα1及BMP- 2等的基因表达情况
与空白对照组相比,400mg·L-1BSA 干预组细胞的cbfα1、BMP- 2及PTHrP的基因表达水平均无明显变化(P>0.05),100、200、400mg·L-1AGE- BSA干预组细胞的cbfα1表达水平与对照组相比,差异具有统计学意义(P<0.05);而BMP- 2及PTHrP仅在200、400mg·L-1AGE- BSA组细胞的表达水平较对照组有明显升高(P<0.05),且随着干预浓度增加,三者在细胞中的表达量均呈逐渐增加的趋势。见图2。
3 讨 论
越来越多的证据表明,糖尿病患者多部位血管钙化的发生均与心血管事件的3~4倍高风险发生率相关联[7]。大量研究证实AGEs不可逆地形成与沉积是导致糖尿病血管钙化发生的关键环节[8],它可通过多种途径对血管壁的完整性及功能造成严重损害[9],进而加速糖尿病性动脉粥样硬化及晚期血管钙化的发生发展[10- 11]。多项研究表明AGEs对血管平滑肌细胞的这种致病效应是多种细胞因子及相关信号转导途径参与的复杂过程[12- 14],了解这些细胞因子及信号分子将有助于我们有针对性地对糖尿病血管钙化进行药物预防及干预。
我们前期的研究工作证实AGEs可通过RAGE途径诱导主动脉平滑肌细胞发生表型转变,从而促进血管钙化的发生[15]。然而,诱导血管钙化发生的确切机制仍在不断探索中。本实验以不同浓度AGEs干预人血管平滑肌细胞以相同时间,干预浓度范围选取在0~500μg·ml-1内,该浓度范围代表了AGEs在糖尿病患者血浆中的浓度[16]。实验结果提示低、中、高浓度AGE- BSA在干预血管平滑肌细胞48h后均可导致细胞间质钙盐沉积增加、ALP活性升高,而钙化诱导子cbfα1、BMP- 2等的表达水平仅在较高AGE- BSA浓度干预组明显增高,低浓度干预组增高不明显。该结果进一步证实了AGE- BSA可能是通过钙化上调子BMP- 2及cbfα1等的基因表达上调促进ALP活性增高,进而增加细胞钙盐沉积,导致血管钙化的发生。
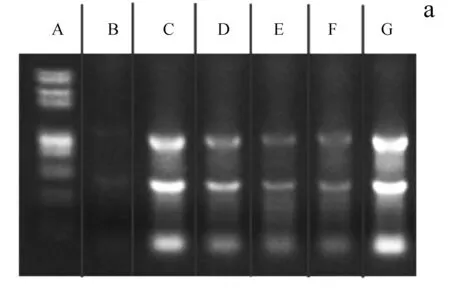


a.各组细胞干预后的总RNA琼脂糖凝胶电泳图谱:A为marker;B泳道为空白组细胞的RNA片段;C泳道为50mg·L-1AGE- BSA组细胞的RNA片段;D泳道为100mg·L-1AGE- BSA组细胞的RNA片段;E泳道为200mg·L-1AGE- BSA组细胞的RNA片段;F泳道为400mg·L-1AGE- BSA组细胞的RNA片段; G泳道为400mg·L-1BSA组细胞的RNA片段。b.各组细胞PTHrP的基因相对表达量。c.各组细胞的cbfα1基因相对表达量。d.各组细胞的BMP- 2基因相对表达量
图2RT-PCR检测的各组细胞PTHrP、cbfα1及BMP-2的基因表达量
Fig2ThemRNAexpressionofcbfα1andPTHrPdetectedbyRT-PCR
PTHrP与甲状旁腺激素有相同的氨基末端,是钙稳态的一个主要病理调节因子,也是心血管系统的一个关键调节物质,并且已证实该物质能诱导主动脉cbfα1的表达,而下调甲状旁腺激素水平能抑制大鼠已经诱导形成的血管钙化的发生发展。为了进一步探讨糖尿病血管钙化与PTHrP之间的相互关系,作者测定了AGEs促血管平滑肌细胞钙化过程中PTHrP的分泌量及其在细胞中的基因表达水平的变化情况,结果发现人血管平滑肌细胞分泌的PTHrP量随AGE- BSA干预浓度增加而逐渐减少。相反,钙化过程中PTHrP在干预后的人血管平滑肌细胞的基因表达水平逐渐升高。本研究结果提示AGEs对PTHrP在血管平滑肌细胞的分泌及表达有一定的影响,且内源性PTHrP的变化趋势与细胞钙化的趋势相反,而PTHrP在血管平滑肌细胞的表达水平变化趋势与细胞钙化的趋势一致,这些结果反映了PTHrP分泌与其基因表达的调节机制可能是不同的。事实上,PTHrP的分泌是以转录后水平由胞外钙离子浓度所调节的[17],所以,细胞外钙磷含量可能影响了PTHrP在血管平滑肌细胞的分泌水平,故而与其基因表达水平的变化不一致。
本实验进一步证实了AGEs对于平滑肌细胞分泌及表达PTHrP有一定的影响,且可促进钙离子沉积,进而引起血管平滑肌细胞钙化的发生。但是该实验仍有不足之处,需要在AGE- BSA的干预浓度范围及时间点上进一步完善,钙化调节因子及PTHrP的相关关系也有待于进一步研究。
[1] MARTIN T J,MOSELEY J M,WILLIAMS E D.Parathyroid hormone- related protein:hormone and cytokine[J].J Endocrinol,1997,154:23- 37.
[2] JUPPNER H,ABOU A B,FREEMAN M,et al.A G protein- linked receptor for parathyroid hormone and parathyroid hormone- related peptide[J].Science,1991,254:1024- 1026.
[3] JONO S,NISHHIZAWA Y,SHIOI A,et al.Parathyroid Hormone- related peptide as a local regulator of vascular calcification:its inhibitory action on in vitro calcification by bovine vascular smooth muscle cells[J].Arteriosclerosis,Thrombosis,and Vascular Biology,1997,17:1135- 114.
[4] LIU F,FU P,FAN W X,et al.Involvement of parathyroid hormone- related protein in vascular calcification of chronic haemodialysis patients[J].Nephrology,2012,17(6):552- 560.
[5] WON K B,CHANG H J,PRAK S H,et al.High serum advanced glycation end- products predict coronary artery disease irrespective of arterial stiffness in diabetic patients[J].Korean Circulation Journal,2012,42(5):335- 340.
[6] 方丽娟,刘乃丰.二甲双胍对糖基化终末产物诱导血管平滑肌细胞钙化的抑制作用[J].东南大学学报:医学版,2011,30(2):269- 273.
[7] RENNENBERG R J,KESSELS A G,SCHURGERS L J,et al.Vascular calcifications as a marker of increased cardiovascular risk[J].Vasc Health Risk Manage,2009,5:185- 197.
[8] The Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group.Retinopathy and nephropathy in patients with type 1 diabetes four years after a trial of intensive therapy[R].N Engl J Med,2000,42:381- 389.
[9] 吴春彪,陆军,王宸.晚期糖基化终末产物在骨性关节炎中的研究进展[J].现代医学,2012,40(3):356- 360.
[10] REN X,SHAO H,WEI Q,et al.Advanced glycation end- products enhance calcification in vascular smooth muscle cells[J].J Int Med Res,2009,37(3):847- 854.
[11] YAMAGISHI S.Glycation[J].Nippon Rinsho,2010,68(5):809- 813.
[12] TAKAHISA T,YOSUKE O,RENA T,et al.Advanced glycation end products induce calcification of vascular smooth muscle cells through RAGE/p38 MAPK[J].J Vasc Res,2009,46:572- 580.
[13] TOSHIHIRO S,TATSUYA L,TAKEHISA S,et al.Activation of receptor for advanced glycation end products induces osteogenic differentiation of vascular smooth muscle cells[J].J Atheroscler Thromb,2011,18:670- 683.
[14] 沈潇,刘乃丰.可溶性晚期糖基化终产物受体基础与临床研究新进展[J].东南大学学报:医学版,2013,32(3):364- 369.
[15] WANG Z Q,JIANG Y C,LIU N F.Advanced glycation end- product Nε- carboxymethyl- Lysine accelerates progression of atherosclerotic calcification in diabetes[J].Atherosclerosis,2012,221(2):387- 396.
[16] XU B,CHIBBER R,RUGGIERO D,et al.Impairment of vascular endothelial progenitor cells by modifying nitric oxide synthase activity by advanced glycation end products[J].FASEB J,2003,56(6):1289- 1291.
[17] AMANO K,HATA K,SUGITA A,et al.Sox9 family members negatively regulate maturation and calcification of chondrocytes through up- regulation of parathyroid hormone- related protein[J].Molecular Biology of the Cell,2009,20:4541- 4551.

