头孢三嗪对脑缺血/再灌注大鼠模型的神经保护作用
柴永宏
(山东医学高等专科学校内科学教研室,山东 临沂 276001)
大脑组织的能量储存能力很低,且脑组织中清除自由基的酶含量很少,因此脑组织对能量供应不足十分敏感,尤其容易受到氧自由基的损伤〔1〕。
自由基是强氧化剂,其脂质过氧化作用会直接造成细胞膜损伤,从而导致细胞死亡〔2〕。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及谷胱甘肽过氧化物酶(GSH-Px)均为内源性抗氧化剂,在氧化脑损伤中发挥重要的保护作用。加强脑组织的抗氧化能力有助于神经细胞从缺血/再灌注损伤中恢复。
有研究〔3〕报道β-内酰胺类抗生素有神经保护作用,在缺血性脑损伤中具有抗氧化作用。头孢三嗪是一种β-内酰胺类抗生素其杀菌机制为抑制细菌细胞壁黏多糖的合成。最近,研究〔4,5〕发现头孢三嗪在脑组织及神经系统中有抗氧化作用,但是,其在大鼠大面积脑缺血中的神经保护作用、组织氧化及抗氧化水平尚缺乏相关研究。本研究拟探讨头孢三嗪对急性脑缺血/再灌注损伤大鼠的神经保护作用。
1 材料与方法
1.1动物处理 分组:随机将50只Wistar大鼠分为3组:对照组(n=10),缺血/再灌注(I/R)组(n=20),I/R-头孢三嗪组(n=20)。对大鼠进行右侧大脑中动脉阻塞(MCAO)处理,并在90 min后再通血管,制作局灶性脑缺血大鼠模型〔3〕。使用水合氯醛将大鼠全麻后(400 mg/kg),在颈部中线作切口暴露右侧颈动脉分叉处,从颈外动脉近端插入栓子,进入颈内动脉后,继续插入栓子直至感到有轻微阻力,栓子到达大脑中动脉。栓子尾部留于切口外,90 min后,拔出栓子形成血液再灌注。
I/R-头孢三嗪组:在对大鼠进行MCAO处理后90 min给予头孢三嗪(200 mg/kg体重),一次注射给药。头孢三嗪的用量参照文献〔6〕。随机抽取10只大鼠,于再灌注30 min后断头处死,剩余大鼠继续观察。
I/R组:在对大鼠进行MCAO处理后90 min给予生理盐水,一次注射给药,给药剂量与I/R-头孢三嗪组头孢三嗪的用量相同。随机抽取10只大鼠,于再灌注30 min后断头处死,剩余大鼠继续观察。
对照组:接受相同的手术处理,只是不将栓子插入造成缺血;手术处理后90 min给予生理盐水,一次注射给药,给药剂量与I/R-头孢三嗪组中头孢三嗪的用量相同。
随后2 d观察动物的情况,第1天对其神经功能状态进行评估,第2天通过MRI观察梗死体积的变化情况。对所有大鼠进行为期4 w的观察,以评价长期死亡率。在操作过程中,大鼠的体温保持在(37±0.5)℃。
1.2脑组织样本提取 从I/R组及I/R-头孢三嗪组中,各随机抽取10只大鼠,于再灌注发生30 min后断头处死,快速分离左侧脑组织用于生化分析。将分离的脑组织储存于-70℃的环境中,直到进行丙二醛(MDA)及氧化氮(NO)水平、SOD及GSH-Px活性分析。
1.3生化分析 称重并均化样本脑组织(5 000 r/min离心2 min)。将所得匀浆离心60 min去除组织碎片获得上清液。一部分上清液保存于-40℃的环境中,1 w后检测GSH-Px的活性。一部分上清液与同等体积的乙醇混合,离心30 min,去上层清亮液体,用于检测SOD活性及蛋白质分析。所有的准备过程均在4℃的环境中进行。
1.4脑血流量监测 从手术开始至再灌注后30 min,使用超声多普勒流量计通过连接于大鼠颅骨的探头(大脑中动脉供血区上方)监测脑血流(CBF)的变化。如果在MCAO发生后CBF下降达75%及以上,手术被认为是成功的。
1.5神经功能评分 于MCAO发生后24 h及7 d对I/R组及I/R-头孢三嗪组剩余大鼠进行神经功能评分。使用Garcia等提出的18分神经功能评估系统对大鼠的不自主运动、运动障碍及感觉功能进行评价,严重损害为1或2级,未观察到神经功能缺损为3级。
1.6T2加权核磁共振成像 MCAO术后48 h对I/R组及I/R-头孢三嗪组剩余大鼠进行MRI T2加权像检查,分别计算病灶体积。

2 结 果
2.1脑血流监测 接受MCAO处理后,与基线水平相比,I/R-头孢三嗪组及I/R组所有动物CBF均下降大于75%,在撤出栓子后,单侧血流量恢复到基线水平的90%。在MCAO期间,CBF的下降及再灌注时CBF的恢复,两组之间没有明显差异。
2.2MDA,NO及抗氧化酶的检测结果 与对照组相比,I/R组的MDA水平明显增加(P<0.001),I/R-头孢三嗪组的MDA水平明显低于I/R组(P<0.05)。三组之间NO浓度无明显差异。与对照组相比,I/R组SOD水平明显降低,I/R-头孢三嗪组SOD水平明显高于I/R组。I/R组GSH-Px水平显著下降,I/R-头孢三嗪组GSH-Px水平高于I/R组。见表1。
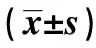
表1 各组大鼠脑组织MDA、NO的浓度及SOD、GSH-Px的活性比较
2.3神经功能评分 局灶性脑缺血处理后24 h,两组大鼠神经功能评分均明显下降,但与I/R组相比,MCAO后24、48 h,I/R-头孢三嗪组大鼠的神经功能评分下降的程度明显较低。MCAO后7 d,I/R-头孢三嗪组大鼠的神经功能评分比I/R组高。见表2。
经统计比较(两因素重复测量方差分析),三组间具有显著性差异,提示三组的大鼠神经功能评分总体上不同。时点间也具有显著性差异,提示各时点间大鼠神经功能评分有较大变化。组别和时点的交互作用也有统计学意义,提示三组的大鼠神经功能评分变化时间趋势有较大不同。该统计结论佐证了上面的分析。
2.4脑梗死病灶体积 I/R-头孢三嗪组(10只)的梗死体积〔(185±53)mm3〕明显小于I/R组〔7只,I/R组在接受MCAO处理后24 h内有3只死亡,梗死体积(271±45)mm3〕(t=3.49,P=0.003)。
2.5死亡率 I/R-头孢三嗪组的死亡率(0)明显低于I/R组(30%)。
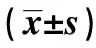
表2 各组神经功能评分比较
3 讨 论
脑卒中是引起成人死亡及残疾的第三大疾病〔7〕,目前治疗方法多限于血管再通或预防。很多研究指出,脑缺血发生时,神经细胞的损伤是一个动态过程,这为治疗干预及尽量挽救组织提供了几个小时的时间窗。由于在脑卒中急性期,脑组织神经保护物质明显下降〔8〕,很多研究致力于寻找能够缓解缺血后脑组织损伤的外源性神经保护物质。最终,很多不同的物质被指出在动物研究中能够改善脑缺血后的神经功能损伤情况,但是这些物质在临床上都未被证明有效〔9〕,而且这些物质均不能够减少脑卒中急性期的死亡率。本研究从检测组织氧化及抗氧化物质水平的改变,病灶体积,神经功能评分等方面表明头孢三嗪对急性缺血/再灌注脑损伤有神经保护作用。
目前主要有两个学说解释缺血/再灌注诱导的神经细胞死亡。一个是神经递质学说,该学说认为兴奋性毒性氨基酸的在大脑急性缺血期对神经细胞的损伤有重要作用;一个是自由基学说,该学说主要解释的是再灌注时脑组织内发生的一系列级联反应。ROS对磷脂的过氧化作用最终改变了细胞膜的结构。这些事件的发生为解释缺血/再灌注后延迟的神经细胞死亡提供理论基础。动物实验研究表明内皮黏附多形核白细胞,能够产生ROS及RNS,参与了缺血/再灌注的脑损伤。内源性神经保护因子的消耗与脂质过氧化产物的生成(如MDA)之间的平衡,决定了组织对氧化性损伤的抵抗力。SOD及GSH-Px是内源性抗氧化物质,能够保护组织免受氧化损伤。因此脑组织抗氧化物质活性增强,对于缺血/再灌注损伤后神经细胞的恢复有重要的积极作用。
据报道,头孢三嗪在多种神经系统疾病中有神经保护作用,如肌萎缩侧索硬化,多发性硬化,脑卒中,亨廷顿病等〔3,10〕。潜在的作用机制可能是提高谷氨酸转运蛋白-1的活性,增加神经细胞谷氨酸的摄入〔3〕。除了以调节谷氨酸代谢为基础的神经保护作用,还有研究发现β内酰胺类物质能够抑制次氯酸的氧化作用。还有研究发现给脑缺血的动物头孢三嗪后,一些神经营养因子,BDNF,NT3及神经营养因子受体,TrkB,在皮质梗死区周围区域均有增加。众所周知,神经营养因子能够通过减少细胞凋亡提高细胞的存活率〔11〕。
在脑缺血的动物模型中,MDA水平上升。本研究中,I/R-头孢三嗪组大鼠在接受头孢三嗪注射后,MDA水平下降提示头孢三嗪能够缓解脂质过氧化作用。在缺血的环境中,SOD形成了对抗再灌注时过度活性O2产生的主要防御系统。本研究结果表明在缺血发生后,头孢三嗪能够增加脑组织中SOD的水平,实现其抗氧化、神经保护作用。GSH是一种最重要的胞内非蛋白-巯基供给物质,在清扫自由基方面有重要的作用。本研究中,缺血/再灌注后GSH的水平轻度下降,这与其他的研究〔12〕结果一致。
本研究的结果提示头孢三嗪能够降低脑缺血/再灌注后大鼠的死亡率,改善神经功能缺损,而未伴随梗死体积的减小。曾有研究指出,MRI评估得到的脑梗死体积与大鼠神经功能缺损无相关性。而且有的研究指出尽管T2W-MRI评估发现梗死体积并未下降,但头孢三嗪能够显著增加缺血半暗带处的神经细胞数目〔13〕。可以从两个方面解释为什么半暗带存活神经元数目增加并不造成梗死体积的减小:T2WI-MRI在脑缺血发生后48 h仅反映的是水肿区,而不是真正的坏死区域;存活的神经细胞均匀分布于半暗带中,在边缘区并没有增多,因此不会造成MRI梗死灶缩小。
综上,头孢三嗪的抗氧化能力使其有显著的神经保护作用,能够减少MDA的过度产生,增加脑组织中的抗氧化物质,包括SOD及GSH-Px,并能够改善大鼠神经功能缺损的严重程度,降低大鼠死亡率。但是,头孢三嗪的神经保护机制还需要进一步研究。
4 参考文献
1Rodrigo J,Fernández AP,Serrano J,etal.The role of free radicals in cerebral hypoxia and ischemia〔J〕.Free Radic Biol Med,2005;39(1):26-50.
2蔡志福.氧自由基与心肌保护〔J〕.广西医学,2010;32(2):226-8.
3Rothstein JD,Patel S,Regan MR,etal.β-Lactam antibiotics offer neuroprotection by increasing glutamate transporter expression〔J〕.Nature,2005;433(7021):73-7.
4Hota SK,Barhwal K,Ray K,etal.Ceftriaxone rescues hippocampal neurons from excitotoxicity and enhances memory retrieval in chronic hypobaric hypoxia〔J〕.Neurobio Learning Memory,2008;89(4):522-32.
5Lewerenz J,Albrecht P,Tien MLT,etal.Induction of Nrf2 and xCT are involved in the action of the neuroprotective antibiotic ceftriaxone in vitro〔J〕.J Neurochem,2009;111(2):332-43.
6Li J,Culman J,Hörtnagl H,etal.Angiotensin AT2 receptor protects against cerebral ischemia-induced neuronal injury〔J〕.FASEB J,2005;19(6):617-9.
7于开军,崔 志,马福志,等.120例脑卒中所致精神障碍临床分析〔J〕.辽宁医学院学报,2012;33(2):140-1.
8邓 晓,秦 超.缺血性脑卒中颅内动脉狭窄的危险因素分析〔J〕.广西医学,2010;32(1):50-2.
9Yu GL,Wei EQ,Wang ML,etal.Pranlukast,a cysteinyl leukotriene receptor-1 antagonist,protects against chronic ischemic brain injury and inhibits the glial scar formation in mice〔J〕.Brain Res,2005;1053(1):116-25.
10Lipski J,Wan CK,Bai JZ,etal.Neuroprotective potential of ceftriaxone in vitro models of stroke〔J〕.Neuroscience,2007;146(2):617-29.
11Luo YW,Li CQ,Advancement in research on biological effects of proBDNF〔J〕.Prog Modern Biomed,2012;12(1):151-4.
12Ege E,Ilhan A,Gurel A,etal.Erdosteine ameliorates neurological outcome and oxidative stress due to ischemia/reperfusion injury in rabbit spinal cord〔J〕.Eur J Vasc endovasc Surg,2004;28(4):379-86.
13Thöne-Reineke C,Neumann C,Namsolleck P,etal.The 〔beta〕-lactam antibiotic,ceftriaxone,dramatically improves survival,increases glutamate uptake and induces neurotrophins in stroke〔J〕.J Hypertens,2008;26(12):2426-35.

