原花青素对HL-60细胞分化及凋亡的影响
谢朝阳 吴斌华 陈小芳 陈秋生 祝 娟 祝其锋
(广东医学院检验医学研究所,广东 湛江 524023)
原花青素(PAC) 以其高效、低毒、高生物利用度而被不断研究开发,研究表明PAC有抗动脉粥样硬化、抗氧化损伤等作用。本课题组前期研究结果提示PAC可剂量依赖性对抗Aβ25~35对PC12细胞的毒性作用,其保护神经元受损机制可能与逆转紊乱的细胞周期有关〔1〕。近来研究结果表明,PAC可抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡〔2〕,阻滞细胞周期〔3〕等,起到抗肿瘤的作用。但国内外关于PAC对白血病细胞的作用研究极少,本文以人急性髓细胞白血病细胞株HL-60为模型,探讨PAC对HL-60细胞增殖、分化及凋亡的影响。
1 材料与方法
1.1实验细胞、试剂、仪器 HL-60 细胞购于中科院上海细胞库。胎牛血清为杭州四季青生物工程材料有限公司产品;RPMI1640购自GIBCO公司;CD14、CD11b 为BD Pharmingen产品;CCK-8试剂盒购于碧云天;各种规格培养皿均为美国Corning Costar公司产品;其余试剂为国产分析纯。EPICS XL流式细胞仪为美国COULTER公司;OLYMPUS BX41光学显微镜为日本OLYMPUS,SSC-DC83P摄像头为日本SONY公司。M450型ELISA Reader 酶标仪为美国Bio-Rad公司。
1.2实验药物 PAC购于南京清泽医药公司,为葡萄籽提取物,质量分数大于95%,用DMSO溶解配成贮存液,DMSO终浓度<0.1%(V/V)。
1.3方法
1.3.1细胞培养 细胞培养在含12% 胎牛血清的RPMI1640培养液中(内含0.1% 青霉素),置于37℃、5%CO2孵育箱内备用。
1.3.2CCK-8法检测 HL-60细胞增殖抑制 用WST-8(CCK-8)细胞增殖及细胞毒性检测试剂盒检测。取对数生长期细胞,调节细胞数为1×105cells/ml,于96孔培养板中每孔加100 μl,细胞浓度为1×104cells/ml,加入不同终浓度的PAC,对照组除未加PAC外其余条件完全一致,置37℃、5%CO2、饱和湿度孵箱中培养24 h、48 h和72 h。培养至实验时间结束前3 h,各孔加入10 μl的CCK-8溶液,继续孵育3 h,测定450 nm处的OD值,重复三次,以药物浓度为横坐标,抑制率为纵坐标绘制增殖抑制曲线。
1.3.3细胞形态学观察 调整HL-60细胞数为2×105/ml,每孔2 ml种入6孔板中,加终浓度分别为20 mg/L、40 mg/L的PAC诱导24 h、48 h,离心收集细胞,用PBS洗2次,去上清,制细胞涂片,用Wright染色,光镜观察形态变化。
1.3.4流式细胞检测细胞周期变化 取对数生长期的HL-60细胞以3×108个/L接种于6孔板,每孔加2 ml,加入终浓度为20 mg/L、40 mg/L的PAC,培养24 h。收集细胞至1.5 ml EP管中,PBS洗2次,800 r/min 离心10 min,70% 乙醇-20℃固定过夜,用PBS洗1次,1 200 r/min离心10 min,每管加PI至终浓度为50 mg/L,37℃避光孵育30 min,过滤后上机检测。每个样品计数10 000个细胞,每组重复3次取平均值。
1.3.5细胞表面分化检测 调整HL-60细胞数为2×105/ml,每孔2 ml种入6孔板中,加终浓度分别为20 mg/L的PAC诱导24、48 h,采用FCM检测髓系主要分化抗原CD14 、CD11b表达变化。离心收集细胞,分别加入鼠抗人FITC-CD14单抗和PE-CD11b单抗5 μl,加PBS至100 μl ,4℃孵育30 min,PBS洗,1次,重悬于PBS,经400目尼龙网过滤,用流式细胞仪检测CD14和CD11b抗原表达。

2 结 果
2.1PAC对HL-60细胞生长增殖的影响 不同浓度PAC处理HL-60细胞24、48 h,用CCK-8法检测细胞存活率,结果显示作用24 h,随PAC浓度从5~40 mg/L逐渐增高,细胞存活率逐渐降低(P<0.05),表明PAC对细胞的抑制作用随浓度的增大而增强(图1)。当PAC浓度为20 mg/L时,HL-60细胞的增殖抑制率为(72.3±1.8)%,与对照组比较差异有统计学意义(P<0.05)。不同浓度PAC作用HL-60细胞48 h,增殖抑制率比24 h的稍高,但差异无统计学意义,且50 mg/L PAC作用HL-60细胞48 h,细胞出现死亡现象。
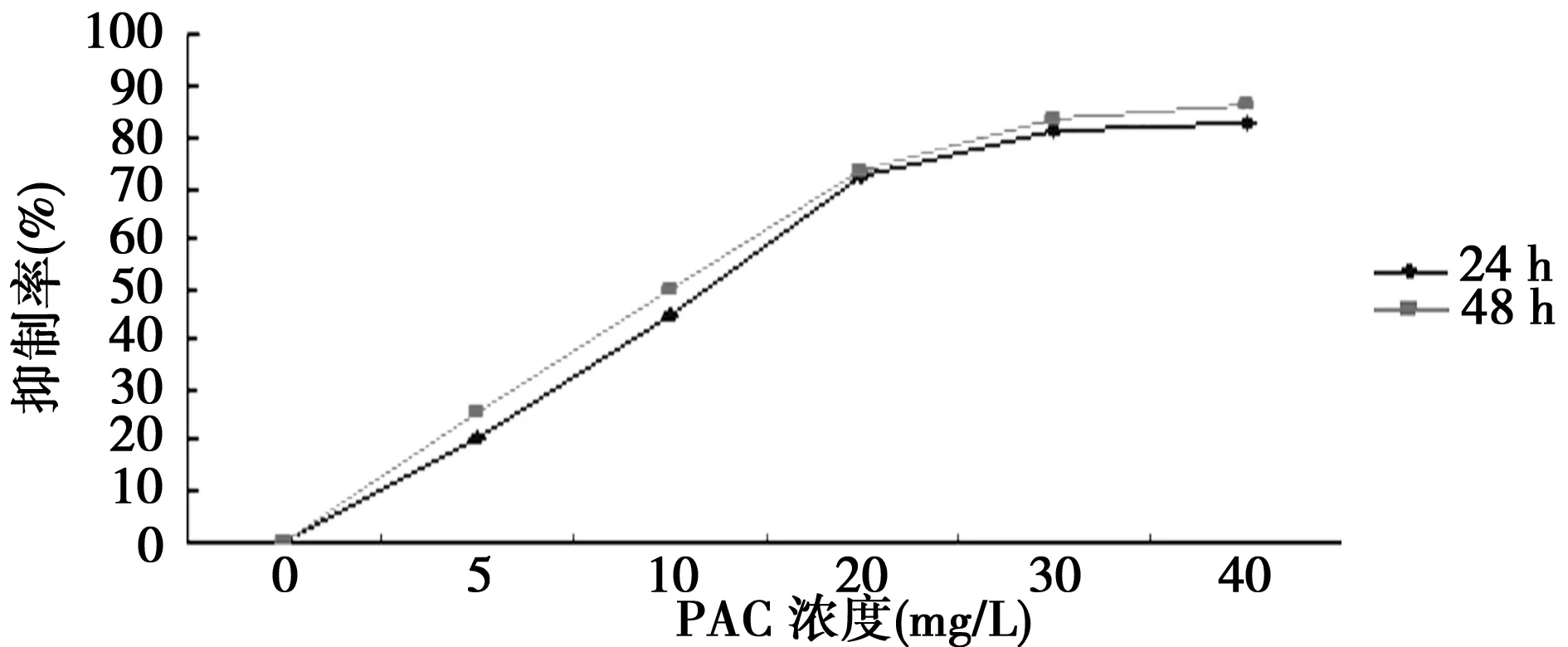
图1 PAC对HL-60细胞生长增殖的影响
2.2细胞形态学观察 细胞涂片经Wright染色,油镜下可见,未经药物作用的HL-60细胞胞体大、核大、多为圆形、核仁清晰、胞质深染、核质比例大。经20 mg/L PAC作用24 h,少数细胞出现核凹陷变形;作用48 h部分细胞体积变小,核形变得不规则,呈现肾形、分叶状等,核仁不清或消失,胞质变多,部分可见染粉红色,提示部分细胞分化为较成熟阶段细胞。而40 mg/L的PAC作用HL-60细胞48 h,细胞则出现凋亡改变,细胞核固缩、碎裂(箭头所示),见图2。
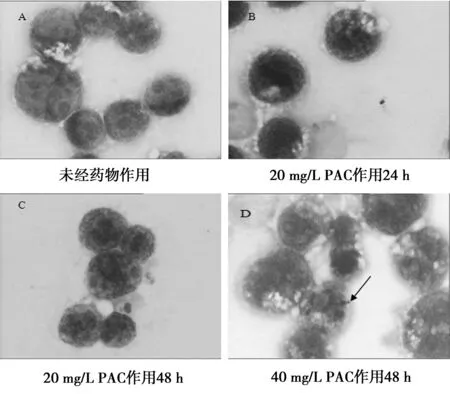
图2 HL-60细胞形态观察
2.3PAC对HL-60细胞细胞周期分布的影响 流式细胞术检测细胞周期结果显示,经PAC(5~20 mg/L) 处理24 h后,G0/G1期细胞呈剂量依赖性的上升,当PAC浓度为20 mg/L时,细胞周期G0/G1期百分比与对照组(46.3%)比较明显增高(77.5%)(P<0.05);S期细胞数明显减少(18.3%,对照组为45.5%)。而当PAC浓度为30 mg/L后,G0/G1期细胞百分率开始降低(50.2%),S期逐渐升高(35.1%)。而40 mg/L的PAC作用HL-60细胞24 h,G2/M期细胞百分比明显增高(22.4%),并出现凋亡峰。
2.4PAC影响HL-60细胞表面分化抗原的表达 20 mg/L的PAC诱导HL-60细胞24 h,流式细胞术检测髓系较成熟阶段细胞分化抗原CD14表达(15.78%)与对照组(0.33%)比较明显增高(0.89% vs 0.31%),CD11b表达稍增高,提示HL-60细胞向成熟阶段细胞分化。
3 讨 论
PAC是一类由葡萄、山楂、松树皮、银杏等植物中提取的多酚类聚合物。研究表明PAC能够减轻脑出血大鼠的细胞凋亡,其机制可能与PAC提高机体的抗氧化能力,同时增强抗凋亡基因bcl-2的表达,降低促凋亡基因bax 的表达有关〔4〕。PAC 可通过减轻脑水肿、改善脑组织的代谢障碍而对脑缺血发挥保护作用〔5〕。研究还表明PAC可以抑制消化道肿瘤、前列腺癌等多种肿瘤的生长,诱导肿瘤细胞凋亡〔6,7〕,提示PAC有可能成为极有希望的低毒、高效的抗肿瘤药物。但国内外关于PAC对白血病细胞作用的研究报道极少。Hu等〔8〕研究表明低剂量GSPE(葡萄籽原花青素)可诱导人急性髓细胞白血病14.3D10细胞凋亡,但对人正常外周血细胞无影响,提示PAC在治疗白血病方面具有一定的应用前景。本研究结果表明PAC可剂量依赖性抑制细胞的增殖,随着作用时间的延长,抑制率呈增高趋势,但差异不明显。提示PAC对HL-60细胞的生长增殖有抑制作用。Feng等〔9〕以花青素诱导氧化应激杀伤白血病细胞实验中,细胞双染色检测凋亡发现,当花青素浓度为50 μg/ml,培养18 h后,HL-60细胞发生凋亡。本文PAC致HL-60细胞凋亡浓度与其比较偏低,但诱导时间延长,推测为实验室间培养或细胞株来源差异所致。陈夏静等〔10〕用复方维甲酸注射液在诱导K562细胞分化成熟过程中CD14表达增高。许培权等〔11〕用全反式维甲酸对HL-60细胞诱导分化中CD11b表达增高。本实验CD11b表达稍增高。国内在利用诱导剂诱导白血病细胞分化研究多有CD11b表达增高,而Park等〔12〕则认为CD11b是细胞黏附分子整合素家族成员之一,参与细胞的黏附与迁移,最早检测到CD11b 是造血细胞发育过程中髓系祖细胞和原单核细胞阶段,随着进一步分化,其表达逐渐减低。提示CD11b在白血病细胞中的表达尚不明确。
本实验结果提示PAC能抑制HL-60细胞增殖,低浓度PAC能诱导其分化为较成熟阶段细胞,随浓度的增加分化效应反而降低,高浓度PAC则可能诱导HL-60细胞发生凋亡。表明PAC对急性髓系HL-60细胞株具有双效作用,其机制可能与细胞周期变化有关。
4 参考文献
1谢朝阳,梅寒芳,祝其锋,等.原花青素对Aβ25-35诱导PC12细胞周期紊乱的保护作用〔J〕.中国老年学杂志,2009;29(10):1197-200.
2Actis-Goretta L,Romanczyk LJ,Rodriguez CA,etal.Cytotoxic effects of digalloyl dimmer procyanidins in human caner cell lines〔J〕.J Nutr Biochem,2008;19(12):797-808.
3Kim M,Wu X,Song I,etal.Selective cytotoxicity of synthesized procyanidin 3-O-galloylepicatechin-4b,8-3-O-galloylcatechin to human cancer cells〔J〕.Cell Cycle,2008;7(11):1648-57.
4高 羽,董 志,徐 露.原花青素对实验性脑出血大鼠脑组织细胞凋亡及凋亡相关蛋白表达的影响〔J〕.中国药理学通报,2010;26(7):969-73.
5陈香红,张 艳.原花青素对大鼠脑缺血再灌注损伤代谢障碍的影响〔J〕.中国实用神经疾病杂志,2010;13(22):15-7.
6Miura T,Chiba M,Kasai K,etal.Apple procyanidins induce tumor cell apoptosis through mitochondrial pathway activation of caspase-3〔J〕.Carcinogenesis,2008;29(3):585-93.
7Kampa M,Theodoropoulou K,Mavromati F,etal.Novel oligomeric proan- thocyanidin derivatives interact with membrane androgen sites and induce regression of hormone-in-dependent prostate cancer〔J〕.J Pharmacol Exp Ther,2011;337(1):24-32.
8Hu H,Qin YM.Grape seed proanthocyanidin extract induced mitochondria -associated apoptosis in human acute myeloid leukemia 14.3D cells〔J〕.Chin Med J(Engl),2006;119(5):417-21.
9Feng R,Ni HM,Wang SY,etal.Cyanidin-3-rutinoside,a natural polyphenol antioxidant,selectively kills leukemic cells by induction of oxidative stress〔J〕.J Biol Chem,2007;282(18):13468-76.
10陈夏静,田 吉,何 兵,等.复方维甲酸注射液诱导K562分化及凋亡作用〔J〕.中药药理与临床,2011;27(2):64-7.
11许培权,龚建平.全反式维甲酸对HL-60细胞分化和凋亡的影响〔J〕.癌症,2004;23(2):118-23.
12Park H,Shelley CS,Arnaout MA.The zinc finger transcription factor ZBP-89 is a repressor of the human β2-integrin CD11b gene〔J〕.Blood,2003;101(3):894-902.

