人参皂苷Rb3保护低糖低氧/复氧诱导乳鼠皮层神经元凋亡的离子通道机制
王巧云 刘 凤 李金莲 杨 静
(滨州医学院基础学院,山东 烟台 264003)
人参皂苷Rb3是五加科植物人参、西洋参、三七等的主要药理活性成分,主要存在于人参的根、花蕾、茎叶和西洋参的根、茎叶以及三七的茎叶中。现代科学研究发现人参皂苷Rb3可显著保护脑缺氧缺糖导致的缺血损伤,机制可能保护线粒体功能、拮抗钙离子、抑制细胞凋亡及caspase活性有关〔1,2〕。目前,mitoKATPC通道在心脑保护中的地位已引起广泛关注,也有研究报道三七总皂苷(Rb3为主要成分之一)对心肌缺血再灌注损伤的保护作用与mitoKATPC开放有关。mitoKATPC是否也参与人参皂苷Rb3抗脑缺血缺性损伤的凋亡作用,尚未见报道。本研究以OGD/R皮层神经细胞为研究对象,观察人参皂苷Rb3的抗凋亡作用及离子通道机制。
1 材料与方法
1.1实验药物 人参皂苷Rb3 (南京泽朗医药科技有限公司,纯度为98%,批号: ZL201003)。
1.2动物 新生24 h Wistar大鼠,购自中国医学科学院实验动物研究所,合格证号:SCKX(京)2004-0001。
1.3试剂与仪器 MEM/F12培养基,购自Gibco公司;胰蛋白酶、Hochest 33342、5-HD,均购自Sigma公司;标准胎牛血清(FBS)、马血清为Hyclone产品;兔抗大鼠 MAP-2抗体、罗丹明标记的羊抗兔 IgG二抗由北京中杉试剂公司提供;兔抗PARP 为Santa Cruz 产品;Caspase-3活性检测试剂盒购自碧云天生物技术研究所;其他为国产分析纯。倒置相差显微镜(OLYMPUS-IX71),细胞培养箱(日本三洋公司),Spectra Max M5 酶标仪(Molecular Devices 公司),低温离心机(德国Beckman 公司)。
1.4方法
1.4.1大鼠皮层神经元的原代体外培养及鉴定〔3,4〕
1.4.1.1包被培养板 细胞培养前2 h,用0.1‰多聚赖氨酸(PLL)包被24孔培养板,置5% CO2培养箱中,使用前用D-Hank′s液冲洗干净。
1.4.1.2皮层的分离 取新生1 d的Wistar乳鼠,75%乙醇皮肤消毒后,剥离皮肤及颅骨,暴露并取出完整的脑组织,解剖显微镜下去除血管、脑膜及海马,分离出皮层组织。
1.4.1.3消化 用眼科剪将皮层组织剪成直径为1 3 mm3的小块,剪碎后移入无菌离心管中。加入0.125%的胰蛋白酶4 ml, 37℃消化约20 min。然后以完全培养基终止消化,离心(1 000 r/min)10 min。
1.4.1.4细胞收集 弃去上清液,加入DMEM完全培养液3~5 ml,以吸管轻轻吹打细胞至细胞分散,然后经200目筛网过滤收集细胞。
1.4.1.5细胞计数 取样,用计数器进行细胞计数,调整细胞浓度为106/L。接种1.0 ml/孔 于24孔培养板中,置5% CO2培养箱中,37℃培养。24 h后换液,以除去悬浮死亡的细胞。于接种的第3天,吸去培养基,加入终浓度为3 μmol/L的阿糖胞苷24 h(每孔1 ml),以抑制非神经元生长。以后每周换液2次,每次换半液,定时在倒置相差显微镜下观察细胞形态及生长情况,并进行显微摄影。培养置10~12 d开始试验。
1.4.1.6大鼠皮层神经细胞的鉴定-微管相关蛋白2(MAP-2)荧光染色检测 细胞培养第 10 天进行免疫细胞荧光染色检测,以证实其性质及纯度。过程如下:将培养液弃去,以 0.01 mol/L的PBS (pH 7.4,37℃)洗涤三次,4% 多聚甲醛室温固定 20 min,0.3% Triton X-100 作用 15 min 将细胞穿孔,再由 PBS 孵育 3×3 min,吸弃 PBS,滴加一滴 10% 羊血清,孵育10 min后弃去,各孔加入兔抗大鼠 MAP-2抗体(1∶400),4℃过夜,次日 PBS 冲洗后(3×10 min),滴加第二抗体-罗丹明标记的羊抗兔 IgG(1∶800),常温孵育2 h,孵育结束前 20 min 加入2 μg/ml的Hoechest 33342。由 PBS 冲洗 4×10 min,吹干后立即由缓冲甘油封固,置荧光显微镜下观察表达阳性的细胞,每孔随机取6个视野,记录3孔,计算阳性细胞数。
1.4.2原代神经元低糖低氧/复氧模型建立〔5〕制备模型前以无糖Earle′s平衡盐缓冲液冲洗4次,每次为原完全培养基体积的2/3,使葡萄糖终浓度小于1 mmol/L。每孔加入100 μl 终浓度为10 mmol/L Na2S2O4无糖Earle液,于CO2培养箱中孵育2 h,取出并吸弃平衡盐缓冲液,换以完全培养基,再置入CO2培养箱孵育24 h。
1.4.3实验分组及给药 将以上培养的细胞分为6组:正常对照组:正常换液培养;在制备OGD模型时同步换以含糖Earle液。低糖低氧再灌注损伤组(OGD/R):终浓度为10 mmol/L Na2S2O4无糖Earle液,于CO2培养箱中孵育2 h,取出并吸弃平衡盐缓冲液,换以完全培养基,再置入CO2培养箱孵育24 h,模拟体内缺血再灌注的过程。人参皂苷Rb3组、5-HD组:换以完全培养基后,分别加60 mol/L人参皂苷Rb3、5-HD,作用30 min后行OGD/R损伤。60 mol/LRb3+5-HD组:人参皂苷Rb3作用15 min后,加入5-HD,15 min后行OGD/R。
1.4.4荧光素染料Hoechst33342测定皮层神经元凋亡 模型制备结束,吸除培养液, PBS 清洗三次,加入染色液(Hoechst 33342/DMEM,5 μmol/L),37℃、5% CO2培养箱避光染色10 min,无血清无酚红培养剂清洗三次,于倒置荧光显微镜下观察(激发波长在350 nm左右,发射波长在460 nm左右)细胞核染色情况。并于20×10高倍镜下每个培养孔随机取5个不同视野,计算凋亡率(凋亡细胞数/总细胞数),以反应皮层神经元凋亡程度。
1.4.5Western 印迹检测PARP的表达 细胞经处理后收集,细胞裂解液冰上裂解15 min,13 000 r/min离心20 min 后提取上清液即为细胞总蛋白质。每泳道取50 mg 蛋白质在10%的SDS-聚丙烯酰胺凝胶中电泳, 将蛋白转移到硝酸纤维素膜上,封闭液(TBS+5%脱脂奶+5% tween 20)室温封闭1 h,加入一抗(1∶5 000兔抗PARP)封闭后,作用3 h,取出膜,用TBS-T漂洗膜10 min×3 次,洗涤后加入辣根过氧化物酶耦联的二抗(1∶2 000)室温封闭30 min。室温摇床上持续平缓摇动1 h,TBS-T 漂洗膜10 min×3 次。化学发光法(ECL) 曝光胶片,显色检测相应蛋白条带。
1.4.6caspase-3 活性测定 活化的caspase-3 可催化底物Ac-DEVD-pNA,产生黄色的pNA,从而可以通过测定吸光度来检测caspase-3 的活性。同上收集细胞总蛋白。caspase-3 活性检测于96 孔板中进行,每孔加入待测样品40 μl,caspase-3 底物20 μmol/L,终体积为100 μl,并设置空白对照。混匀后37℃孵育2 h,于405 nm 处测定OD值。实验过程中同时制备pNA标准曲线。最终caspase-3的活性以正常对照组为标准,其余各组与之相比表示。
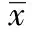
2 结 果
2.1大鼠原代皮层神经细胞体外培养及鉴定结果 神经细胞培养至第10天胞体饱满,背景清晰,折光性强,突起分支较多且形成网络(图1)。MAP-2在神经细胞的胞浆和突起中呈阳性表达,其免疫荧光染色能够反映出细胞性质及纯度。对培养至10 d的大鼠皮层神经细胞进行细胞免疫荧光化学检测,结果显示细胞胞体饱满,突起粗大,胞质内颗粒明显,与形态学检测结果相吻合,提示神经细胞生长良好。经鉴定,神经细胞的纯度为 81.34%(图1)。

图1 原代培养大鼠皮层神经元(×400)
2.2荧光素染料Hoechst33342测定人参皂苷Rb3对OGD/R诱导皮层神经元凋亡的影响 Hoechst 33342是一种亲嗜DNA 的荧光染料,与DNA 发生特异性结合后,在荧光显微镜下可检测到蓝色荧光,清楚地显示核的形态、大小及核质的密度。正常细胞呈均匀的蓝色荧光,细胞核膜光滑无皱缩、无浓缩及碎裂征,可见圆形细胞核;OGD/R损伤后,细胞核皱缩变小,密度增加,并发生浓缩,碎裂呈三角形、圆形或多边形的团块;正常对照组皮层神经元的凋亡率为(2.67±0.42)%,OGD/R组表现出明显的细胞凋亡,凋亡率为(47.12±1.23)%;与OGD/R组比较,人参皂苷Rb3组(60 mol/L)可以降低OGD/R后皮层神经元的凋亡率(26.641±1.35)(P<0.01)。但5-HD则削弱了人参皂苷抗OGD/R损伤的细胞凋亡作用,使5-HD组及人参皂苷Rb3+5-HD组细胞凋亡率分别为(44.32±2.44)%及(37.12±1.23)%。见图2。
2.3人参皂苷Rb3对OGD/R损伤后细胞中PARP的影响 如图3所示,在正常培养的神经细胞中,PARP表达较高(1.00±0.03);而OGD/R损伤后,PARP的表达明显减低(0.58±0.13),提示表明其完整性被破坏;人参皂苷Rb3作用后明显提高了PARP的表达水平(0.88±0.07),与OGD/R损伤组相比具有显著的统计学差异(P<0.01),提示人参皂苷Rb3能够通过维持PARP的完整性而对皮层神经细胞发挥保护作用。5-HD亦使PARP的完整性受到破坏,与OGD/R组无显著性差异(0.64±0.07,P>0.05)。但5-HD减弱了人参皂苷Rb3引起的PARP完整性作用(0.76±0.04,P<0.01)。

图2 Hoechst 33342染色示OGD/R诱导致皮层神经元细胞核的形态学改变(×400)
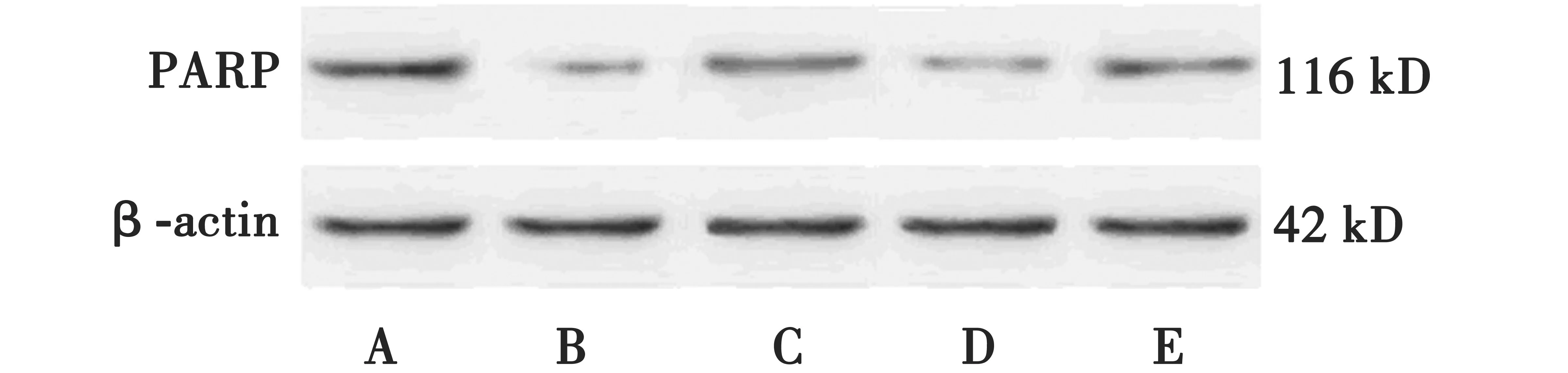
A:正常对照组;B:OGD/R组;C:人参皂苷Rb3组;D:5-HD组;E:人参皂苷Rb3+5-HD组
2.4人参皂苷Rb3 对OGD/R损伤后细胞中caspase-3活性的影响 在正常情况下,caspase-3 活性较低(1.00±0.04);OGD/R后,神经细胞内caspase-3 的活性明显升高(3.53±0.19),约为损伤组的3.14 倍;人参皂苷Rb3明显降低了caspase-3 的活性(1.71±0.13,P<0.01)。而应用5-HD后,caspase-3 的活性增高,与OGD/R损伤组相比无统计学差异(3.08±0.12,P>0.05)。但5-HD削弱了人参皂苷Rb3对caspase-3活性的抑制作用,使caspase-3活性约增加1.43倍(2.45±0.16)。
3 讨 论
mitoKATP是一种存在于心肌细胞线粒体膜上的主要钾通道,近年来,mitoKATP的激活在脑缺血缺氧保护中的作用越来越引人注目,大量研究显示在脑缺血缺氧过程中,mitoKATP开放,K+内流,膜去极化,减轻线粒体内Ca2+超载;减少自由基损伤,维持线粒体膜稳定性,延缓和减轻细胞凋亡〔6,7〕。
本研究通过缺氧复氧成功诱导了乳鼠神经元凋亡,通过DNA荧光染色Hoechst染色观察到人参皂苷Rb3干预后对体外培养神经细胞凋亡影响。实验发现,人参皂苷Rb3可以明显降低缺氧/复氧后神经元的凋亡率,改善细胞形态。在应用人参皂苷Rb3预处理的同时应用mitoKATPC特异阻断剂5-HD则消弱了其抑制神经元凋亡作用。
PARP是定位在细胞核内,在应激条件下与DNA修复密切相关的一种酶,它的存在对于细胞的稳定和存活非常重要。PARP在体外可以被多种caspases剪切,在体内则是caspase-3的主要剪切对象,因此,PARP的剪切被认为是细胞凋亡的一个重要指标,也通常被认为是caspase-3激活的指标。在正常培养的神经细胞中,PARP表达较高,caspase-3活性也较低;而OGD/R损伤后,PARP的表达明显减低,提示其完整性受到破坏,同时凋亡蛋白caspase-3活性增强,神经元凋亡率增高;人参皂苷Rb3明显提高了PARP的表达水平,降低了caspase-3活性,与OGD/R损伤组相比具有显著统计学差异。而5-HD则削弱了人参皂苷Rb3对PARP完整性的维持,增强了caspase-3的活性,促使神经元凋亡,即5-HD抑制了人参皂苷Rb3的抗凋亡作用。由此推测,人参皂苷Rb3可能通过开放mitoKATPC,抑制激活的caspase-3对其特异性底物进行裂解而缓解细胞凋亡,起到脑缺血保护。
4 参考文献
1李桂生,田京伟,傅风华,等.人参皂苷Rh3对脑缺血大鼠脑线粒体损伤的保护作用〔J〕.中国新药杂志,2006;15(7):518-21.
2Zhu JR,Tao YF,Lou S,etal.Protective effects of ginsenoside Rb(3) on oxygen and glucose deprivation-induced ischemic injury in PC12 cells〔J〕. Acta Pharmacol Sin,2010;31(3):273-82.
3Ban JY,Jeon SY,Nguyen TT,etal.Neuroprotective effect of oxyresveratrol from smilacis china erhizome on amyloid Beta protein (25-35)-induced neurotoxicity in cultured rat cortical neurons〔J〕.Biol Pharm Bull, 2006;29(12):2419-24.
4Rui Liu,Mei Gao,Zhi-Hong Yang,etal.Pinocembrin protects rat brain against oxidation and apoptosis induced by ischemia-reperfusion both in vivo and in vitro〔J〕.Brain Res, 2008;1216(8):104-15.
5Sun Y,Tian YK,Wang P.Rat hippocampal neuron culture in vitro〔J〕. Chin J Anesthesiol,2004;5(24):396-7.
60′Rourke B.Evidenee for mitochondrial K+channels and their role in cardioprotection〔J〕.Cric Res,2004;94(4):420-32.
7Xu M,Wang Y,Ayub A,etal.Mitochondrial KATP channel activation reduces anoxic injury by restoring mitochondrial membrane potential〔J〕. Am J Physiol Heart Circ Physiol,2001;281(3):1295-303.

