重组腺相关病毒介导神经肽Y基因转染对红藻氨酸致痫大鼠海马P35表达的影响
张新颖 娄 燕 李文玲 董长征 赵文清
(河北省人民医院儿科,河北 石家庄 050051)
神经肽Y(NPY)及其受体与癫痫的发生密切相关〔1〕,Woldbye等〔2〕研究显示脑室内注射NPY能抑制运动性癫痫发作,并能大幅度减少在齿状回和CA3区记录到的由红藻氨酸(KA)诱发的癫痫脑电,起到一定程度的抗惊厥作用。P35是细胞周期蛋白依赖性蛋白激酶5(Cdk5)激活剂,Cdk5持续激活可诱发海马苔藓纤维出芽(MFS)和突触重建,从而促进癫痫的反复发作〔3,4〕。董长征等〔5,6〕前期实验已应用免疫荧光染色方法证明rAAV2/1-hNPY-EGFP在癫痫病理状态下的脑组织中可以实现有效表达,且脑室注射途径优于海马注射途径,本实验采用多次KA海马内注射制成大鼠慢性癫痫模型〔7〕,并通过脑室注射携带人源性神经肽Y(hNPY)基因的腺相关病毒载体,运用荧光定量PCR及免疫组织化学技术检测癫痫大鼠海马组织中NPY及P35 mRNA和蛋白水平。
1 材料与方法
1.1实验动物与分组 清洁级健康雄性老年Wistar大鼠96只,体重250~270 g〔由河北医科大学实验动物中心提供,许可证:SCXK(冀) 2008-1-003,合格证编号:1103040〕,于河北省人民医院临研中心动物室分笼喂养,20℃~26℃环境温度,自由进食水。采用随机数字法分为A、B、C、D 四组,每组24只。
1.2主要实验试剂和设备 介导人源性神经肽Y治疗基因和增强型绿色荧光蛋白(EGFP)报告基因的rAAV2/1-hNPY-EGFP载体由北京本元正阳基因技术有限公司提供,有效滴度为5×1011/ml;(KA批号079k1737) 购自美国Sigma公司;立体定向仪购自深圳市瑞沃德生命科技有限公司;兔抗NPY多克隆抗体购自北京博奥森公司;兔抗P35多克隆抗体购自美国Bioword公司; Trizol试剂、PCR扩增试剂盒购自北京康为世纪生物科技有限公司;荧光定量PCR逆转录试剂盒购自北京全式金生物技术有限公司。
1.3慢性癫痫模型的建立 根据参考文献〔5〕方法建立慢性癫痫模型。先用10%水合氯醛(35 mg/kg)腹腔注射麻醉大鼠,然后将其固定于立体定向仪上,剪除术区毛发,75%的酒精消毒处理后沿大鼠头顶部正中线纵行切开头皮,切口长约3 cm,用头皮拉钩将头皮向两侧对称地拉开并固定, 根据George Painos大鼠脑立体定位图谱,确定大鼠右侧海马CA3区中心点的三维坐标: X=-5.3 mm,Y=4.0 mm, Z=-6.0 mm, 即为海马区注药点。用电钻在颅骨上钻孔,微量进样器抽取KA 2 μl (浓度0.4 μg/μl) 于20 min内匀速注射至大鼠海马的CA3区, 留置5 min后,缓慢退出微量进样器。此后,每间隔2 d重复注射1次,剂量同前,共注射KA 5次,D组注射同等容量的生理盐水。依据Racine分级标准,至少连续出现3次Ⅳ级或以上的惊厥发作被认为完全点燃。造模成功的大鼠随机分为A组、B组和C组。A组不做任何处理,B组和C组接着进行基因转染手术。
1.4基因重组体注射 造模成功后1周再次将大鼠麻醉,确定大鼠侧脑室注射靶点的三维坐标:X=-1.0 mm,Y=1.5 mm,Z=-3.8 mm, 在立体定向仪辅助下,B组用微量进样器向靶点注射rAAV2/1-empty-EGFP,注射量10 μl,滴度为5×1011/ml,注射时间20 min,注射速度0.5 μl/min, 注射完毕后用少量无菌骨蜡封闭骨孔,缝合头皮。C组用同样的方法注射等量的rAAV2/1- hNPY-EGFP。
1.5大鼠海马NPY及P35的免疫组化染色及图像分析 在基因导入后2 w和4 w,随机选取不同实验组和对照组大鼠各12只,每个时间点6只,腹腔注射10%水合氯醛(35 mg/kg)麻醉,4%多聚甲醛灌注固定,取含有海马的中段脑组织,石蜡包埋,冠状位连续切片,片厚5 μm,每隔5张取1张,以链霉菌抗生素蛋白-过氧化酶S-P免疫组化染色法行NPY及P35的免疫组化染色。免疫组化结果判定方法:对染色反应阳性强度进行半定量分析。染色强度以多数细胞为准,染色呈浅棕黄色为弱阳性,呈深黄色为阳性,呈深棕褐色为强阳性。阳性细胞数的计量方法为,观察10个固定高倍视野,每个高倍视野计数100个细胞中阳性细胞的数目,最后取其均值。阳性细胞数量<10%为阴性;10%~50%为弱阳性; 50%~80%为阳性;80%~100%为强阳性。
1.6大鼠海马NPY及P35的荧光定量PCR检测 在基因导入后2 w和4 w,随机选取不同实验组和对照组大鼠各12只,每个时间点6只,迅速分离海马,Trizol提取海马总RNA,测定其浓度及纯度。每个样品取2 μl RNA反转录合成cDNA,再各取1 μl cDNA进行PCR扩增。引物序列: NPY上游: 5′-TCGTGTGTTTGGGCATTCTG-3′,下游5′-TCAGTGTCTCAGGGCTGGAT-3′,扩增长度164 bp。P35上游: 5′-ACACTGTTTGAGGATGGCG-3′,下游: 5′-TGGCGTTCTTGCTGTTCT-3′,扩增长度为67 bp。为了准确检测表达水平,选用大鼠GAPDH cDNA序列作为内参照。GAPDH上游: 5′- ACCACAGTCCATGCCATCAC-3′;下游5′-TCCACCACCCTGTTGCTG-3′;扩增长度为452 bp。引物由上海生物工程有限公司采用美国PE公司391型DNA自动合成仪合成。PCR条件为: 96℃预变性4 min,94℃变性30 s,58℃退火30 s,72℃延伸30 s,进行40个循环,在每个循环的第三步72℃ 30 s收集荧光信号。扩增完毕后,进入结果分析界面,以GAPDH为内参照基因,与对照组相比,得到目的基因表达的相对定量值(RQ值)用于统计学分析。
1.7统计学分析 应用SPSS13.0统计软件进行Kruskal-WallisH检验。
2 结 果
2.1大鼠海马NPY及P35的免疫组织化学结果 海马各区NPY均有表达,其阳性神经元胞体呈圆形或椭圆形,着色部位为胞质,颜色呈棕褐色,并可见NPY阳性纤维的表达。基因转染后2 w和4 w,与D组相比,A组、B组和C组大鼠海马CA3区NPY阳性神经元表达均增多,着色加深。与A组及B组相比,C组在2 w时NPY阳性神经元表达无明显差异,但在4 w时其表达量明显高于A组和B组,着色加深。见图1,表1。
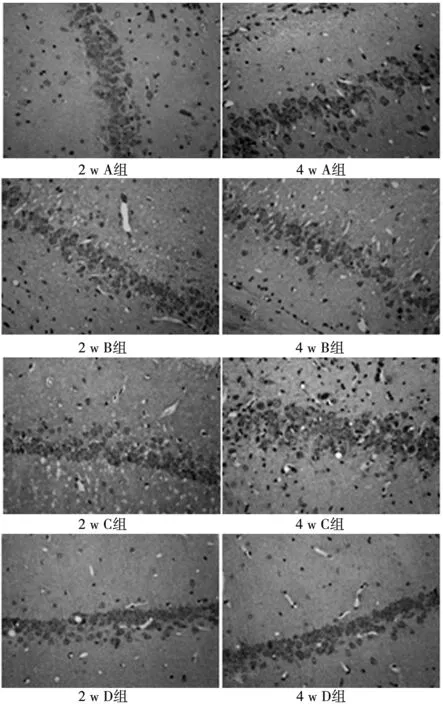
图1 大鼠海马CA3区NPY表达(DAB,×400)
P35阳性神经元在各组大鼠海马中均有表达,呈现胞体圆形或椭圆形,着色部位为胞核,颜色呈棕褐色,海马各区均有分布,主要位于大鼠海马CA3区和CA1区锥体细胞、齿状回颗粒细胞以及门区神经元胞体和突起内。在基因转染后2 w和4 w,与D组相比,A组、B组和C组大鼠海马CA3区P35阳性神经元表达均增多,着色加深。与A组及B组相比,C组在2 w时海马组织中P35阳性神经元表达无明显差异,但在4 w时海马组织中表达量明显低于A组和B组,着色变淡。见图2,表1。
2.2大鼠海马NPY及P35 mRNA的表达 在基因转染后2 w和4 w,与D组相比,A组、B组和C组NPY、P35 mRNA表达均高于对照组(P<0.05)。与A组及B组相比,C组在2 w时海马组织中NPY、P35 mRNA表达无明显差异(P<0.05),但在4 w时NPY mRNA表达量明显高于A组和B组(P<0.05),见表2。而P35 mRNA表达量明显低于A组和B组(P<0.05)。见表2。

表1 各组大鼠海马CA3区NPY表达免疫组化结果
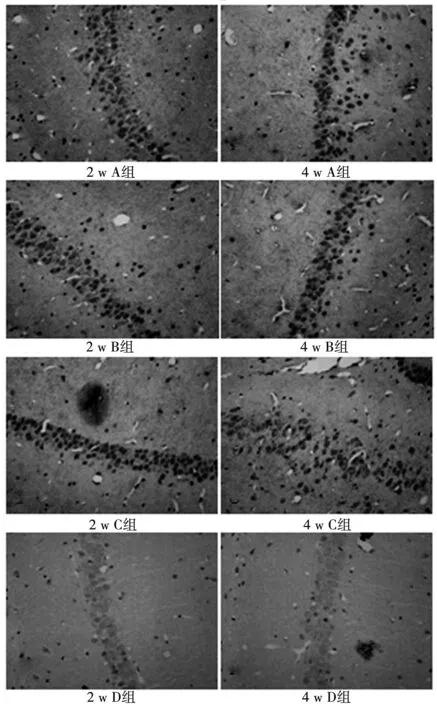
图2 大鼠海马CA3区P35表达(DAB,×400)

表2 各组大鼠NPY、P35 mRNA表达比较±s,n=12)
3 讨 论
随着分子生物学的发展,以及人们对癫痫发病过程及机制研究的不断深入,难治性癫痫的基因治疗已成为神经分子生物学领域的研究焦点之一。重组腺相关病毒(rAVV)作为转基因载体具有安全性好,免疫原性低,能够高效、稳定、长期表达目的基因等优点, 成为目前倍受关注且具广泛应用前景的载体工具之一〔8〕。本实验将介导NPY基因的腺相关病毒载体,通过脑室注射的方法转染至脑内特定靶区,观察NPY基因对慢性癫痫大鼠海马组织中P35表达的影响,以探讨其在癫痫发病机制中的作用以及NPY基因治疗慢性癫痫的可能机制。
NPY即神经肽酪氨酸,是Tatemoto等于1982年首先从猪脑中提取,由36个氨基酸组成的神经肽,作为神经递质或神经调质广泛分布于中枢及外周神经系统。NPY在中枢神经系统中主要分布在大脑皮层、海马、丘脑、下丘脑及脑干等处,尤以海马内浓度最高。许多研究发现NPY具有明显的抗癫痫作用。董长征等〔5〕的实验结果表明,rAAV2/1-hNPY-EGFP基因转染可以抑制KA诱导的大鼠癫痫发作和海马神经元放电,并进一步利用电生理学方法观察到NPY可以抑制大鼠海马神经元癫痫样电活动,具有降低神经细胞兴奋性的作用〔9,10〕。有研究显示在培养的神经元中发现NPY能够通过Y2受体抑制突触前膜神经元的N型Ca2+通道,降低细胞内Ca2+水平,抑制钙超载,从而维持了细胞内Ca2+的自稳态〔11〕,并抑制同一神经末梢谷氨酸的释放,降低神经元的兴奋性。但关于NPY抗癫痫作用机制的研究,目前尚处于探索阶段,有很多问题期待解决。
Cdk5是脯氨酸限定性Ser/Thr蛋白激酶,参与有丝分裂后神经元的蛋白磷酸化,可分别在KSPXK基序和KSPXX基序磷酸化tau蛋白和神经丝蛋白,调节细胞骨架的稳定性,影响轴突的形态和功能〔12〕。Cdk5主要通过与调节亚单位P35结合而被激活,P35主要分布于中枢神经系统梨状皮层、海马(CA1、CA3、齿状回)、杏仁核和内嗅皮层的分化神经元中(尤以海马内浓度最高),是Cdk5主要的调节亚基,又被称为神经元Cdk5激活剂。虽然Cdk5在细胞和组织中广泛表达,但其蛋白激酶活性却主要局限于大脑皮层,尤其是海马神经元中。实验表明,Cdk5与其调节蛋白p35在癫痫的发生发展过程中起着非常重要的作用。Cdk5/p35共同参与了神经元骨架蛋白-tau蛋白的磷酸化过程,导致其磷酸化水平的变化,进而诱发海马MFS和突触重建〔13〕,从而在癫痫的反复发作中起重要作用。
董长征等〔5〕前期实验已应用免疫荧光染色方法证明rAAV2/1-hNPY-EGFP在癫痫病理状态下的脑组织中可以实现有效表达,并观察记录了NPY基因过表达对KA诱导慢性癫痫大鼠发作的影响,结果提示,大鼠脑电变化与癫痫大鼠惊厥行为变化相吻合,在癫痫形成中NPY能明显抑制KA诱导慢性癫痫大鼠海马神经元放电和癫痫发作。本研究结果显示,rAAV2/1-hNPY-EGFP脑室内注入可以通过使NPY过表达产生明显的抗癫痫作用。与此同时A组在注射后2 w和4 w,致痫大鼠反复自发性抽搐发作时,P35 mRNA及蛋白表达均明显升高,提示KA诱发癫痫的机制可能与KA影响P35转录及蛋白水平的表达有关。有研究表明:癫痫反复发作P35的过表达,可激活Cdk5,引起一系列病理生理变化,使神经元处于过度兴奋状态,最终导致脑功能障碍〔14〕。本实验研究说明NPY的基因过表达有可能是通过下调P35的异常表达而发挥抗癫痫作用,其直接原因有可能是NPY通过降低P35的表达水平,抑制了Cdk5的蛋白激酶活性,使Tau蛋白磷酸化水平发生变化〔3,4〕,从而减弱了MFS和突触重建〔15〕造成的大脑结构功能的异常改变〔14〕,最终发挥NPY抑制癫痫发作及其神经元保护的作用。
总之,腺相关病毒载体介导NPY为临床基因治疗难治性癫痫提供了一种新的思路和途径,本研究在前期工作的基础上进一步研究了NPY基因抗癫痫的可能机制,但其安全性、有效性及其更加完善的抗癫痫机制有待继续深入研究。
4 参考文献
1Cristina R,En-Ju DL, Daniela S,etal. Anticonvulsant and antiepileptogenic effects mediated by adeno- associated virus vector neuropeptide Y expression in the rat hippocampus〔J〕.J Neurosci,2004;24(3):3051-9.
2Woldbye PD, Mikael A. Adeno-associated viral vector-induced overexpression of neuropeptide Y Y2 receptors in the hippocampus suppresses seizures〔J〕.Brain,2010;133(9): 2778-88.
3田发发, 郭婷辉, 陈金梅, 等. 戊四氮点燃模型大鼠海马苔藓纤维出芽与Cdk5/p35表达的动态变化〔J〕. 中南大学学报(医学版), 2008;33(12): 1101-7.
4Tian FF, Guo TH, Chen JM,etal. Potential roles of Cdk5/p35 and tau protein in hippocampal mossy fiber sprouting in the PTZ kindling model〔J〕. Clin Lab, 2010;56(3-4):127-36.
5董长征, 赵文清, 李文玲, 等. 重组腺相关病毒介导人源性神经肽Y基因转染对红藻氨酸致痫大鼠行为及脑电图的影响〔J〕. 第三军医大学学报,2010;32(19): 2140-2.
6董长征, 赵文清, 李文玲, 等. rAAV2/1介导hNPY和增强型EGFP基因转染KA致痫老年大鼠脑组织的有效途径〔J〕. 中国老年学杂志, 2011;31(5): 822-4.
7Alok KS, George H. Kainic acid-induced F-344 rat model of mesial temporal lobe epilepsy:gene expression and canonical pathways〔J〕.Toxicol Pathol, 2009;37(10): 776-89.
8Heilbronn R,Weger S. Viral vectors for gene transfer: current status of gene therapeutics〔J〕.Handb Exp Pharmacol, 2010;1(97): 143-70.
9董长征, 董秀芳, 孔艳莉, 等. 神经肽Y对海马神经元癫痫样动作电位的影响〔J〕. 中国神经精神疾病杂志, 2012;38(8): 473-6.
10董长征, 董秀芳, 赵文清, 等. 神经肽Y对海马神经元兴奋性突触活动的影响〔J〕. 中风与神经疾病杂志, 2012;29(10): 876-8.
11Lewis CJ, Evans RJ, Neild TO. Inhibition of vasoconstriction and Ca2+ currents mediated by neuropeptide Y Y2 receptors〔J〕. J Smooth Muscle Res, 1999;35 (5~6): 147-56.
12Lai KO, Ip NY. Recent advances in understanding the roles of Cdk5 in synaptic plasticity〔J〕. Biochim Biophys Acta, 2009;1792(8): 741-5.
13田发发, 郭婷辉, 党 静, 等. Cdk5/p35和tau蛋白对戊四氮点燃模型海马苔藓纤维出芽的作用〔J〕. 中华医学杂志, 2011;91(17): 1197-202.
14Nakamura NH, Akama KT, Yuen GS,etal. Thinking outside the pyramidal cell:unexplored contributions of interneurons and neuropeptideY to estrogen-induced synapse formation in the hippocampus〔J〕. Rev Neurosci, 2007;18(1): 1-13.
15张 帆, 赵文清, 李文玲, 等. 重组腺相关病毒神经肽Y基因转染对海人酸致痫大鼠癫痫发作及海马苔藓纤维出芽的影响〔J〕. 中国老年学杂志, 2013;33(1):107-9.

