利用双向电泳技术分离节瓜叶片总蛋白的方法研究
赵 芹,谢大森,彭庆务,郭巨先,周 念
(广东省农业科学院蔬菜研究所,广东广州 510640)
利用双向电泳技术分离节瓜叶片总蛋白的方法研究
赵 芹,谢大森,彭庆务,郭巨先,周 念
(广东省农业科学院蔬菜研究所,广东广州 510640)
【目的】建立适合节瓜叶片蛋白质组学研究的双向电泳体系.【方法】以节瓜品种“A37毛节瓜”为材料,对蛋白质抽提方法、上样量、凝胶浓度及IPG胶条pH范围等关键因素进行探索与优化.【结果和结论】与TCA/丙酮沉淀法及酚提取法相比,改良酚提取法抽提蛋白质总量较高,纯度最高,SDS-PAGE电泳条带明显、清晰,双向电泳图谱蛋白质点最多、清晰均匀、纵横条纹少.利用17 cm pH 4~7范围IPG胶条、120 μg蛋白质上样量、12%凝胶浓度,硝酸银染色获得蛋白质点数丰富、分辨率高、背景清晰且重复性好的双向电泳图谱,检测到节瓜叶片蛋白质点1 936个,相对分子质量主要分布于15 000~100 000之间.初步建立了一套适用于节瓜叶片蛋白质组学研究的双向电泳体系,为后续开展蛋白质组学研究及其相关工作奠定了基础.
节瓜;叶片总蛋白;蛋白质组学;双向电泳
随着后基因组时代的到来,蛋白质组学成为功能基因组学研究的重要支柱及生命科学研究的热点和核心.蛋白质组学研究一个基因、一种细胞组织或生物所表达全部蛋白的复合体组成、互作关系与丰度以及修饰状态等[1-2].双向电泳技术(Two-dimensional electrophoresis,2-DE)可以比较分析在不同条件下生物样品的蛋白质表达谱,筛选出差异表达蛋白,结合质谱技术和数据库检索,鉴定出具特定功能的蛋白[3],因此成为蛋白质组学研究的重要工具,已广泛应用于拟南芥、水稻等多种植物的遗传多样性蛋白质组学、突变体蛋白质组学、生理蛋白质组学和发育蛋白质组学研究等方面[4-6].
蛋白质组学研究技术包括蛋白质样品的制备、等电聚焦与第2向PAGE电泳、凝胶染色、图像扫描分析等一系列繁杂程序.获得高质量的蛋白质样品、清晰的双向电泳图谱是开展研究的重要前提.植物组织蛋白因材料种类、取样部位、取样时间、生理病理状态不同导致组成成分的差异[7].2-DE试验中的上样方式、等电聚焦和染色等各个环节均影响蛋白质分离效果.因此,对于每一种样品,为了获取最佳的电泳结果,需确定特定的条件组合,建立一套稳定的、高分辨率的双向电泳体系.
节瓜Benincasa HispidaCogn.var.为我国华南特色蔬菜,其风味别致,营养丰富,是供应本地市场及广东出口创汇的主要蔬菜之一[8].目前节瓜蛋白质组学研究鲜有报道.为了研究节瓜抵御胁迫、生长发育及遗传改良等方面的蛋白质表达谱,探索其分子机制,建立节瓜叶片蛋白质2-DE电泳体系势在必行.本研究以生菜、莴苣、萝卜、黄瓜等叶片蛋白质的2-DE分离体系为基础[9-11],针对节瓜叶片蛋白质抽提方法、上样量、凝胶浓度及IPG胶条pH范围等因素进行了探讨,建立了一套适合节瓜叶片蛋白质组学研究的双向电泳体系,为后续节瓜蛋白质组学及相关研究奠定了基础.
1 材料与方法
1.1 材料与试剂
试验材料“A37毛节瓜”种子由广东省农科院蔬菜所保存,播种于m(蛭石)∶m(草炭土)=1∶2的营养盘内,温室培养,待长出2片真叶时,采集第1片真叶,液氮速冻,-80℃保存.
交联聚乙烯吡咯烷酮(PVPP)购自BIO BASIC INC公司;胎牛血清标准品BSA购自Sigma公司;17 cm IPG胶条(pH 3~10、4~7)、IPG缓冲液、两性电解质、蛋白酶抑制剂PMSF、2-D Marker、尿素、覆盖油等购自GE Healthcare公司;硫脲、二硫苏糖醇(DTT)购自Amresco公司;3-[(3-胆酰胺丙基)二乙胺]丙磺酸(CHAPS)、质量分数为30%的丙烯酰胺单体储液、四甲基乙二胺(TEMED)、碘乙酰胺(IOA)购自Amersham公司;JY96-Ⅱn超声仪购自宁波新芝生物科技股份有限公司;ETTAN DAL Tsix垂直电泳槽、ETTAN IPGDHOR 3等电聚焦仪、PROTEANⅡMOLTI-CELL垂直电泳系统、Image Master 2D Platinum 5.0软件均为GE Healthcare公司产品.
1.2 方法
1.2.1 节瓜叶片总蛋白的提取方法 TCA/丙酮沉淀法:参考Giavlisco等[12]方法略作改进,取1.0 g节瓜叶片液氮速冻并加入0.1 g PVPP研碎,悬浮于预冷丙酮溶液(含φ为10%的TCA、φ为0.07%的 β-ME)中,-20℃沉淀l h;12 000 r·min-1离心1 min,预冷丙酮(含φ为0.07% 的β-ME)悬浮沉淀;重复此步骤2次,彻底去除残留TCA;沉淀用φ为80%的预冷丙酮洗涤几次至颜色发白,冷冻真空干燥.
酚抽提法:参考 Hurkman等[13]方法并加以改进,将节瓜叶片(1.0 g)研磨后,利用φ为80%的丙酮溶液清洗粉末;加入2.5 mL Tris饱和酚与等体积提取液(0.1 mol·L-1Tris-HCl、pH 8.8、10 mmol·L-1EDTA、φ为0.4% 的β-ME、0.9 mol·L-1蔗糖)涡旋,4℃放置30 min,离心后上层酚相加入5倍体积0.1 mol·L-1醋酸铵-甲醇溶液,-20℃ 1 h,离心沉淀,依次用0.1 mol·L-1醋酸铵-甲醇和预冷的φ为80%的丙酮溶液各清洗2次,预冷φ为70%的乙醇溶液清洗1次,冷冻干燥备用.
改良酚抽提法:参考Deng等[14]方法并加以改进,1.0 g节瓜叶片加入0.1 g PVPP研磨,加入10 mL提取液(蔗糖7 mol·L-1、KCl 0.1 mol·L-1、EDTA 50 mmol·L-1、Tris-HCl 0.5 mol·L-1、pH 7.5)及10 mL Tris饱和酚,振荡后冰浴;4℃ 5 000 r·min-1离心30 min,上层酚相加入等体积提取液,按上述操作重复2次;得到的酚相加入5倍体积醋酸铵-甲醇溶液,-20℃沉淀过夜;离心后5 mL甲醇溶液洗涤蛋白质2次,5 mL丙酮溶液洗涤3次,室温干燥.
1.2.2 蛋白质溶解与定量 提取的蛋白质团块中加入200 μL水化液(7 mol·L-1尿素、2 mol·L-1硫脲、40 g·L-1的CHAPS、φ为2%的两性电解质载体、60 mmol·L-1DTT),用枪头反复吸吹至充分分散.超声助溶,80 W,0.8s开、0.8s关,超声4次后置于冰上冷却,重复1次,4℃、12 000 r·min-1离心20 min,吸出上清液,转移至新EP管中.
采用Bradford蛋白质定量法[15]对3种方法提取的总蛋白进行定量.每个样品进行3次独立定量,计算蛋白质总产量,再除以每管叶片鲜质量求得蛋白质提取率,3次定量平均浓度用以计算双向电泳的蛋白质上样量.利用SPSS 13.0软件进行不同方法蛋白产量的差异显著性分析.
1.2.3 单向SDS-PAGE电泳 参考Sambrook等[16]的方法,采用12%分离胶、5%浓缩胶,上样量分别按5、10 μg进行,在ETTAN DALTsix垂直电泳槽上电泳.
1.2.4 双向电泳 第1向等电聚焦:在 ETTAN IPGPHOR 3等电聚焦仪上完成,样品水化上样.IPG胶条胶面朝下放入盛放蛋白质样品(相应量蛋白质、w为1%的DTT、φ为1%的IPG Buffer、1×溴酚蓝溶液、水化液至460 μL)的水化盘槽中,20℃泡胀过夜(10~12 h).取出胶条放入等电聚焦盘中,搭盐桥,按照操作手册《2-D Electrophoresis principle and methods》设定,并结合孔芳等[6]报道程序,略作改进,操作步骤:300 V 0.5 h,700 V 0.5 h,1 500 V 1.5 h,9 000 V 3 h,9 000 V 4 h.等电聚焦结束后,放入平衡管中-20℃保存.
平衡:每支平衡管先加8 mL 100 mmol·L-1DTT平衡液平衡15 min,倒除平衡液马上加入250 mmol·L-1IOA平衡液平衡15 min.
第2向 SDS-PAGE电泳:采用 PROTEAN II MOLTI-CELL垂直电泳系统进行分离,按照不同浓度配制凝胶.用低熔点琼脂糖封住胶面,将胶条压入玻璃板中紧密接触胶面,酸性端朝左放置;转至电泳槽开始电泳:2W/凝胶45 min,17W/凝胶.
硝酸银染色:按GE Healthcare公司双向电泳操作手册进行,并略有改动.将凝胶先固定2 h以上(φ为40%乙醇溶液,φ为 10%冰醋酸溶液,0.68 g·L-1的无水乙酸钠溶液),敏化(φ为30%乙醇溶液,3.2 g·L-1硫代硫酸钠溶液)60 min,漂洗,w为0.25%的硝酸银溶液染色60 min,漂洗,着色(25 g·L-1的碳酸钠溶液,用前加φ为0.02%的甲醛溶液)8 min,EDTA终止液(ω=1.46%)孵育45 min,漂洗.
图像的采集和分析:显色凝胶经UMAX Powerlook1100扫描仪扫描,参数设置为透射扫描模式,256灰阶,光学分辨率为300 dpi,利用Image Master 2D Platinum 5.0软件得到清晰的Tiff格式图像,对比度与亮度采用软件默认值,分辨率为600 dpi,再通过Image Master 2D 5.0分析软件系统,对图像进行背景消减、斑点检测、匹配和获取斑点位置坐标等分析,参数设置为Smooth-2、Min area-5、Saliency-3,具体分析步骤见操作说明.
1.2.5 双向电泳体系的优化 蛋白质上样量、第2向SDS-PAGE凝胶浓度及胶条pH范围与电泳结果密切相关.本试验设置了3个上样量梯度(80、120和 150 μg),分离胶浓度分别设置为10%、12%;选用17 cm胶条不同pH范围(3~10、4~7)的IPG胶条;电泳参数:2W/凝胶45 min,17 W/凝胶.
2 结果与分析
2.1 3种方法提取的节瓜叶片蛋白质含量的比较
称取等质量节瓜叶片,3种方法获得蛋白质产量经SPSS软件分析,存在显著差异.TCA/丙酮沉淀法获得蛋白质含量最少,为0.021 mg·g-1,显著低于酚抽提法(0.491 mg·g-1)和改良酚提取法(0.399 mg·g-1),裂解液溶解时不易分散.酚抽提法蛋白质沉淀最多,略带黄色,较易分散溶解,改良酚提取法所得蛋白质(0.399 mg·g-1)沉淀较多,颜色亮白,易溶于裂解液,蛋白质产量与酚抽提法(0.491 mg·g-1)差异显著,可能由于改良方法样品处理步骤增多导致蛋白质产率减少.
2.2 不同提取方法的蛋白质SDS-PAGE图谱比较
由图1可知,3种方法提取的蛋白质经 SDSPAGE分离后,条带数目、位置以及染色深浅均存在较大差异.其中,TCA-丙酮沉淀法蛋白质条带(10条左右)明显少于酚抽提法和改良酚提取法,条带位置也略低,条带染色较浅,说明节瓜叶片中多糖类物质严重干扰了蛋白质的有效沉淀;酚提取法与改良酚提取法蛋白质条带均很多,带形明显、清晰,条带分离效果好,未见明显的蛋白质降解现象,但改良酚提取法的蛋白质条带又稍多于酚提取法(图1).由此表明不同制备方法提取的蛋白质种类和含量有所不同,以改良酚抽提法为优,初步符合2-DE凝胶电泳要求.

图1 样品3种方法提取的节瓜叶片蛋白SDS-PAGE分离结果Fig.1 SDS-PAGE pattern of chieh-qua leaves proteins extracted by three sample preparation methods
2.3 不同提取方法对双向电泳分离效果影响
图2为对3种方法提取蛋白质样品2-DE分离和银染后的结果.结果显示,蛋白质点主要集中在pH 4~7和相对分子质量15 000~100 000之间,TCA/丙酮沉淀法得到蛋白质点极少,且存在明显竖条纹(图2A);酚抽提法蛋白质点数量增多,但总数依然偏少,部分蛋白质点融合在一起未能完全分离开,存在横向条纹干扰(图2B);改良酚提取法蛋白质点显著增多,多数近圆形,分布均匀,背景较浅,基本没有条纹干扰,图谱质量最佳(图2C).TCA/丙酮沉淀法、酚提取法和改良酚抽提法3种方法的蛋白质点数差异较大,分别为243、1 308和1 596个,经SPSS软件差异显著性分析发现,TCA/丙酮沉淀法与酚提取法蛋白质点数差异显著(P=0.020),与改良酚抽提法差异显著(P=0.010),而酚提取法与改良酚抽提法之间差异不显著(P=0.227).3种方法在不同相对分子质量(Mr)、等电点(pI)范围内的蛋白质种类、含量及分离效果方面均有一定差异.如图3A所示,在pI 4~7区域改良酚抽提法(1 207个)蛋白质点数比酚提取法(879个)多328个,比TCA/丙酮沉淀法(160个)多1 047个,在pI 3~4区域蛋白质点数显著低于pI 6~7(P=0.021)与pI 7~10区域(P= 0.012),而其他区域间差异不明显;在中低相对分子质量区(15 000~100 000),改良酚抽提法(1 414个)效果总体也优于酚提取法(1 095个)和TCA/丙酮沉淀法(164个),分别多319个与1 250个,且蛋白质点清晰,纵横条纹较少,TCA/丙酮沉淀法与酚提取法在该区蛋白质点数分布差异显著(P=0.012),与改良酚抽提法相比呈极显著差异(P=0.004),而酚提取法与改良酚抽提法之间差异不显著(P=0.502);蛋白相对分子质量15 000~35 000与100 000~170 000区域蛋白点数差异极显著(P=0.005),55 000~100 000区域、15 000~35 000(P=0.015)和35 000~55 000区域(P=0.04)均差异显著(图3B).
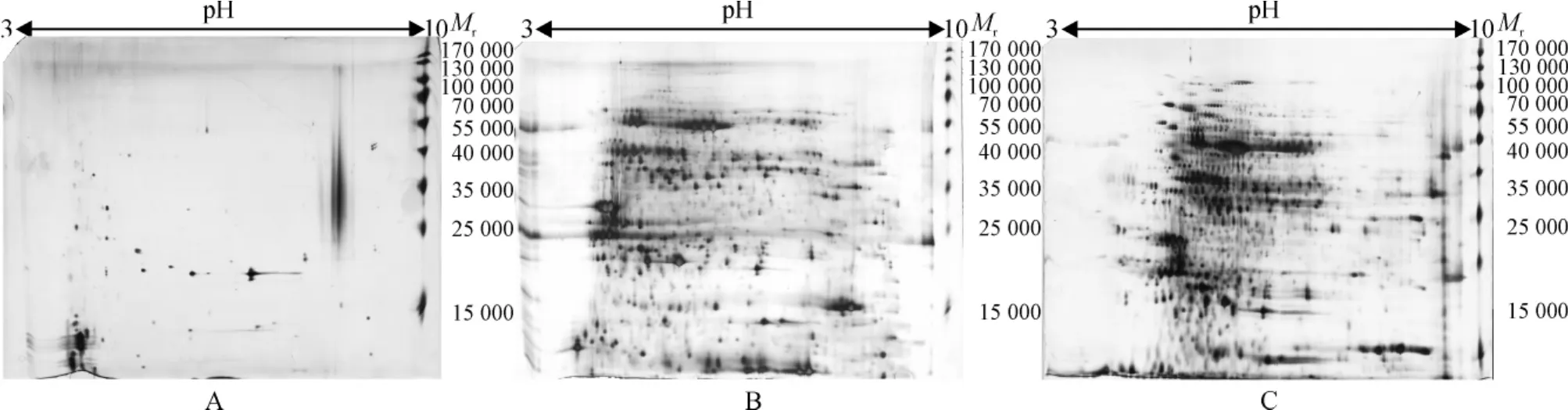
图2 样品3种方法提取的节瓜叶片蛋白2-DE分离结果Fig.2 2-DE isolation of chieh-qua leaves proteins extracted by three sample preparation methods
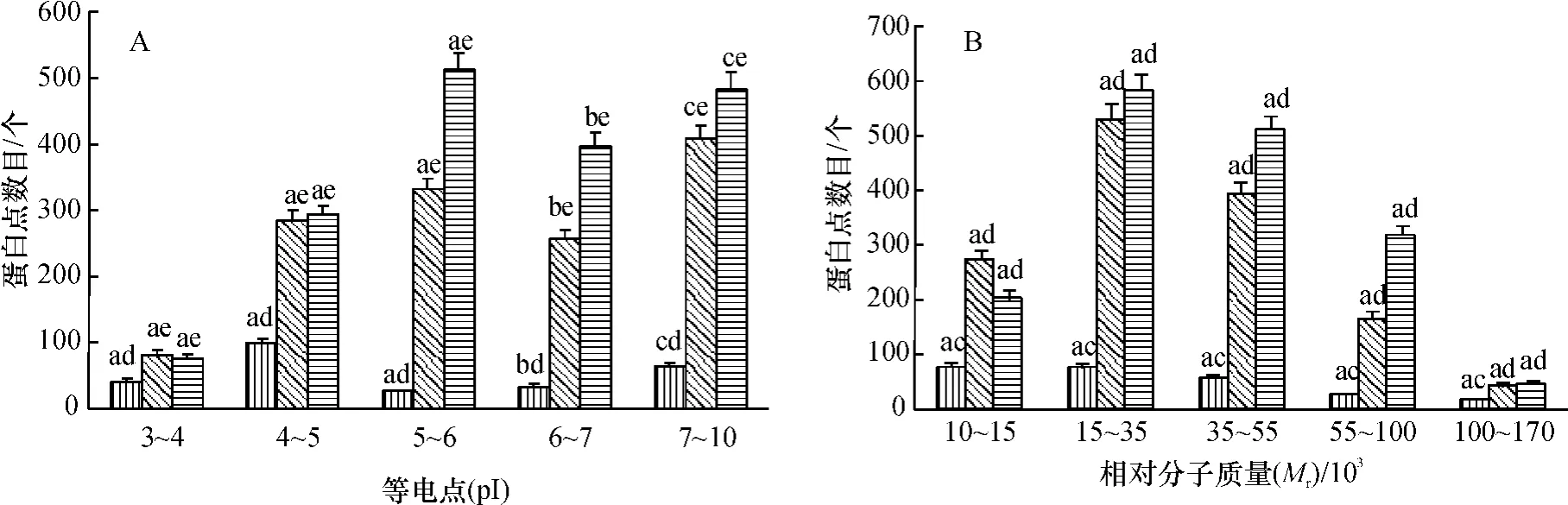
图3 样品不同方法提取蛋白质的等电点和相对分子质量分布Fig.3 The distribution of proteins spots according to molecular mass(Mr)and isoelectric point(pI)of different protein extraction methods
由此可见,样品的不同处理方法对同一材料的提取效果是不同的,TCA-丙酮沉淀法受到酚类与多糖类等物质的干扰,蛋白质丢失现象很严重;与酚提取法相比,改良酚抽提法所提取总蛋白完整性提高,蛋白质点丢失减少,较好的消除了微量酚类、多糖类等物质残留造成的背景较深与横竖条纹,因此改良酚提取法为节瓜叶片双向电泳样品制备的最优方法.
2.4 不同上样量双向电泳分离结果比较
3种上样量比较分析发现,上样量为80 μg时,虽然背景较清晰,蛋白点无拖尾现象,但数量明显减少(817个),低丰度蛋白检出量很少(图4A);上样量为120 μg时,蛋白点均匀分布,形态规则,呈现较多的低丰度蛋白,无扩散和拖尾现象,横竖条纹干扰少,检测蛋白点约1 596个(图4B);上样量提高至150 μg时,所获蛋白点约1 527个(图4C),数量不但没有增加,反而使高丰度蛋白斑点过大,造成交叉重叠,影响其他蛋白点的分离与分析,且横纵向条纹明显增加,背景颜色加深,这是由于上样量过大使样品溶液中的杂质及离子含量增大,聚焦效果差,影响蛋白点的有效分离.因此,综合考虑图谱分辨率和蛋白点数量,最佳上样量为120 μg.
2.5 第2向凝胶浓度对双向电泳图谱的影响
双向电泳效果取决于蛋白质相对分子质量范围,第2向凝胶浓度对蛋白质点分布起重要作用.本研究探讨10%与12%凝胶浓度对节瓜蛋白质的分离效果,结果显示,10%聚丙烯酰胺凝胶中(图5A),节瓜叶片蛋白质点分布较靠近溴酚蓝前沿,部分低相对分子质量蛋白质已丢失,图谱中上部蛋白质点分布较少(1 069个);12%凝胶中(图5B),蛋白质点充分分开(1 596个),蛋白质点清晰,是适于节瓜叶片蛋白质分离的较优凝胶浓度.

图4 不同节瓜叶片蛋白上样量2-DE效果比较Fig.4 Comparison of 2-DE maps among different loading quantities of chieh-qua leaves protein

图5 不同聚丙烯酰胺胶浓度对双向电泳图谱的影响Fig.5 2-DE gel maps of protein using different polyacrylamide gel concentrations
2.6 IPG胶条pH范围的选择
等电聚焦效果与胶条的长度及pH范围等因素密切相关.当选用pH 3~10浓度梯度IPG胶条时,发现蛋白质点集中分布在pH 4~7区域,未完全分开,且低相对分子质量蛋白质分布较少(图6A).而选用pH 4~7胶条时,虽然损失了部分碱性端蛋白质点,却保留了中性偏酸区域的大部分蛋白质点,蛋白质点充分分离,蛋白质点近圆形,数量较多,检测到1 936个蛋白质点(图6B).这表明:在保证试验条件一致的情况下,pH 4~7的胶条能显著提高节瓜叶片蛋白质的分离效果.
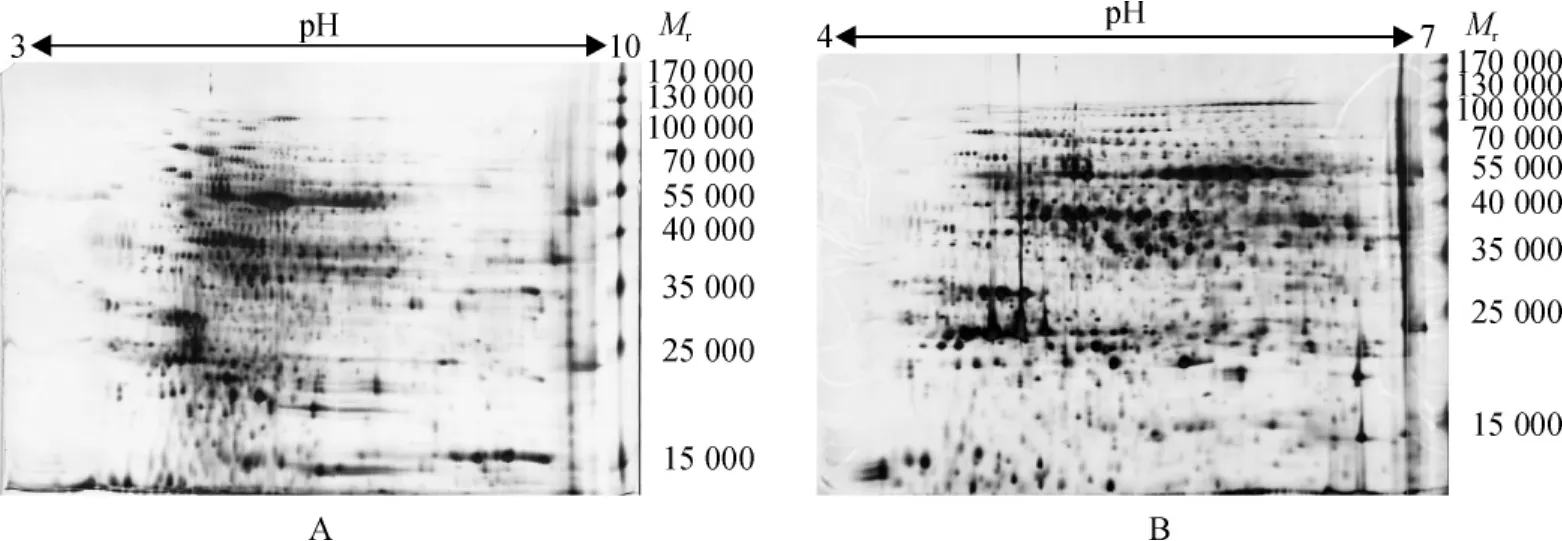
图6 不同pH梯度IPG胶条的双向电泳图谱Fig.6 2-DE gel maps of protein using IPG strips with two different pH ranges
3 讨论与结论
蛋白质样品制备是双向电泳的首要环节.理想的样品制备,应尽可能提高蛋白质样品的溶解性,降低蛋白质的损耗与降解,在蛋白质提取、裂解液配制、杂质去除等方面应尽量采取步骤简单的方法[17].节瓜叶片富含色素、多糖、酚类、醌类等对双向电泳干扰严重的次生物质,本研究以TCA/丙酮沉淀法、酚抽提法为基础,加以探索与改良,建立一套适合节瓜叶片蛋白质的制备体系.TCA/丙酮沉淀法能够有效沉淀蛋白质,去除盐离子和杂质提取的蛋白质难溶解,小分子蛋白质易丢失,在一些蛋白质含量低且次生代谢产物丰富的植物样本中应用受到限制[18],本研究中该方法沉淀蛋白质受到节瓜次生物质的严重干扰,蛋白质产率低,可溶性差,获得的SDS-PAGE与2-DE图谱均不合要求.酚抽提法在去除干扰物质方面有一定优势[19],节瓜叶片蛋白质产率、纯度与图谱质量比TCA/丙酮法明显改善.改良酚提取法首先通过添加PVPP去除色素与多酚,提取液成分的改良有利于更好地去除干扰杂质,利用醋酸铵甲醇溶液清洗样品,进一步去除残留的多酚、油脂和类油脂聚合物等干扰物质,增加蛋白质沉淀干燥前的甲醇丙酮洗涤次数,在离心时加大转速和延长离心时间,尽可能彻底去除残留的杂质和盐离子等干扰物,以减少双向电泳中的条纹干扰,但增加制备步骤使蛋白质含量略减少,该法处理所得2-DE图谱显著改善,显示出更多蛋白质点,获得较高蛋白质产量.
IPG胶条选择需根据样品中蛋白质分布、目的蛋白质性质及丰度等进行选择.对于未知蛋白质分布特性的样品,可以先用宽pH梯度IPG胶条进行分离,可清晰地纵览总蛋白的分布,进而选用窄pH梯度IPG胶条,分离等电点相差不大的蛋白质,显著提高分辨率.对于蛋白质点无法充分分离的pH区域,可选用对应范围的窄pH梯度的IPG胶条进一步进行分离.本研究表明,pH 4~7 IPG胶条比pH 3~10 IPG胶条得到的蛋白质信息量更大.pH范围宽的IPG胶条能反应节瓜叶片蛋白质的特征,但难以有效区分等电点接近的蛋白质,在pH 4~7分离出大量蛋白质,说明节瓜叶片的功能性蛋白主要分布在该区域.
双向电泳最佳上样量受多种因素的影响,如上样方式、IPG胶条长度和pH范围、染色方法等[20],窄pH梯度IPG胶条比宽pH梯度IPG胶条需更大上样量,杯上样相对于水化上样,上样量可以减少,考染比银染需要更大上样量.因此最佳上样量必须通过实践经验决定.双向电泳一般推荐的上样量不超过1.2 mg,不低于50 μg.提高蛋白质上样量,有利于低丰度蛋白质检测,但上样量过高可导致高丰度蛋白质斑点掩盖低丰度蛋白质,且盐离子浓度过高可直接影响到等电聚焦效果,产生横向干扰.上样量较低,蛋白点分离较好,图谱清晰,但也会导致低丰度蛋白质微弱或丢失.另外绿色叶片中含有大量Rubisco酶(w可达50%)[21],故需适当提高上样量利于低丰度蛋白质检测.基于上述因素,本研究选用120 μg为最佳上样量,此时蛋白质点清晰,无横条纹干扰,图谱质量最佳.
双向电泳中第2向SDS-PAGE中凝胶浓度,对于蛋白质点分布起到重要作用.凝胶浓度太大导致大分子量蛋白质聚集在凝胶上部,不能得到很好分离,而凝胶浓度太小又会使小分子量蛋白质聚集在溴酚蓝前沿,所以选择适当浓度的凝胶才能得到蛋白质点分布均匀的理想图谱.使用10%浓度凝胶时,大多数蛋白质集中在凝胶中下部区域,部分蛋白质点丢失,且蛋白质点不够清晰.稍微提高凝胶浓度至12%,蛋白质点富集区域的分辨效果得到改善,而且低分子量蛋白未超出凝胶所能容纳的范围.
综上所述,本研究通过节瓜叶片蛋白质提取方法、上样量、胶条pH范围和PAGE凝胶浓度的优化,建立了一套重复性好、分辨率高的节瓜叶片蛋白质双向电泳体系,即采用改良酚提取法抽提制备蛋白质样品,17 cm、pH 4~7胶条等电聚焦、120 μg上样量、12%第2向凝胶浓度进行双向电泳分析,硝酸银染色,可获得质量较高的双向电泳图谱.
另外,由于节瓜叶片含有大量叶绿体及很多与光合作用有关的Rubisco羧化酶/加氧酶等高丰度蛋白,低丰度调控蛋白受到了高丰度蛋白的覆盖和遮蔽,去除Rubisco高丰度蛋白对于更科学而精确地利用双向电泳研究节瓜蛋白质组学是必要的.在后续的研究中,将尝试PEG分步沉淀法[6]和Mg/NP-40/PEG3350/ TCA/丙酮提取法[5]有效剔除节瓜叶片中高丰度的Rubisco结构蛋白,提高低丰度蛋白可检测性,使节瓜蛋白双向电泳图谱的饱和度与分辨率进一步提高.
[1] WILKINS M R,WILLIAMS K L,APPEL R D,et al.From proteins proteomes:Large scale protein identification by two dimensional electrophorese and amino acid analysis[J].Biotechnology,1996,14:61-65.
[2] DU H K.Gel-based proteomics approach for detecting low nitrogen-responsive proteins in cultivated rice species[J].Physiol Mol Biol Plants,2009,15(1):31-41.
[3] 甘露,李殿荣,臧新,等.甘蓝型油菜蛋白双向电泳体系的建立[J].作物学报,2010,36(4):612-619.
[4] RUTSCHOW H,YTTERBERG A J,FRISO G,et al.Quantitative proteomics of a chloroplast SRP54 sorting mutant and its genetic interactions with CLPC1 inArabdopsis[J].Plant Physiol,2008,148:156-175.
[5] 钟俐,马成梅,梁永增,等.甜瓜叶片中Rubisco的去除及双向电泳体系的优化[J].植物生理学报,2012,48 (3):303-309.
[6] 孔芳,蒋金金,吴磊,等.油菜叶片总蛋白双向电泳样品制备方法的改进[J].生物技术通报,2010,5:93-110.
[7] ISLAM N,LONSDALE M,UPADHYAYA N M,et al.Protein extraction from mature rice leaves for two-dimensional gel electrophoresis and its application in proteome analysis[J].Proteomics,2004(4):1903-1908.
[8] 谢大森,何晓明,彭庆务,等.瓜类枯萎病发生机理研究进展[J].仲恺农学院学报,2006,19(3):65-70.
[9] 刘丽娟,舒烈波,陈海荣,等.适用于生菜叶片质双向电泳方法的建立及初步应用[J].植物遗传资源学报,2009,10(1):106-110.
[10]陈曙红,韩莹琰,范双喜,等.叶用莴苣叶片总蛋白质双向电泳影响因素的研究[J].北京农学院学报,2012,27(2):14-16
[11]范海延,陈捷,张春宇,等.适于黄瓜叶片蛋白质组分析的双向电泳方法最佳条件的研究[J].沈阳农业大学学报,2008,39(3):365-367.
[12]GIAVALSCO P,NOPDHOFF E,LEHRACH H,et al.Extraction of proteins from plant tissues for two-dimensional electrophoresis analysis[J].Electrophoresis,2003,24 (1/2):207-216.
[13]HURKMAN W J,TANAKA C K.Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis[J].Plant Physiol,1986,81:802-806.
[14]DENG Z P,ZHANG X,TANG W Q,et al.A proteomics study of brassino-steroid response inArabidopsis[J].Mol Cell Proteomics,2007,6:2058-2071.
[15]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1/2):248-254.
[16]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning:A laboratory manual[M].3rded.Beijing:Science Press,2002.
[17]JELLOULI N,SALEM A B,GHORBEL A,et al.Evaluation of protein extraction methods forVitis viniferaleaf and root proteome analysis by two-dimensional electrophoresis[J].J Integr Plant Biol,2010,52(10):933-940.
[18]WANG W,VIGNANI R,SCALI M,et al.A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J].Electrophoresis,2006,27(13):2782-2786.
[19]WANG W,SCALI M,VIGNANI R,et al.Protein extraction for two-dimensional electrophoresis from olive leaf,a plant tissue containing high levels of interfering compounds[J].Electrophoresis,2003,24(14):2369-2370.
[20]LIN Jinke,ZHEN Jingui,YUAN Ming,et al.The improvement of isolation and the method of two-dimensional electrophoresis of protein from tea plant[J].J Tea Sci,2003,23(1):16-20.
[21]ELLIS R J.The most abundant protein in the world[J].Trends Biochem Sci,1979,4:241-244.
【责任编辑 霍 欢】
An optimization study on two-dimensional electrophoresis for chieh-qua leaf proteomic analysis
ZHAO Qin,XIE Dasen,PENG Qingwu,GUO Juxian,ZHOU Nian
(Vegetable Research Institute,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
【Objective】To establish two-dimensional electrophoresis(2-DE)system suitable for chieh-qua leaf proteomics analysis.【Method】The effects of various protein extraction methods of 2-DE were intercompared using the leaves of“A37maojiegua”as the materials,and the loading quantity of sample,SDSPAGE gel concentration and the pH range of IPG strips were also investigated and optimized.【Result and conclusion】The results showed that modified phenol extraction method was notably superior to TCA/acetone precipitation method and phenol extraction method in total protein quality and clarity of protein bands in SDS-PAGE electrophoresis,and the final 2-DE image map based on modified phenol extraction method had the maxium protein dots and clear background,slight streaking,more completely separated spots compared with the other methods.The further optimization of 2-DE system was carried out to obtain a 2-DE electrophoretogram abundant protein spots,high resolution,clear background and excellent repeatability with 17 cm IPG strips,120 μg protein loading quantity,SDS-PAGE with 12%gel concentration and IPG strips with pH 4-7,finally detecting proteins with modified silver nitrate staining.More than 1 936 protein spots were detected and their relative molecular mass ranged from 15 000 to 100 000.The optimization of the experimental conditions of 2-DE system suitable for chieh-qua proteomics research has been constructed,which provides a basis for further investigation of chieh-qua proteomics researches.
chieh-qua;total protein of leaf;proteomics;two-dimensional electrophoresis
S336
A
1001-411X(2014)03-0079-07
2013-07-10 优先出版时间:2014-03-31
优先出版网址:http:∥www.cnki.net/kcms/doi/10.7671/j.issn.1001-411X.2014.03.015.html
赵 芹(1982—),女,副研究员,博士,E-mail:zhaoqin0802@126.com
广东省自然科学基金博士启动基金(10451064001006063);广东省农业科学院院长基金(1279009475432)
赵 芹,谢大森,彭庆务,等.利用双向电泳技术分离节瓜叶片总蛋白的方法研究[J].华南农业大学学报,2014,35(3):79-85.

