聚醚醚酮表面壳聚糖的固定
刘焕萍,孙 辉,高艺菡
(北京工商大学材料与机械工程学院,北京100048)
0 前言
PEEK作为一种新型的半晶态芳香族热塑性工程材料[1],具有优异的耐磨擦性、高强度和抗蠕变等优势,是一种极具潜力的生物假体植入材料。另外,PEEK无毒、质轻、耐腐蚀、耐水解,是与人体骨骼最接近的材料,因此,PEEK可代替金属制造人体骨骼和椎间融合器等[2]。但由于PEEK材料本身的生物惰性和低表面能致使其在植入时易产生不利的宿主反应。故需对PEEK材料表面进行改性以改善其生物相容性。
本课题组成员陈睿超等[3-5]通过紫外光诱导在PEEK薄膜表面自引发接枝上丙烯酸单体以在其表面引入亲水性基团羧基,其薄膜表面的水接触角从104.7°降至15.8°,大大提高了表面润湿性。并在此基础上,又通过紫外辐照和湿化学发连用在PEEK材料表面成功的固定上了牛血清蛋白和肝素分子,以改善材料表面的润湿性、组织相容性和血液相容性,而且不改变其本身的强度和稳定性,可在PEEK表面培养细胞或者用于抗凝血材料等,扩大了PEEK材料在生物医用领域的应用。
在材料植入人体时,假体易引发细菌感染,大大减低了手术的成功率,故需改善生物材料表面的抗菌性能。生物材料表面性能(表面润湿性和表面电荷等)对细菌黏附影响较大。已有研究证明通过在生物材料表面产生极端的浸润性可以有效地抑制细菌黏附[6-8];此外,在一般情况下,细菌表面存在负电荷,可以在材料表面引入正电荷,通过静电吸附在细菌细胞膜表面形成外层膜,改变其选择透过性,阻止营养物质进入细胞内,以达到抑菌和杀菌作用。壳聚糖作为一种生物衍生的以β-1,4-键连接的带正电多糖,具有良好的生物相容性和生物活性,可促进创面愈合[9]。而且,壳聚糖通过带正电的NH+2结合负电子可抑制细菌活性和杀菌,使其在医药领域具有广泛的应用[10]。
本文通过采用紫外光接枝和湿化学法在PEEK薄膜表面固定上壳聚糖,期望在PEEK材料产生抗菌表面,抑制细菌感染,改善其组织相容性,使PEEK在生物医药领域具有更广阔的应用前景。
1 实验部分
1.1 主要原料
丙酮,分析纯,北京化工厂;
二苯丙酮,化学纯,天津市远航化学品有限公司;
丙烯酸,化学纯,国药集团化学试剂有限公司;
硫酸亚铁铵,分析纯,北京化工厂;
碳二亚胺(EDC),纯度99%,北京东华力拓科技发展有限公司;
乙酸,36%,北京化工厂;
壳聚糖,DA≥90%,上海特佰化学科技有限公司;
PEEK薄膜,Vitrex-PEEK,英国ICI公司。
1.2 主要设备及仪器
扫描电子显微镜(SEM),Quanta 250,美国FEI公司;
视频光学接触角测量仪,OCA35,德国Data physicsinstruments Gmb H公司;
X射线光电子能谱仪(XPS),ESCALAB 250,美国Thermo Fisher Scientific公司。
1.3 样品制备
PEEK 膜接枝丙烯酸(PEEK-g-AAc):对 PEEK薄膜片(尺寸为20 mm×30 mm)进行清洗,后浸泡在10 mg/m L的二苯丙酮(BP,光敏剂)溶液中10 min,黑暗环境下晾干;将处理后的薄膜浸入0.75 mol/L的丙烯酸溶液(含溶液质量的0.5%的莫尔盐,阻聚剂)中,在紫外灯下辐照6 min[1000 W,光波长为(365±5)nm,光照距离为20 cm],清洗后得PEEKCOOH薄膜;
PEEK-g-AAc固定壳聚糖(PEEK-g-CTS):将PEEK-g-AAc浸在0.1%的EDC溶液(乙酸溶液调节p H=4.7)中,室温下静置2 h;然后,将薄膜置于不同浓度壳聚糖的0.1%乙酸溶液中,4℃下冷藏静置24 h,清洗。
1.4 性能测试与结构表征
水接触角:将改性后的PEEK的水接触角在Dataphysics OCA35接触角测量系统上测试,用SCA20软件调整合适的水滴形状并测量水接触角,测试仪器每次低落的水滴为2μL,去离子水滴在PEEK膜表面5 s后进行测量;在改性的PEEK膜和未改性PEEK膜表面分别均匀的5个点进行测试,每组数据取平均值进行对比;
SEM分析:在5kV的加速电压的环境下通过SEM对未改性样品和接枝后的样品表面形态和微观结构样品进行表征,在观测之前进行溅射喷金;
XPS分析:壳聚糖修饰的PEEK表面元素由XPS进行分析,所使用的XPS光谱仪所配备的辐射源为Monochromated Al Kalph 200 W,光斑尺寸为650μm,对壳聚糖修饰的PEEK试样进行5次扫描;
接枝率计算:对未改性的PEEK薄膜和壳聚糖修饰的PEEK薄膜进行称量,用质量法计算经过壳聚糖修饰的PEEK膜的接枝率(Dg):
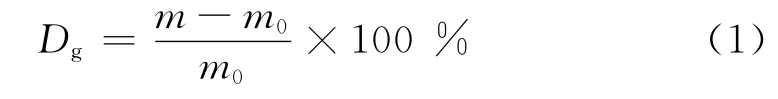
式中 m0:接枝前膜的质量,g m:接枝后膜的质量,g
2 结果与讨论
2.1 壳聚糖的固定
本文采用紫外光接枝和湿化学法连用在PEEK薄膜表面固定壳聚糖。首先在光敏剂BP的作用下,通过紫外光引发在PEEK表面接枝上亲水性丙烯酸单体,引入羧基,改善材料表面的润湿性,并为下一步的表面功能化提供反应位点;然后通过质子化的EDC与PEEK材料表面的羧酸根离子反应生成高活性的O-酰基异脲,这一活化中间体易与氨基基团反应形成酰胺结构[11];最后以共价键结合的方式在PEEK表面固定上壳聚糖(CTS),其反应流程示意图如图1所示。
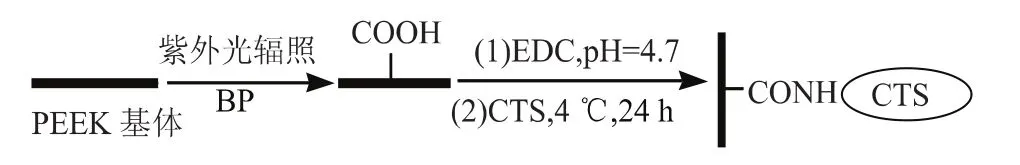
图1 PEEK表面接枝壳聚糖的反应流程示意图Fig.1reaction process diagram of grafting chitosan on the surface of PEEK film
2.2 表面润湿性
使用光学视频接触角测量仪对PEEK膜、PEEK-g-AAc膜及PEEK-g-CTS膜表面亲水性进行测试,如表1所示。
由表1可以看出未经改性的PEEK膜表面的平均水接触角为85.04°,亲水性较差。经过紫外光接枝丙烯酸后,由于材料表面引入亲水性基团羧基使表面平均水接触角大幅降低至14.92°,减小了70.12°,润湿性明显提高,同时也证明了在PEEK表面成功接枝上丙烯酸。在PEEK-g-AAc的基础上的固定壳聚糖后平均水接触角较PEEK-g-AAc相比有明显升高,PEEK-g-CTS表面的平均水接触角低于未改性的PEEK膜的平均水接触角。由上可知,PEEK-g-CTS相比PEEK-g-AAc水接触角增加,但与未经改性的PEEK膜相比亲水性得到了改善,即PEEK的壳聚糖修饰使其亲水性得到了提高。

表1 PEEK膜改性前后的水接触角测量值及示意图Tab.1 Water contact angle of blank and grafted PEEK film
对于不同浓度(0.005、0.01、0.015、0.02、0.025 g/mL)壳聚糖的0.1%乙酸溶液处理过的薄膜,水接触角平均 值 依 次 为:59.01°、61.43°、62.69°、63.24°、66.91°,如表1所示。由图2可知,随着壳聚糖乙酸溶液浓度的增大,改性的PEEK薄膜表面的水接触角值增加,但总体变化不大。

图2 PEEK表面固定上不同浓度壳聚糖的水接触角Fig.2 Water contact angle of chitosanimmobilization with surface different concentrations
2.3 接枝率
通过对表2数据进行曲线拟合作图,如图3所示,壳聚糖浓度对PEEK膜表面的接枝率成线性关系。由图3可知,随着壳聚糖浓度的提高,在PEEK膜表面的接枝率增加。

表2 PEEK膜上壳聚糖接枝率Tab.2 Degree of grafting chitosan on PEEK surface

图3 PEEK膜表面固定不同浓度壳聚糖时的接枝率Fig.3 The degree of PEEK surface grafted different concentrations of chitosan
2.4 表面形貌
对改性前后的PEEK膜进行溅射喷金,在5 k V的加速电压的环境下通过SEM对其表面形态和微观结构进行表征。
由图4可知,未改性的PEEK膜表面比较光滑平整,在PEEK膜接枝丙烯酸后表面明显变得粗糙,并出现不规则的带状结构,间接证明了在PEEK薄膜表面成功接枝上了丙烯酸单体。在PEEK-g-AAc基础上进行壳聚糖修饰后,未洗膜表面有许多较厚的白色覆盖物层,且厚度不均。相比其他薄膜,洗过的PEEK-g-CTS膜表面可清晰的观察到密集粗糙的纹理,可明显的观察到接枝层。由此可知壳聚糖成功地固定在聚醚醚酮薄膜表面。

图4 接枝前后的PEEK膜SEM图片(×5000)Fig.4 SEM of blank and grafted PEEK films(×5000)
PEEK薄膜表面固定上不同浓度的壳聚糖的表面形貌如图5所示,由上可知随着壳聚糖浓度的提高,PEEK膜表面的粗糙纹理更加密集,而且膜表面的接枝区域增大,即在PEEK薄膜表面固定的壳聚糖含量增加。其结果与随壳聚糖浓度提高,PEEK膜表面固定壳聚糖的接枝率提高相符合。

图5 未改性PEEK膜和在PEEK膜表面固定不同浓度的壳聚糖的SEM照片(×5000)Fig.5 SEM of blank PEEK and PEEK film with surface different concentrations of chitosanimmobilization(×5000)
2.5 表面组成
采用XPS对接枝前后的PEEK膜进行分析,观察表面改性前后PEEK膜的元素组成和电子结合能变化。
由图6、7和表3可知,未改性的PEEK膜表面元素只存在C、O和H 3种元素。通过壳聚糖分子修饰后,PEEK材料表面的C含量降低,O含量由于PEEK引入亲水性基团羧基而明显增加;通过PEEK膜表面的羧基和壳聚糖分子链上的氨基发生酰胺反应形成酰胺键而在PEEK-g-CTS膜表面引入新的N元素,即图7中N1s峰的出现。

图6 接枝前后PEEK膜表面XPS全谱扫描Fig.6 XPS of blank and grafted PEEK film

表3 接枝前后PEEK薄膜的表面各元素的含量Tab.3 The content of each element of blank and grafted PEEK film

图7 接枝前后PEEK膜表面N元素的高分辨率扫描图Fig.7 XPS N spectra(N1s)of blank and grafted PEEK film
3 结论
(1)通过紫外光接枝和湿化学法连用在PEEK材料表面接枝具有抑菌作用的壳聚糖,其表面水接触角从原来的85.04°降低至59.01°,说明PEEK材料表面的亲水性得到改善;
(2)随着壳聚糖浓度的提高,在PEEK表面的接枝率增加,通过SEM可观察到接枝区域扩大;由质量法计算其接枝率可知当壳聚糖浓度为0.025 g/m L时,其表面接枝率达到最大为2.98‰,表面的壳聚糖接枝层完全覆盖在PEEK膜表面;由X射线光电子能谱分析可知,在改性后PEEK表面出现了新的N元素峰,证明在其表面成功接枝上了壳聚糖;
(3)随着壳聚糖浓度的增加,虽然提高了接枝率,但相应的材料表面的亲水性却有所下降。
[1]NiNAGAKI,S TASAKA,T HORIUCHI,et al.Surface Modification of Poly(aryl ether etherketone)Film byremote Oxygen Plasma[J].Applied Polymer Science,1998,68(2):271-279.
[2]Steven M Kurtz,John N Devine.PEEK Biomaterialsin Trauma,Orthopedic,and Spinalimplants[J].Biomaterials,2007,28:4845-4869.
[3]Steven M Kurtz.PEEK Biomaterials Handbook[M].USA:William Andre Publishing,2011:95.
[4]CHENrui-chao,SUN Hui.UV-induced Self-initiated Graft Polymerization of Acry-lam ide onto Poly(ether ether ketone)[J].Chemres Chinese Universities,2012,28(1):162-165.
[5]SUN Hui,CHENrui-chao.Immobilization of Bovine Serum Albumin on Poly(ether etherketone)for Surface Biocompatibilityimprovement[J].Chemres Chinese Universities,2012,28(2):353-357.
[6]SUN Hui,CHENrui-chao.Surface Heparinization of Poly(ether ether ketone)[J].Chemres Chinese Universities,2012,28(3):542-545.
[7]Yin B,Liu T,Yin Y.Prolonging the Duration of Preventing Bacterial Adhesion of Nanosilver-containing Polymer Films Through Hydrophobicity[J].Langmuir,2012,28(49):17019-17025.
[8]Speranza G,Gottardi G,Pederzolli C,et al.Role of Chemicalinteractionsin Bacterial Adhesion to Polymer Surfaces[J].Biomaterials,2004,25(11):2029-2037
[9]高长有,马 列 .医用高分子材料[M].北京:化学工业出版社,2006:24.
[10]Pradip Kumar Dutta,Joydeep Dutta,V S Tripathi Chitin et al.Chemistry,Properties and Application[J].Journal of Scientific andindustrialresearch,2004,63(1):20-31.
[11]Madeleine M Joullie,Kenneth M Lassen.Evolution of Am ide Bond Formation[J].Arkivoc:Online Journal of Organic Chemistry,2010,(8):189-250.

