一个新的小麦-中间偃麦草异代换系的分子细胞学鉴定
胡 静,李 欣,阎晓涛,任永康 ,郭慧娟 ,詹海仙 ,乔麟轶 ,畅志坚 ,张晓军
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院作物科学研究所,山西太原030032)
中间偃麦草(Thinopyrum intermedium amphiploid,2n=6x=42,EEEEXX或 JJsSt)为禾本科小麦亚族(Triticinae)多年生野生草本植物,是普通小麦(Triticum aestivum,2n=6x=42,AABBDD) 的近缘物种之一[1-3],免疫小麦叶锈、条锈、秆锈、白粉等病害[4],高抗小麦黄矮病、黑穗病、叶枯病和根腐病等,且有较强的耐盐碱、耐旱和耐低温性,生长势强,再生性好,适应性广等特性。目前,其已成为小麦遗传改良中具有重要利用价值的野生亲本之一[4],国内外学者已将多个偃麦草的有益基因转移到普通小麦中[5-8]。
本试验以来源于中间偃麦草的八倍体小偃麦TAI7047(2n=8x=56)为桥梁亲本,从其与普通小麦晋太170杂交、回交的BC1F6选系中选育出一个高抗秆锈病、白粉病的小麦-中间偃麦草异代换系CH08-141。2011—2012年,分别在四川邛崃电子科技大学试验农场和山西省农业科学院东阳试验基地温室进行了秆锈病和白粉病的接种鉴定。为了明确抗病新种质CH08-141中所携带的抗病基因来源及其所在的染色体位置,进一步利用基因组原位杂交和SSR分子标记技术对其进行了分析鉴定。
1 材料和方法
1.1 材料
八倍体小偃麦TAI7047为畅志坚[9]利用远缘杂交方法选育出的高抗小麦秆锈病、白粉病的小麦-中间偃麦草部分双二倍体。晋太170为山西省农业科学院作物科学研究所选育的优质强筋小麦品种[10]。CH08-141为八倍体小偃麦TAI7047与普通小麦晋太170杂交、回交的BC1F6选系中选育出的高抗秆锈病、白粉病的高代品系。抗病鉴定所用病理小种秆锈Ug99和白粉菌E09来自中国农业科学院植保研究所,由山西省农业科学院作物科学研究所保存繁殖。
1.2 方法
1.2.1 抗病性鉴定 为分析CH08-141的抗病特性及其所携带的抗病基因来源,于2011—2012年,分别在四川省邛崃市电子科技大学试验农场对CH08-141及其杂交亲本TAI7047、晋太170和TAI7047的亲本中间偃麦草、晋春5号接种目前我国流行的秆锈菌小种Ug99,在山西省农业科学院东阳试验基地温室接种白粉菌小种E09进行抗病鉴定,使用高感品种SY95-71作为感病对照及诱发材料。接种15~18 d后,当感病品种充分发病时,按 0(免疫)、0;(过敏性坏死)、1(高抗)、2(中抗)、3(中感)和4(高感)的6级分级标准分别调查、记载其秆锈病和白粉病的侵染型,其中,0~2的侵染型为抗病,3~4的侵染型为感病。
1.2.2 根尖细胞中期染色体制备 根尖细胞中期染色体制备、探针标记及原位杂交程序参照Han等[11-12]描述的方法进行。
将CH08-141种子放到吸满水的滤纸上,置于培养皿中,24℃进行发根;当根尖长到1.0~1.5 cm时,剪取根尖端0.5 cm,放入打孔并喷了水的1.5 mL离心管中,室温下使用N2O处理2 h;然后用90%冰乙酸固定10 min,再用蒸馏水冲洗3次,待无明显乙酸味时置入70%乙醇中保存备用。将纤维素酶与果胶酶按一定比例混合均匀,取1 mL混合酶液放入0.5 mL离心管中,在37℃恒温保湿箱中预热5 min;将用蒸馏水洗净的根尖放入混合酶液中,保持37℃处理50 min;将多余酶液吸出,用蒸馏水将根尖冲洗3次,然后加入20μL 1×TE溶液,用镊子将根尖挤碎并混匀;用移液器吸取20μL细胞悬混液,于载玻片上方10 cm处滴片;晾干后在显微镜下观察染色体的分散效果。
1.2.3 基因组原位杂交(GISH) 基因组DNA的提取采用CTAB法[13]。以Chroma Tide Alexa Fluor 488-5-dUTP1标记的中间偃麦草基因组DNA作探针,以中国春基因组DNA作封阻,对CH08-141的根尖细胞中期染色体进行基因组原位杂交分析。
选取分散均匀、染色体数目完整的制片放入紫外交联仪中交联;每个制片滴加稀释好的探针(以2×SSC和 1×TE溶液稀释到 20 ng/μL)6μL;盖上塑料盖玻片,放入铁盘,在100℃沸水中处理5 min,再放入55℃恒温保湿箱中杂交过夜;杂交好的制片使用2×SSC溶液冲洗2次,晾干后滴1滴DAPI(4,6-diamidino-2-phenylindole),盖上玻璃盖玻片;在荧光显微镜下观察拍照。
1.2.4 SSR标记分析 选取48对平均分布于小麦基因组染色体上的小麦特有SSR引物,覆盖小麦全部基因组ABD染色体,每条染色体上长、短臂各选取2对引物,以晋太170、中国春、TAI7047、晋春5号、中间偃麦草为对照,对CH08-141进行分子标记的染色体定位,从而判定CH08-141中被代换染色体所属小麦基因组。
2 结果与分析
2.1 CH08-141抗病性分析
以SY95-71作为感病对照,用秆锈菌小种Ug99和白粉菌小种E09对CH08-141及其亲本进行抗病性鉴定。结果表明,CH08-141对这2个小种均表现高抗(表1)。
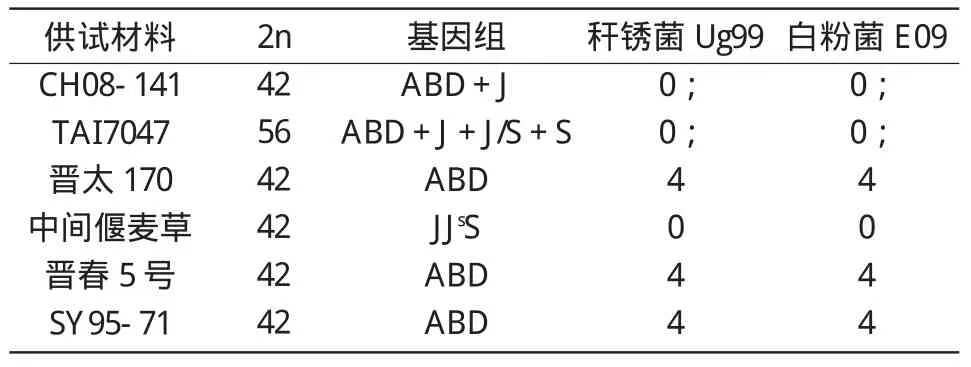
表1 CH08-141、八倍体小偃麦TAI7047及其亲本对白粉病和秆锈病的抗性表现
通过对其杂交亲本TAI7047、晋太 170及TAI7047的亲本中间偃麦草和晋春5号抗病鉴定结果进行分析,结果(表1)显示,中间偃麦草对Ug99和E09均表现免疫,其侵染型为0级;CH08-141和TAI7047表现为近免疫,其侵染型为0;级;而CH08-141和TAI7047的小麦亲本晋太170和晋春5号均高感秆锈病和白粉病,其侵染型为4级。因此,推测CH08-141对秆锈病和白粉病的抗病基因可能来源于八倍体小偃麦及其野生亲本中间偃麦草。
2.2 GISH结果分析
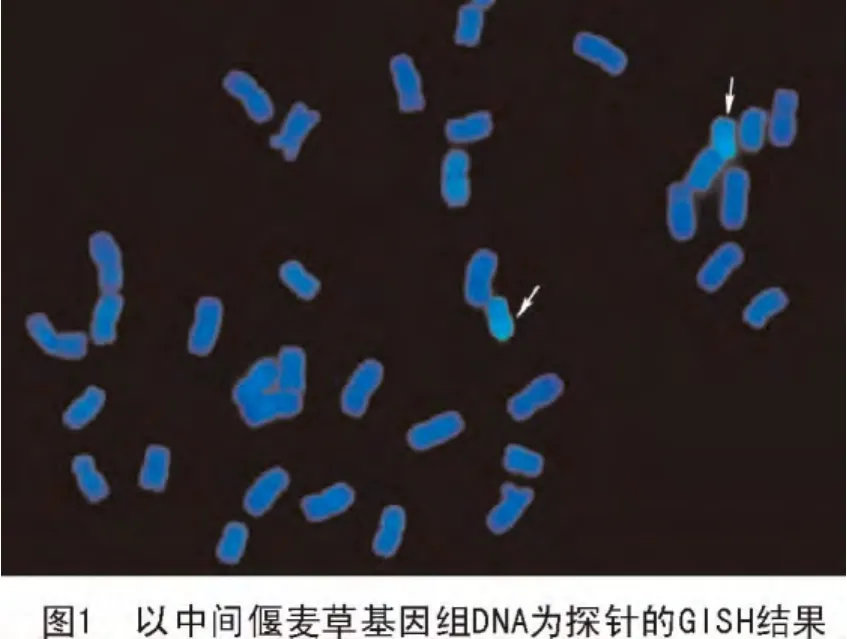
CH08-141是利用优质强筋小麦新品种晋太170与来源于中间偃麦草的八倍体小偃麦TAI7047通过回交转育法选育的高抗小麦秆锈病、白粉病的小麦新种质,其自交后代表现稳定,未发现性状分离的情况;不同单株种子进行根尖有丝分裂中期检测结果显示,其染色体数目均为2n=42,与普通小麦相同。
以Chroma Tide Alexa Fluor 488-5-dUTP1标记的中间偃麦草DNA作探针、中国春基因组DNA作封阻的原位杂交结果发现,每个细胞分裂相中均有1对染色体被激发出绿色荧光(图1),表明CH08-141中有1对染色体被中间偃麦草染色体所代换。
2.3 SSR标记结果分析
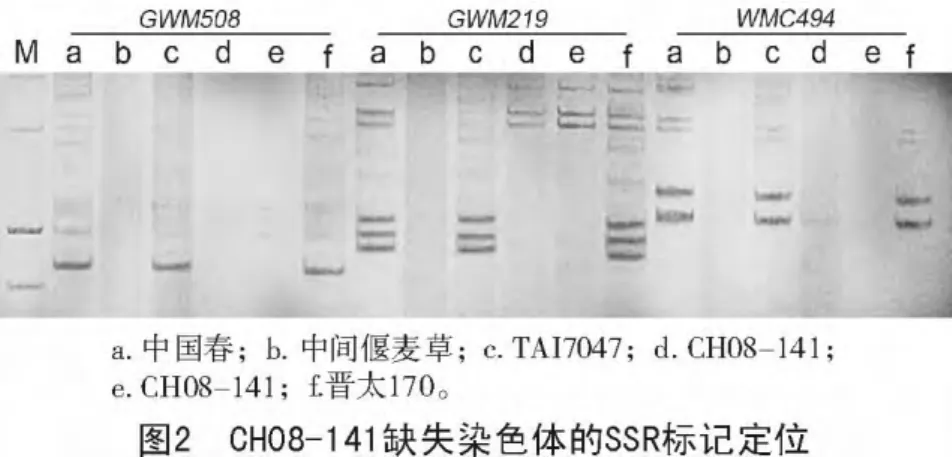
使用平均分布于小麦基因组ABD染色体上的48对SSR引物对CH08-141及其亲本TAI7047和晋太170以及TAI7047的亲本中间偃麦草和晋春5号进行小麦特异标记鉴定,结果显示,位于小麦染色体6BS上的GWM508和位于小麦染色体6BL上的GWM219,WMC494表现出明显差异,对照品种中国春、小麦亲本晋太170、晋春5号及TAI7047都扩增出其特有带型,而CH08-141、中间偃麦草则表现为带型缺失(图2);位于小麦其他染色体上的SSR引物扩增结果均表现为:CH08-141、对照品种中国春、小麦亲本晋太170、晋春5号及TAI7047都扩增出其特有带型,而中间偃麦草则表现为带型缺失。因此,初步判定CH08-141中被代换的染色体属于小麦B基因组第6同源群,即6B染色体。更加准确的结果还有待于进一步深入分析。
3 讨论
八倍体小偃麦是人们在利用偃麦草与普通小麦进行远缘杂交过程中人工选育的一种植物新物种,除含有普通小麦完整的42条染色体外,还包含来源于偃麦草的14条染色体,保留了偃麦草的许多优良性状,因其与普通小麦染色体组成相近,可以有效克服远缘杂交过程中极易出现的染色体不亲和现象,因此,成为普通小麦利用外源基因进行遗传改良的重要途径之一。TAI7047为畅志坚[9]选育的八倍体小偃麦新类型,具有抗条锈、叶锈、秆锈病及优质、多年生等优良特性,是偃麦草有用基因向小麦转移的重要桥梁材料。
CH08-141高抗秆锈病、白粉病,兼具双亲的优良农艺性状,是一个新型的小麦种质系。由于其小麦亲本晋太170高感秆锈病和白粉病,而TAI7047及其野生亲本中间偃麦草对秆锈病和白粉病表现免疫,因此,推测CH08-141对秆锈病和白粉病的抗病基因可能来自TAI7047,抗病基因也可能位于它们含有的偃麦草染色体上[14]。中间偃麦草的J或Js组染色体携带有抗白粉病及秆锈病基因[15],它与普通小麦杂交选育的后代如果含有J或Js组染色体,那么这个材料也就携带有此抗病基因。根据畅志坚[9]对八倍体小偃麦TAI7047的GISH分析,其外源基因组由1对S组染色体、1对S组与J组的中间易位染色体和6对J组染色体组成,未发现有Js组染色体存在。因此,推测CH08-141很可能是由中间偃麦草的J组染色体代换了小麦的6B染色体所形成的异代换系,其所含有的外源染色体对被代换的小麦染色体在功能上具有良好的补偿作用[16],不仅能够保持小麦高产、高效的特点,还具有偃麦草的某些优良性状,在小麦抗病育种及遗传改良中具有重要的意义。
[1]金善宝.中国小麦学[M].北京:中国农业出版社,1990.
[2]董玉琛.小麦的基因源[J].麦类作物学报,2000,20(3):78-81.
[3]张保民,张立琳,李小军,等.六倍体小黑麦和八倍体小偃麦杂交 F2的细胞学特性[J].河南农业科学,2012,41(7):7-11.
[4]王洪刚,刘树兵,亓增军,等.中间偃麦草在小麦遗传改良中的应用研究 [J].山东农业大学学报:自然科学版,2000,31(3):333-336.
[5]王黎明,林小虎,赵逢涛,等.中间偃麦草的染色体组及其优良基因向普通小麦的转移[J].中国草地,2005,27(1):57-63.
[6]高智,韩方普,何孟元,等.应用荧光原位杂交和染色体配对研究八倍体小冰麦中2的染色体组构成及染色体特征[J].植物学报,1999,41(1):25-28.
[7]Liu SB,Wang H G.Characterization of awheat-Thinopyron intermedium substitution linewith resistancetopowdery mildew[J].Euphytica,2005,143:229-233.
[8]孙善澄.小麦与偃麦草远缘杂交的研究[J].华北农学报,1987,2(1):7-12.
[9]畅志坚.几个小麦-偃麦草新种质的创制及分子细胞遗传研究[D].雅安:四川农业大学,1999:13-88.
[10]温辉芹,张立生,程天灵,等.国审小麦新品种晋太170的选育实践与体会[J].山西农业科学,2008,36(9):15-20.
[11]Han F P,Gao Z,Yu WC,et al.Minichromosome analysis of chromosome pairing,disjunction,and sister chromatid cohesion in maize[J].Plant Cell,2007,19(12):3853-3863.
[12] Han F P,Lamb J C,Birchler J A,et al.High frequency of centromereinactivation resulting in stable dicentric chromosomes of maize[J].Proc Natl Acad Sci USA,2006,103(9):3238-3243.
[13]Kimberlee K Kidwell,Thomas COsborn.Simple plant DNA isolation procedures[M]//Beckmann JS,Osborn T C.Plant Genomes:Methods for Genetic and Physical Mapping.Springer Netherlands:Kluwer Academic Publishers,1992.
[14]王建荣,畅志坚,郭秀荣,等.在小麦育种中利用偃麦草抗病特性的研究[J].山西农业科学,2004,32(3):3-7.
[15]闫金龙,畅志坚,孙美荣,等.中间偃麦草抗小麦白粉病基因导入及其抗性评价[J].华北农学报,2010,25(3):225-230.
[16]张延滨,高智,肖志敏,等.中间偃麦草的染色体组构成研究[J].植物研究,1996,16(2):190-194.
- 山西农业科学的其它文章
- 燕麦microRNAs及其靶基因的生物信息学预测

