体外诱导嗜水气单胞菌对喹诺酮类耐药及其耐药机制研究
邓玉婷,薛慧娟,2,姜兰,谭爱萍,吴雅丽,王伟利,罗理,赵飞
(1中国水产科学研究院珠江水产研究所/农业部渔用药物创制重点实验室/广东省水产动物免疫技术重点实验室,广东广州 510380;2上海海洋大学水产与生命学院,上海 201306)
体外诱导嗜水气单胞菌对喹诺酮类耐药及其耐药机制研究
邓玉婷1,薛慧娟1,2,姜兰1,谭爱萍1,吴雅丽1,王伟利1,罗理1,赵飞1
(1中国水产科学研究院珠江水产研究所/农业部渔用药物创制重点实验室/广东省水产动物免疫技术重点实验室,广东广州 510380;2上海海洋大学水产与生命学院,上海 201306)
【目的】探讨在亚抑菌浓度喹诺酮类药物培养后,嗜水气单胞菌Aeromonas hydrophila对喹诺酮类的药物敏感性变化及其耐药机制.【方法】以对喹诺酮类敏感的临床分离嗜水气单胞菌菌株和标准菌ATCC7966为研究对象,分别在含亚抑菌浓度萘啶酸(NAL)和环丙沙星(CIP)的培养基上逐步诱导培养.提取诱导菌的DNA,PCR扩增其gryA和parC基因,测序分析其喹诺酮类耐药决定区(QRDR)突变情况;测定诱导菌对诱导药物和11种非诱导药物的最小抑菌浓度(MIC)及添加外排泵抑制剂羰基氰化氯苯腙(CCCP)后的MIC,分析其敏感性变化与基因突变、外排作用的关系.【结果和结论】诱导后菌株对萘啶酸和环丙沙星的MIC分别提高了1 024和64 000倍,对非诱导药物也有不同程度提高;当萘啶酸和环丙沙星诱导浓度分别达到16和32 μg/mL或以上后,诱导菌株gyrA基因编码的氨基酸分别发生Asp87→Tyr和Ser83→Arg的变化,但两者parC基因编码的氨基酸均没有发生突变;添加CCCP后,只有氟喹诺酮类药物的MIC值略有下降,提示嗜水气单胞菌对喹诺酮类耐药存在靶基因突变及主动外排作用等多种耐药机制.
嗜水气单胞菌;喹诺酮类;体外诱导;基因突变;外排作用
嗜水气单胞菌Aeromonas hydrophila是一类属于气单胞菌科Aeromonadaceae、气单胞菌属Aeromonas的革兰阴性短杆菌,是我国流行最广泛的一种典型人-兽-水生动物共患病病原菌,在自然界中广泛分布,可以感染各种淡水鱼、两栖动物、鸟类、哺乳动物[1].嗜水气单胞菌可引起养殖鱼类细菌性败血症的暴发,给水产养殖业造成巨大的经济损失.喹诺酮类药物具有高效、副作用小、抗菌谱广等优点,是目前治疗嗜水气单胞菌感染的主要药物.然而,随着该药的普遍使用,耐药率逐年上升.耐药菌株的产生使得药效下降甚至失效,给临床治疗带来了极大的困难.
迄今为止,已报道的细菌对喹诺酮类药物的耐药机制主要有4种:靶基因突变,主动外排系统,细菌细胞膜通透性的改变以及质粒介导的喹诺酮类耐药机制,其中前3种耐药机制均为染色体突变介导的[2].研究发现,质粒介导的喹诺酮类耐药机制引起细菌对氟喹诺酮类药物的低水平耐药,而染色体突变介导的耐药可引起细菌对喹诺酮类药物的高水平耐药[3-5].喹诺酮类药物作用于革兰阴性细菌的DNA旋转酶和拓扑异构酶IV,DNA旋转酶由2个GyrA亚基和2个GyrB亚基组成,拓扑异构酶IV由2个ParC亚基和2个ParE亚基组成.当这2个酶的基因发生突变,导致一个或多个结构发生改变,增加了细菌对喹诺酮类药物的耐药性,这些突变位点通常发生在这2种酶不连续的序列中,称其为喹诺酮类耐药决定区(Quinolone resistance-determining regions,QRDR)[2].目前认为靶基因gyrA和parC的喹诺酮类耐药决定区与气单胞菌喹诺酮类耐药性的产生密切关联[6-9].国内外研究均是对嗜水气单胞菌临床分离株的耐药检测[6-9],而对体外应用喹诺酮类药物诱导选择相应的高度耐药菌及其靶基因喹诺酮类耐药决定区突变情况的研究则报道较少.为探讨靶基因突变引起的嗜水气单胞菌耐药机制,本文应用萘啶酸和环丙沙星以体外连续诱导的方式诱导出高度耐药菌,并通过聚合酶链反应(Polymerase chain reaction,PCR)分析喹诺酮类耐药决定区靶基因突变情况及主动外排系统对菌株药物敏感性的影响,以探讨体外诱导下嗜水气单胞喹诺酮类耐药机制,进而了解临床使用喹诺酮类药物对细菌耐药性的影响.
1 材料与方法
1.1 材料
1.1.1 菌株来源诱导受试菌株为中国水产科学研究院珠江水产研究所水产病害与免疫研究室临床分离的鱼源嗜水气单胞菌BZ和嗜水气单胞菌标准菌株ATCC7966,前期试验已就受试菌株对常见抗菌药物进行药敏试验[9],并鉴定为喹诺酮类药物敏感菌株.中国水产科学研究院珠江水产研究所水产病害与免疫研究室保存的临床分离鳖源嗜水气单胞菌44A,已鉴定对萘啶酸、环丙沙星、诺氟沙星和氧氟沙星耐药[9].标准菌ATCC7966由浙江省淡水水产研究所鱼病研究室馈赠,质控菌ATCC25922由华南农业大学兽医学院药理教研室馈赠.
1.1.2 受试药物、培养基、酶和其他试剂恩诺沙星(Enrofloxacin,ENR)、环丙沙星(Ciprofloxacin,CIP)、诺氟沙星(Norfloxacin,NOR)、氧氟沙星(Ofloxacin,OFL)、洛美沙星(Lomefloxacin,LOM)、多西环素(Doxycycline,DOX)、土霉素(Oxytetracycline,OTC)、甲氧苄啶(Trimethoprim,TMP)、氟苯尼考(Florfenicol,FLR)、氯霉素(Chloramphenicol,CHL)及新霉素(Neomycin,NEO)均为中国兽医药品监察所产品;萘啶酸(Nalidixic acid,NA)为广州康龙生物科技有限公司产品.以上药物用无菌双蒸水配成1 024 μg/mL的储存液,分装后-20℃条件保存备用,使用时再稀释成所需浓度.羰基氰化物间氯苯腙(Cyanide chlorophenyl hydrazone,CCCP)为美国Sigma公司产品.PCR反应试剂均为康为世纪公司产品.胰蛋白胨大豆琼脂(Tryptone soya agar,TSA)、LB琼脂(Luria-bertani agar)、LB肉汤(Luria-bertani broth)、水解酪蛋白肉汤(Muller-hinton broth,MH肉汤),为青岛海博生物技术有限公司产品.
1.2 方法
1.2.1 药物敏感试验采用微量肉汤稀释法测定受试菌以及诱导试验中所有培养浓度下的诱导菌株对12种受试药物的最小抑菌浓度(Minimum inhibitory concentration,MIC).同时,培养基中加入10 μg/mL的CCCP,再测定添加后的MIC.每次试验设置阳性对照(培养基加菌液)和阴性对照(仅加培养基),同时用大肠埃希菌ATCC25922为质控菌株.
1.2.2 体外诱导试验依据菌株药物敏感性结果,将受试菌株分别接种在含有1/4×MIC的萘啶酸和环丙沙星的固体培养基中,置于28℃培养箱中培养传代,并逐步2倍提高诱导药物质量浓度,依次在1/2×MIC、1×MIC、2×MIC、4×MIC等的含药培养基中培养传代,至诱导药物质量浓度达到128 μg/mL为止.同时将受试菌株在不含药液的固体培养基中同步传代培养作为对照,用微量稀释法测定每代诱导菌株的MIC.
1.2.3 交叉耐药试验将诱导筛选出的耐药菌株在TSA固体培养基中培养后,用微量稀释法测定菌株对非诱导药物的MIC,并比较诱导前后的MIC变化.若药物诱导后菌株对非诱导药物的MIC比诱导前升高4倍或以上,则为交叉耐药.
1.2.4 遗传稳定性试验将诱导后的菌株在不含药物的TSA固体培养基中培养20代,每1~2 d接种传代1次,依次测定第5、第10、第15、第20代传代菌株的MIC,以此判断其耐药的遗传稳定性.同时也以临床分离喹诺酮类耐药菌44A作为对照按上述方法进行试验.
1.2.5 细菌模板DNA提取采用水煮法提取菌株模板DNA.挑取纯化后的单菌落划于LB固体培养基,28℃培养12~16 h,用接种环挑取适量菌苔于含500 μL 1×TE的1.5 mL灭菌离心管,混匀后煮沸10 min,冰浴5 min,1 2000 r/min离心1 min,提取上清液即为DNA模板.
1.2.6 PCR扩增靶基因gyrA和parC及DNA序列分析根据参考文献[9]报道的相应引物序列,由上海博尚生物技术有限公司合成.引物序列、各PCR反应的退火温度见表1.将经10 g/L琼脂糖凝胶电泳检测为阳性的PCR扩增产物送交上海博尚生物技术有限公司测序,将测序结果用BLAST软件(http:∥www.ncbi.nlm.nih.gov)参照GenBank上标准嗜水气单胞菌序列进行序列比对分析,找出氨基酸序列突变位点.
2 结果
2.1 体外诱导菌株对喹诺酮类药物及其他药物MIC的变化
受试菌分别用诱导药物萘啶酸和环丙沙星从1/4×MIC开始,通过体外诱导获得萘啶酸和环丙沙星MIC均为128 μg/mL的高耐诱导菌.高耐诱导菌对萘啶酸和环丙沙星的MIC与诱导前相比,分别提高了1 024和64 000倍;对非诱导药物恩诺沙星、诺氟沙星、氧氟沙星和洛美沙星的MIC比诱导前增加了32~2 048倍,呈现交叉耐药现象;除甲氧苄啶外,对土霉素、多西环素、氟苯尼考、氯霉素和新霉素等其他类药物的MIC比诱导前增加了2~16倍(表2).
2.2 诱导耐药菌株的稳定性
经萘啶酸诱导的高耐菌株在无药平板连续传20代后对萘啶酸的MIC值仍保持在128 μg/mL,说明具有较好的遗传稳定性.经环丙沙星诱导的高耐菌株传代20代后,对环丙沙星的MIC值从128 μg/mL降到16 μg/mL,但仍在耐药范围之内.临床分离的耐药菌44A在传代前对萘啶酸和环丙沙星的MIC分别为>128和128 μg/mL,传代20代后的MIC维持不变.
2.3 诱导菌株的喹诺酮类耐药决定区突变
PCR扩增所有不同诱导质量浓度下获得的菌株靶基因gyrA和parC并进行序列比对,结果发现当萘啶酸诱导质量浓度达16 μg/mL或以上后获得的菌株其gyrA编码的氨基酸第87位天冬氨酸(Asp)均突变为酪氨酸(Tyr);而环丙沙星诱导质量浓度达32 μg/mL或以上后获得的菌株其gyrA编码的氨基酸均发生第83位的丝氨酸(Ser)突变为精氨酸(Arg);2种药物诱导后的菌株均未检测到ParC突变.而经过稳定性试验后的4株诱导菌,检测其靶基因,其GyrA的突变仍存在,也没有其他位点的变化(表2).
2.4 CCCP对受试菌MIC的影响
加入外排泵抑制剂CCCP(10 μg/mL)后,诱导菌对5种氟喹诺酮类药物的MIC比未添加前有小范围的降低,降低幅度为2~4倍,而对萘啶酸没有作用.对于其他类药物,添加CCCP后其MIC基本上没有改变.
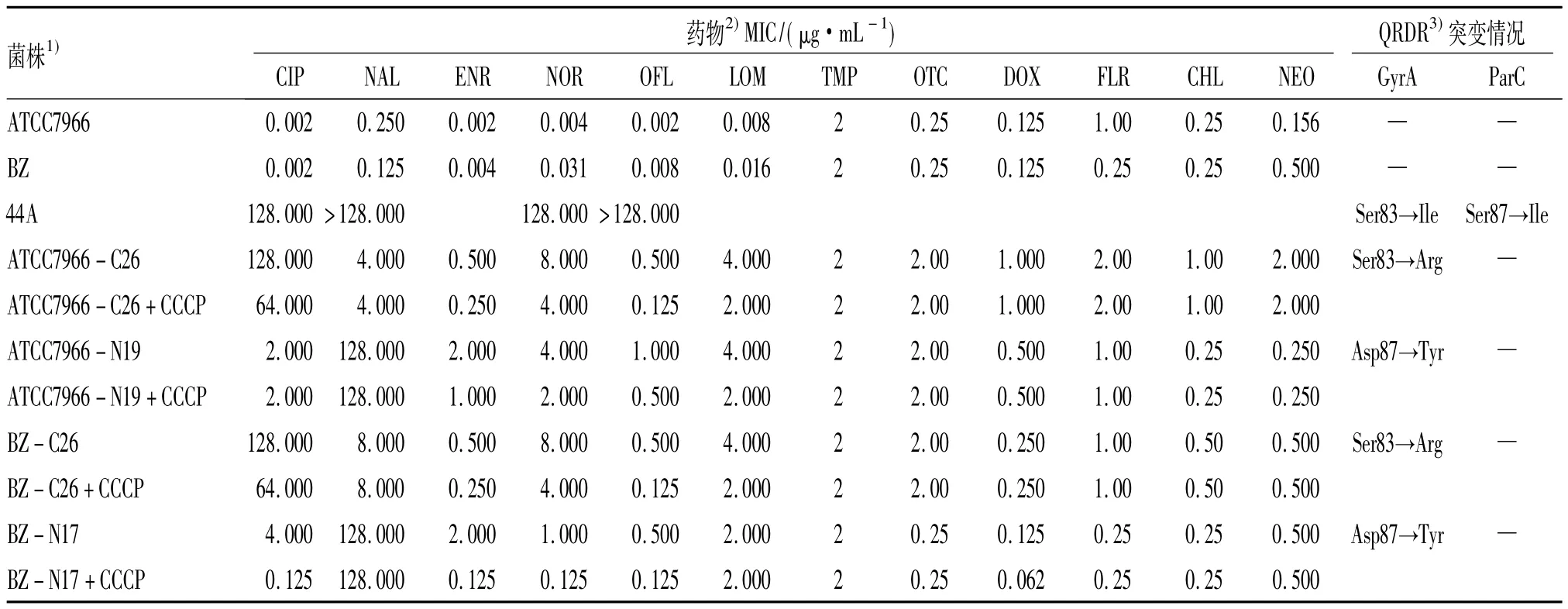
表2 诱导前后及加入CCCP前后诱导菌株对12种药物的MIC变化及喹诺酮类耐药决定区突变情况Tab.2 MICs of 12 antimicrobials before and after selection as well as CCCP added and quinolone resistance-determining region mutations of the strains
3 讨论与结论
有研究表明,基于MIC的治疗浓度,仅能阻止大部分敏感细菌的生长,但会使一些突变耐药菌株得到选择性的富集和扩增[10].本研究分别以萘啶酸和环丙沙星对临床分离的嗜水气单胞菌和标准菌株ATCC7966从1/4×MIC开始到128 μg/mL进行逐级诱导,128 μg/mL诱导后的菌株对测定的喹诺酮类各种药物呈现出交叉耐药,对其他类药物也呈现不同程度的耐药;验证了当嗜水气单胞菌从低质量浓度到高质量浓度的喹诺酮类药物培养基中培养时,非但不能完全杀死细菌,反而筛选出高度耐药菌.
喹诺酮类药物第1代以萘啶酸为代表及第3代以环丙沙星为代表的2种药物,由于环丙沙星在基本结构上引进不同基团后,与靶位点的结合能力增强,并介入了其他作用机制,因此其自发突变的频率比结构简单的萘啶酸低了1 000倍,为10-9~10-11μg/mL[2,11].本试验中,当萘啶酸诱导质量浓度达16 μg/mL、环丙沙星达32 μg/mL或以上时,只有gyrA基因编码的氨基酸发生突变,分别为Asp87→Tyr和Ser83→Arg;而parC基因编码的氨基酸一直没有发生突变.而我们对临床分离的喹诺酮类耐药嗜水气单胞菌的QRDR突变研究发现,萘啶酸耐药菌株的GyrA均发生突变,为Ser83→Ile,而环丙沙星耐药菌株除了GyrA突变外,其ParC亦同时发生突变,为Ser87→Ile或Ser87→Arg[9].国内外研究报道,临床分离的喹诺酮类耐药气单胞菌在GyrA第83位氨基酸多发生Ser→Ile突变,也有部分突变为Arg、Val或Asn[7-9];而ParC在第80位变异最多,为Ser→Ile,也有突变为Thr及Arg[7-8].诱导获得的与临床分离的耐药菌株靶位点突变存在差异,其原因可能是受自然条件多种因素的影响,造成临床菌株发生基因突变是多方向的、随机的,而诱导菌株是在人为干预下只添加一种药物筛选的,突变较为单一.
有研究表明,细菌对喹诺酮类药物耐药性的演变方式是由单点突变向多点突变方向逐渐发展[2,11].在大肠埃希菌喹诺酮类耐药机制研究中发现,大肠埃希菌对氟喹诺酮类耐药性的获得经历4个阶段,首先是GyrA的单位点突变,引起环丙沙星的低水平耐药(MIC为0.125~0.250 μg/mL);第2阶段是ParC的单位点突变,导致对环丙沙星的中度耐药(1~4 μg/mL);第3阶段GyrA第2个位点的突变以及第4阶段ParC第2个位点的突变,引起对环丙沙星的高度耐药,其MIC可分别达到8~64和128 μg/mL[2].从诱导试验可以看出,萘啶酸从低质量浓度到高质量浓度诱导获得的耐药菌只发生GyrA改变,可能与其作用位点单一有关.与大肠埃希菌耐药靶位点突变及发生过程不同的是,环丙沙星诱导质量浓度在32 μg/mL以下时,获得的耐药嗜水气单胞菌的部分碱基先发生突变,但是其编码的氨基酸并没有改变,直到诱导质量浓度达到32 μg/mL后,菌株的GyrA才发生1个氨基酸的突变.但是,随着诱导质量浓度继续增大,仍未有其他位点突变的发生.由此可推测在氟喹诺酮类药物选择压力下,嗜水气单胞菌对氟喹诺酮类耐药性的增加,除了靶位点突变外,其他机制可能发挥了重要作用.
在肠杆菌科细菌、铜绿假单胞菌、金黄色葡萄球菌等喹诺酮类耐药机制的研究中发现,这些耐药菌除了GyrA和ParC的喹诺酮类耐药决定区的改变外,其外膜和内膜蛋白及相关的外排泵亦经常发生突变,而外排泵抑制剂CCCP对多种以质子驱动力提供能量的外排泵(除依赖ATP水解驱动的ATP结合盒超家族外)的调控发挥了重要作用[12-13].萘啶酸或环丙沙星对受试菌诱导后,非诱导的喹诺酮类药物以及其他类药物的敏感性均出现不同程度的降低,喹诺酮类药物MIC上升的幅度比其他类药物的高几十甚至几百倍,可能与喹诺酮类药物之间结构相似有关.诱导菌株的药敏试验中添加CCCP后,诱导菌对氟喹诺酮类药物的敏感性存在不同程度的增加,而对萘啶酸及其他类药物的敏感性基本没影响,提示嗜水气单胞菌中存在一种以氟喹诺酮类为作用底物的外排泵.当低浓度环丙沙星诱导时,该外排泵起了主要作用,导致药物在体内蓄积减少;当环丙沙星诱导质量浓度继续增大时,细菌细胞内吸收的药物量大于排除的量,并且进一步促进细菌DNA的旋转酶发生改变,从而使嗜水气单胞菌对氟喹诺酮类耐药性增加.而其他类药物的MIC在诱导后增加可能与外膜通透性改变或其他类型的外排泵有关.Hernould等[14]首次报道了嗜水气单胞菌存在引起内源性多重耐药的外排泵AheABC,属于耐药节结化细胞分化家族,其作用底物最少有13种,其中9种为抗生素,但对氟喹诺酮类无作用.至于哪一类家族的外排泵对氟喹诺酮类药物发挥了重要作用,目前国内外仍在探索之中,本试验为下阶段对嗜水气单胞菌外排泵的耐药机制研究打下了基础.
从以上结果可以发现,在氟喹诺酮类药物的选择压力下,嗜水气单胞菌中外排系统、外膜通透性改变等非特异性的调节机制发挥了重要作用,减少细菌体内的药物蓄积;当在一定药物浓度作用下,嗜水气单胞菌的GyrA最容易发生突变,引起对喹诺酮类药物低水平耐药;随着耐药压力的逐步增大,外排作用协同突变机制,令细菌对喹诺酮类的耐药性进一步增加,使对喹诺酮类药物的耐药性上升到更高水平.由此可见,在临床使用喹诺酮类药物时,应正确选择敏感性高的药物并足量地使用才能达到有效的杀菌效果,并且避免长期施用某一种抗菌药物,给药方法不合理或者剂量不足可能是导致细菌喹诺酮类耐药性出现的重要原因之一,结果将严重影响药物的治疗效果.
[1]JANDA J M,ABBOTT S L.The genusAeromonas:Taxonomy,pathogenicity,and infection[J].Clin Microbiol Rev,2010,23(1):35-73.
[2]FABREGA A,MADUQA S,GIRALT E,et al.Mechanism of action of and resistance to quinolones[J].Microb Biotechnol,2009,2(1):40-61.
[3]岳磊,陈雪影,庄娜,等.健康鸡源肺炎克雷伯菌检测到质粒介导喹诺酮耐药qnrA基因[J].华南农业大学学报,2012,33(2):259-263.
[4]汤电,张小华,付晓平,等.广东地区鱼源大肠埃希菌ESBLs和PMQR流行分布调查[J].华南农业大学学报,2012,33(1):113-119.
[5]任艳娜,甄盼盼,李健,等.喹诺酮类耐药决定区、外排泵负调控基因对大肠杆菌氟喹诺酮高水平耐药分子机制的影响[J].中国畜牧兽医,2012,39(10):11-16.
[6]ALCIDE E,BLASCO M D,ESTEVE C.Mechanisms of quinolone resistance inAeromonasspecies isolated from humans,water and eels[J].Res Microbiol,2010,161 (1):40-45.
[7]KIM J H,HWANG S Y,SON J S,et al.Molecular characterization of tetracycline-and quinolone-resistantAeromonas salmonicidaisolated in Korea[J].J Vet Sci,2011,12(1):41-48.
[8]HAN J E,KIM J H,CHERESCA C H,et al.First description of theqnrS-like(qnrS5)gene and analysis of quinolone resistance-determining regions in motileAeromonasspp.from diseased fish and water[J].Res Microbiol,2012,163(1):73-79.
[9]薛慧娟,邓玉婷,姜兰,等.水产动物源嗜水气单胞菌药物敏感性及QRDR基因突变分析[J].广东农业科学,2012,39(23):149-153.
[10]楼海,沙巍,肖和平.氟喹诺酮类药物防突变浓度的研究进展[J].临床肺科杂志,2009,14(7):929-931.
[11]夏蕊蕊,国宪虎,张玉臻,等.喹诺酮类药物及细菌对其耐药性机制研究进展[J].中国抗生素杂志,2010,35 (4):255-260.
[12]BHARDWAJ A K,MOHANTY P.Bacterial efflux pumps involved in multidrug resistance and their inhibitors:Rejuvinating the antimicrobial chemotherapy[J].Recent Pat Antiinfect Drug Discov,2012,7(1):73-89.
[13]王春梅,何启盖,操继跃.细菌多重耐药泵的研究进展[J].畜牧兽医学报,2011,42(4):455-467.
[14]HERNOULD M,GAGNE S,FOURNIER M,et al.Role of the AheABC efflux pump inAeromonas hydrophilaintrinsic multidrug resistance[J].Antimicrob Agents Chemother,2008,52(4):1559-1563.
【责任编辑柴焰】
Characterization of quinolone resistance mechanism of Aeromonas hydrophila selected in vitro
DENG Yuting1,XUE Huijuan1,2,JIANG Lan1,TAN Aiping1,WU Yali1,WANG Weili1,LUO Li1,ZHAO Fei1
(1 Pearl River Fisheries Research Institute,Chinese Academy of Fishery Sciences/Key Laboratory of Fishery Drug Development,Ministry of Agriculture,P.R.China/Guangdong Province Key Laboratory of Aquatic Animal Immune Technology,Guangzhou 510380,China;2 College of Fishery and Life Science,Shanghai Ocean University,Shanghai 201306,China)
【Objective】To investigate the effect of the sub-inhibitory concentration of quinolones on resistance to quinolones inAeromonas hydrophilaand its mechanisms.【Method】The quinolone sensitive strains ofA.hydrophilafrom clinical and ATCC7966 were selectedin vitrostepwise exposure to increasing concentration of nalidixic acid(NAL)and ciprofloxacin(CIP)on solid medium.The quinolone resistance-determining region(QRDR)was sequenced to determine the mutation for quinolone resistance.The minimal inhibitory concentrations(MICs)of selected and non-selected antimicrobials as well as MIC by efflux pump inhibition cyanide chlorophenyl hydrazone(CCCP)of each strain were determined by broth microdilution method.The relationship between sensitivity varieties,mutations and efflux pump activitieswere analyzed.【Result and conclusion】The MICs of NAL and CIP increased 1 024-and 64 000-fold after selection,respectively,while the MICs of other antimicrobials increased diversely.When MIC of NAL or CIP inA.hydrophilareached 16 μg/mL or 32 μg/mL,Asp87→Tyr or Ser83→Arg,mutations of GyrA were identified,but no mutations of ParC were found.After CCCP was added,only MICs of fluoroquinolones caused a slight decrease,implying that it might include the quinolone mechanisms of target gene mutations and an active efflux system inA.hydrophila.
Aeromonas hydrophila;quinolone;selectionin vitro;mutation;efflux
S 511;S502
A
1001-411X(2014)01-0012-05
邓玉婷,薛慧娟,姜兰,等.体外诱导嗜水气单胞菌对喹诺酮类耐药及其耐药机制研究[J].华南农业大学学报,2014,35(1):12-16.
2013-02-21优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1611.020.html
邓玉婷(1982—),女,助理研究员,博士,E-mail:fourdeng@163.com;通信作者:姜兰(1965—),女,研究员,硕士,E-mail:jianglan2@tom.com
公益性行业(农业)科研专项(201203085);广东省鱼病防治专项资金(2012年);广东省科技计划项目(2011B020307001)

