普通野生稻苗期耐冷性QTLs的互作和聚合效应分析
郑加兴,张月雄,覃宝祥,邱永福,蒙姣荣,刘芳,马增凤,刘驰,李容柏,陈保善
(1广西大学农学院,广西南宁 530005;2广西大学,亚热带农业生物资源保护利用国家重点实验室,广西南宁 530005; 3广西农业科学院水稻研究所,广西南宁 530007;4广西大学生命科学与技术学院,广西南宁 530005)
普通野生稻苗期耐冷性QTLs的互作和聚合效应分析
郑加兴1,2,3,张月雄1,4,覃宝祥1,2,邱永福1,2,蒙姣荣2,4,刘芳1,2,马增凤3,刘驰3,李容柏1,2,陈保善2,4
(1广西大学农学院,广西南宁 530005;2广西大学,亚热带农业生物资源保护利用国家重点实验室,广西南宁 530005; 3广西农业科学院水稻研究所,广西南宁 530007;4广西大学生命科学与技术学院,广西南宁 530005)
【目的】普通野生稻Oryza rufipogonGriff.蕴含丰富的遗传多样性,对其进行耐冷性数量性状位点(QTLs)的挖掘和效应分析,可为水稻耐冷性分子育种提供宝贵的基因资源和理论支持.【方法】以籼稻品种9311为受体亲本、普通野生稻品系DP15和DP30为供体亲本,构建染色体片段代换系,鉴定了18个水稻苗期耐冷QTLs,将其中分别包含4个耐冷QTL且遗传背景一致的4个代换系qSCT-1-CSSL、qSCT-4-CSSL、qSCT-8-CSSL和qSCT-12-CSSL分别两两杂交得到2个聚合系(qSCT-1/qSCT-12)-CSSL和(qSCT-4/qSCT-8)-CSSL,对聚合系中各耐冷QTL的互作效应及聚合效应进行研究.【结果和结论】4个耐冷QTL对水稻耐冷性有加性效应;互作分析显示各耐冷QTL间在聚合系中均存在正向互作.聚合效应在qSCT-4与qSCT-8间表现为QTL间明显的累加效应,而qSCT-1与qSCT-12间聚合的累加效应不明显,表现为qSCT-12对qSCT-1有上位作用.
普通野生稻;耐冷性;数量性状位点(QTLs);染色体片段代换系;聚合效应
水稻的低温冷害在世界上许多国家均有发生,是全球性自然灾害.在水稻广泛种植的温带以及热带亚热带地区,冷害频繁发生,严重影响了水稻生产的稳定与发展,对世界粮食供给的安全与协调也产生了不小的影响.我国所有稻区均有冷害发生,每2~3年就发生一次较大冷害,每逢灾害年稻谷损失达50亿~100亿kg[1].在中国南方双季稻区早稻播种后,幼苗生长期常遇上寒潮天气,导致秧苗黄叶卷叶、生长迟钝、植株矮小,严重者甚至导致植株死苗,冷害不仅严重影响早稻的产量,而且还会延长早稻生育期而影响晚稻的生产计划,使得晚稻产量降低和稻米品质变差[2].为此,研究水稻耐冷性的遗传基础和遗传规律,对于提高水稻的耐冷能力、提高水稻产量等具有重要的理论和现实意义.
随着分子生物学相关技术的发展,对水稻耐冷性遗传分析和分子定位的研究已相继报道[3-18].但是由于不同研究者所用的遗传群体、分子标记和试验环境等方面的不同,研究结果差异较大,主要表现在不同群体、相同群体不同环境或不同鉴定方法所定位的耐冷QTL数目、染色体区域和效应大小有较大差异,导致这些QTLs难以被育种家利用.育种家最关心的是这些QTL的真实性、效应大小、不同QTL之间的互作关系以及它们潜在的育种价值.用分子标记辅助QTL聚合程序能够将感兴趣的QTL合并到一个群体中分析QTLs之间的作用方式及各自的效应大小,能够将多个有利的QTLs快速精确地聚合到一个个体中供育种利用[19-22],从而有效提高育种效率和精度.
早期的聚合育种一般利用携带优良目的基因的材料进行杂交,其遗传背景复杂,虽然分子标记辅助选择可在短时间内实现多个基因的聚合,但非目的基因仍会出现大量分离,因此要获得多基因聚合系仍需经过常规的育种程序[23].染色体片段代换系(Chromosome segment substitution line,CSSL)是基因组内部只有一个纯合染色体片段来自供体亲本、其他部分与受体亲本相同的品系[24].利用染色体片段代换系进行QTLs聚合研究,由于它消除了置换片段外其他基因区域的干扰,大大提高了对目标QTLs选择的精确性和效率.
郑加兴等[25]以广西普通野生稻核心种质材料DP15和DP30为供体亲本、低温敏感的籼稻品种9311为受体亲本,通过连续回交和SSR分子标记辅助选择,建立了2套普通野生稻染色体片段代换系,利用这2套普通野生稻染色体片段代换系鉴定了18个耐冷QTLs.本研究用分子标记辅助选择,选取4个遗传背景回复到轮回亲本9311背景较多的耐冷QTL-CSSLs分别进行杂交,获得了2个QTLs聚合系,分析了聚合系中耐冷QTLs间的作用方式及聚合效应.
1 材料与方法
1.1 材料
受体亲本为对低温敏感的籼稻品种9311,供体亲本为广西普通野生稻耐冷品系DP15和DP30.通过与轮回亲本连续回交结合SSR分子标记辅助选择至BC4F2世代,构建了一套由230个株系组成的、含导入片段相互重叠、最大程度覆盖野生稻基因组的普通野生稻染色体片段代换系.用这套染色体片段代换系BC4F2代的230个株系进行苗期耐冷性筛选鉴定,获得4个耐冷性较强的株系DC866、DC1006、DC1046及DC1081[25].用这4个耐冷株系建立作图群体,经连锁分析鉴定了qSCT-1、qSCT-4、qSCT-8和qSCT-12共4个耐冷QTLs,与其相连锁的最近分子标记分别是位于第1染色体的RM466、第4染色体的RM317、第8染色体的RM6208和第12染色体的RM5746,遗传距离分别为3.8、2.0、4.2和1.1 cM (图1).利用这些连锁标记通过分子标记辅助选择,在BC4F2分离群体中含有目标耐冷QTL的单株继续与轮回亲本9311回交并自交,产生BC5F2群体,在BC5F2群体中选择目标耐冷QTL位点纯合的单株自交,获得目标耐冷QTL位点纯合的BC5F3株系qSCT-1-CSSL、qSCT-4-CSSL、qSCT-8-CSSL和qSCT-12-CSSL.另外,在BC5F2代利用分子标记辅助选择具有目标耐冷QTL的纯合单株进行2个QTLs间的杂交聚合,聚合后的F2世代再通过分子标记检测选择2个目标QTLs位点均纯合的单株自交构建纯合QTL-CSSL聚合系.

图1 4个苗期耐冷性QTLs的分子图谱Fig.1 Linkage maps of four cold tolerant QTLs at the seedling stage
1.2 苗期耐冷性鉴定方法
种子在清水中泡种48 h后在人工气候箱催芽至根长2 cm,播种于44 cm×34 cm的托盘中.托盘中的泥土取自稻田,充分混合使土质均一,每托盘均匀地播12行,每行30株,中间2行设置为对照,对照品种分别为冷敏感的籼稻受体亲本9311和耐冷粳稻品种藤坂5号.幼苗在温室培育至“3叶”或“3叶1心”期转移至人工气候箱中冷处理,设置条件为温度10℃、湿度70%,光照12 000 lx,白天/黑夜各12 h,连续处理5 d后,转移至26℃气候箱恢复7 d.统计活苗数和死亡苗数并计算活苗率,活苗率=活苗数/总苗数×100%.重复3次.
水稻苗期耐冷级别鉴定参考国际水稻所的分级方法[26]略有改动.1级:所有叶片青绿或接近青绿;2级:第1叶枯黄,其余叶片青绿;3级:第1叶枯黄,第2叶1/2叶片枯黄,第3和第4叶片青绿;4级:第1叶和第2叶片枯黄,第3和第4叶片青绿;5级:第1叶、第2叶和第3叶1/4叶片枯黄,第4叶片青绿;6级:第1叶、第2叶和第3叶1/2叶片枯黄,第4叶青绿;7级:第1、第2叶和第3叶1/2叶片枯黄,或第1、第3叶和第2叶1/2叶片枯黄,第4叶1/4叶片枯黄;8级:第1、第2、第3和第4叶1/4叶片枯黄;9级:苗全部死亡.1~6级的为耐冷材料;7~9级的为冷敏感材料.
1.3 SSR标记引物
参照McCouch等[27]2002年公布的2 240对新增SSR标记,从中选取覆盖水稻全基因组的715个SSR标记,合成相应引物(引物序列见http:∥www.gramene.org),对2个亲本进行多态性分析.根据亲本间多态性分析结果选取多态性好、在水稻遗传图谱上均匀分布的232个标记作为构建染色体单片段代换系(CSSL)的全基因组检测标记,标记间的平均遗传距离是9.83 cM.
1.4 DNA提取、PCR反应及电泳分析
每个单株样本取约5 mg叶片放入2.0 mL离心管中用莱驰MM400(Retsch,Germany)组织研磨仪磨碎.DNA提取参照《精编分子生物学实验指南》中的CTAB制备方法[28].PCR反应体系:0.1 μL 5 U/μLTaqDNA聚合酶,2 μL模板DNA,1 μL 10 μmol/L引物,1 μL 2 mmol/L dNTP,1 μL 10×Buffer(100 μmol/LTris-HCl,500mmol/LKCl,15mmol/L MgCl2,0.1 g/L的明胶,pH8.3),用ddH2O补足10 μL.PCR扩增反应条件:先95℃预变性5 min;然后94℃30 s、55℃30 s、72℃30 s,反应30个循环;最后72℃延伸5 min.PCR扩增产物加入6×Loading Buffer后在70 g/L的聚丙烯酰胺凝胶(PAGE)中进行电泳,银染检测.
1.5 数据分析
采用SPSS17.0统计分析软件分析数据.通过t测验比较染色体片段代换系与轮回亲本9311之间耐冷性的差异,统计测验时以亲本9311的3个重复观察值合并为1个群体作对照,P≤0.001时认为代换片段上有耐冷QTL存在.参照Eshed和Zamir[29]的分析方法估算各个QTL的加性效应,加性效应值= (染色体片段代换系的表型值-亲本9311的表型值)/2.QTL的命名遵循McCouch等[30]制定的原则.
对聚合系F2世代2个QTLs 2种基因型植株的耐冷级别差异显著性采用双因素方差分析和Duncan’s多重比较.对聚合系与QTL-CSSLs植株间的耐冷性差异显著性采用Duncan’s多重比较分析.
2 结果与分析
2.1 QTL-CSSLs耐冷性验证
利用已鉴定的qSCT-1、qSCT-4、qSCT-8和qSCT-12这4个耐冷QTLs通过分子标记辅助轮回选择在BC5F3代获得4个耐冷QTL-CSSLs纯合家系qSCT-1-CSSL、qSCT-4-CSSL、qSCT-8-CSSL和qSCT-12-CSSL.将这4个QTL-CSSLs各培养300株幼苗至“3叶”期,以轮回亲本9311做对照进行苗期耐冷性鉴定.结果显示:4个QTL-CSSLs的活苗率均显著高于轮回亲本9311(P≤0.001),表明4个QTL-CSSLs所包含的QTLs对耐冷性有很强加性效应(表1).亲本9311几乎所有植株已枯黄,藤坂5号植株仍然保持青绿,4个QTL-CSSLs植株大部分叶片仍保持青绿(图2).这些结果与之前QTLs鉴定的结果基本一致,稍有不同的是之前鉴定耐冷效应并非最大的qSCT-12发展来的纯系qSCT-12-CSSL在4个QTL-CSSLs中表现出最强的耐冷性,可能与其在回交过程中排除了某些对耐冷性有负效应的背景QTL有关.鉴定结果再次验证了4个耐冷QTLs有较强的耐冷效应,由其发展来的4个QTL-CSSLs是分子标记辅助选择聚合育种良好材料.
2.2 背景分析
选取均匀覆盖水稻全基因组的144个SSR标记,检测4个耐冷QTL-CSSLs的背景(引物序列见http:∥www.gramene.org).从图3可以看出,4个耐冷代换系qSCT-1-CSSL、qSCT-4-CSSL、qSCT-8-CSSL和qSCT-12-CSSL基因组在亲本9311的背景均超过95%,除目标QTL区段外,其他残留野生稻片段均少于5%.在qSCT-1-CSSL中的第11染色体有3.6 Mb其他残留片段,在qSCT-12-CSSL中的第2和第4染色体分别有1.7 Mb和2.6 Mb其他残留片段,在qSCT-4-CSSL中的第6染色体有2.9 Mb其他残留片段,在qSCT-8-CSSL中的第7染色体有3.3 Mb其他残留片段.4个耐冷QTL-CSSLs经冷处理鉴定和分子标记检测残留片段的基因型,结合耐冷表型和基因型结果,用QTL分析软件Windows QTL Cartographer V2.5对4个耐冷代换系目标片段以外的其他残留片段进行QTL连锁分析发现,4个耐冷代换系的其他残留片段与耐冷性不相关.这表明,4个耐冷QTL-CSSLs的残留片段对耐冷QTL的表达没有影响.

表1 4个QTL-CSSLs上检测出的耐冷性QTL的耐冷效应Tab.1 Additive effects of QTLs for cold tolerance detected using CSSL of rice
2.3 互作分析
根据4个耐冷QTLs所在代换片段两端标记的基因型,通过分子标记辅助选择,在代换系BC5F2群体中选择目标代换片段均纯合的qSCT-1-CSSL与qSCT-12-CSSL杂交获得聚合系(qSCT-1/qSCT-12)-CSSL,目标代换片段均纯合的qSCT-4-CSSL与qSCT-8-CSSL杂交获得聚合系(qSCT-4/qSCT-8)-CSSL.将2个聚合系(qSCT-1/qSCT-12)-CSSL和(qSCT-4/ qSCT-8)-CSSL的F2群体分别培养312和306株幼苗,至“3叶”期经冷处理鉴定分别获得126和102株活苗,用水稻苗期耐冷级别鉴定法统计各存活单株的耐冷级别,利用距离4个耐冷QTLqSCT-1、qSCT-4、qSCT-8和qSCT-12最近的SSR标记RM466、RM317、RM6208和RM5746检测2个聚合系各种基因型的单株数,结果见表2.结合2个聚合系各自F2的基因型及其相应平均耐冷级别,用双因素方差分析(P<0.05)方法分析qSCT-1与qSCT-12之间的互作(图4).从图4a可以看出,在聚合系(qSCT-1/qSCT-12)-CSSL中,当qSCT-1是野生稻纯合等位基因时qSCT-12是野生稻纯合等位基因和杂合等位基因间均值存在显著差异;而当qSCT-12是野生稻纯合等位基因时,qSCT-1是野生稻纯合等位基因与杂合等位基因之间均值没有显著差异.同样用双因素方差分析(P<0.05)对qSCT-4与qSCT-8进行互作分析,从图4b可以看出,在聚合系(qSCT-4/qSCT-8)-CSSL中,当qSCT-4是野生稻纯合等位基因时,qSCT-8是野生稻纯合等位基因与杂合等位基因间均值存在显著差异;同样,当qSCT-8是野生稻纯合等位基因时,qSCT-4是野生稻纯合等位基因与杂合等位基因间均值有显著差异.

图2 4个耐冷QTL-CSSLs和轮回亲本9311的耐冷性表型Fig.2 Phenotypes of the parents and four QTL-CSSLs for cold tolerance
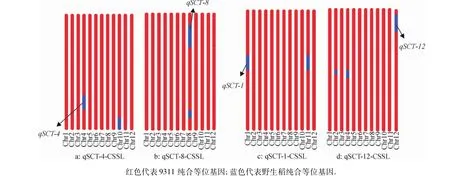
图3 4个耐冷QTL-CSSLs遗传背景Fig.3 Graphical genotypes of cold tolerance QTL-CSSLs

表2 聚合系F2群体各种基因型的单株数Tab.2 The individual plant number of different genotypes in two pyramiding lines
2.4 聚合效应分析
将4个耐冷QTL-CSSLs及其相对应的聚合系各培养400株幼苗至“3叶”期,以9311为对照经冷处理鉴定,统计活苗率,结果见图5.由图5可见,2个聚合系(qSCT-4/qSCT-8)-CSSL和(qSCT-1/qSCT-12)-CSSL的活苗率分别为60.3%和62.8%,4个耐冷代换系qSCT-1-CSSL、qSCT-4-CSSL、qSCT-8-CSSL和qSCT-12-CSSL的活苗率分别为57.5%、47.2%、47.1%和61.6%.对各家系的活苗率进行方差分析和多重比较的结果表明,4个耐冷QTL-CSSLs及2个聚合系的活苗率均显著高于受体亲本9311,可见4个耐冷QTLs对提高水稻苗期耐冷性有很大作用.比较4个耐冷QTL-CSSLs的耐冷性差异,qSCT-1-CSSL与qSCT-12-CSSL间以及qSCT-4-CSSL与qSCT-8-CSSL间均没有显著差异,但qSCT-1-CSSL或qSCT-12-CSSL的活苗率显著高于qSCT-4-CSSL或qSCT-8-CSSL.聚合系(qSCT-4/qSCT-8)-CSSL的活苗率显著高于qSCT-4-CSSL和qSCT-8-CSSL.聚合系(qSCT-1/qSCT-12)-CSSL与qSCT-1-CSSL及qSCT-12-CSSL的活苗率没有显著差异.有意思的是qSCT-4-CSSL与qSCT-8-CSSL聚合而得的(qSCT-4/qSCT-8)-CSSL活苗率与(qSCT-1/qSCT-12)-CSSL的活苗率没有明显差异.说明耐冷QTLsqSCT-4与qSCT-8的聚合效应明显,表现为QTLs间很强的累加效应,显著提高了其聚合系(qSCT-4/ qSCT-8)-CSSL的耐冷性;而qSCT-1与qSCT-12的聚合系(qSCT-1/qSCT-12)-CSSL耐冷性提高并不明显.

图4 聚合系F2群体耐冷QTLs不同基因型的耐冷级别Fig.4 Differences in cold tolerance scores for different genotypes in F2populations derived from crosses between QTL-CSSLs

图5 耐冷QTL-CSSLs及聚合系的活苗率Fig.5 Survival rates of QTL-CSSLs and pyramiding lines for cold tolerance
3 讨论与结论
传统的育种方法要将分散于各个种质中的多个优良基因聚合于同一个体来培育优良新品种的过程缓慢、难度较大,而将分子标记技术与常规育种相结合进行作物多基因(QTL)聚合的育种方法更加快速、高效.随着作物分子图谱的密度不断加大,以及越来越多的目标性状基因(QTL)的定位与克隆,分子标记辅助多基因聚合正日益体现出巨大的优势和应用前景[22,31-33].特别是在抗病虫方面,分子标记辅助选择多基因(QTL)聚合,能同时有效地将多个抗性基因(QTL)聚合于同一个体,能有效提高作物抗性、拓宽抗谱、获得持久抗性[34-38].在水稻耐冷QTLs定位方面已有不少研究报道[3-18],其中Saito等[10]用耐冷粳稻品种Silewah和冷敏感商业品种Hokkai241杂交构建的近等基因系在第4染色体长臂OSR15-RM317区域内定位并已克隆的一个抽穗期耐冷QTLCtb1与本研究定位的耐冷QTLqSCT-4处于同一区间内.Kuroki等[13]用耐冷品系Hokkai-PL9和冷敏感品系Hokkai287构建近等基因系将一个抽穗期耐冷QTLqCTB8定位在第8染色体短臂RM5647-RM9028区域内,与本研究定位的耐冷QTLqSCT-8所在区间很接近.Andaya等[12]用耐冷粳稻品种M202与冷敏感籼稻品种IR50杂交构建的F5~F10重组自交系在第12染色体BAC克隆OSJNBb0071I17上87 kb区域内定位的一个苗期耐冷QTLqCTS12与本研究定位的耐冷QTLqSCT-12所在区间很接近.前人已报道的耐冷QTLs往往只是对单个QTL的遗传效应进行分析,没有将多个耐冷QTLs聚合到一个重组体中,分析各QTL相互间的作用方式及其聚合效应.本研究首次将普通野生稻耐冷QTLs聚合到冷敏感籼稻品种9311背景中,分析各QTL相互间的作用方式及其聚合效应,为研究QTL间互作机理及QTL聚合育种打下一定的理论基础.
数量性状的复杂性是基因组内多基因相互作用的结果,要明晰各基因间的相互作用,就要排除背景中控制或影响相同性状的基因的干扰,在一致的遗传背景下加以分析,才能更清楚地认识各QTL间的作用方式.因此,我们不仅需要了解各个QTL所能提供的耐冷性效应,而且需要对不同QTL之间的互作方式有清晰地认识.只有这样,育种家才能有目的地向需要改良的品种导入目标QTL,以提高育种效率.在本研究聚合系(qSCT-1/qSCT-12)-CSSL的F2分离群体中,qSCT-1和qSCT-12是野生稻纯合等位基因或是杂合等位基因对提高耐冷性均有一定作用,但当2个QTL都是野生稻纯合等位基因比是杂合等位基因其聚合系耐冷性级别要低,即耐冷效应更强,表现出一定的正向互作效应.在聚合系(qSCT-4/qSCT-8)-CSSL的F2分离群体中,当qSCT-4和qSCT-8是野生稻纯合等位基因或是杂合等位基因均能够提高聚合系的耐冷性,而当2个QTL都是野生稻纯合等位基因其聚合系耐冷性级别显著低于杂合等位基因,即耐冷效应更强,QTL间的互作方式表现为显著正向互作效应.
本研究所涉及的2个聚合系中不同的QTLs两两组合的形式其聚合效应存在明显差异.qSCT-4与qSCT-8聚合的效应明显,表现为QTLs间明显的正向累加效应,聚合系(qSCT-4/qSCT-8)-CSSL的耐冷性显著提高,推测这2个耐冷QTLs可能属于不同作用途径的2个基因,且相互间作用方式可能存在正向互补,在育种上可以优先考虑把这2个QTLs聚合到一起产生强耐冷的品系;而qSCT-1与qSCT-12的聚合效应并不明显,其聚合系(qSCT-1/qSCT-12)-CSSL的耐冷表型接近于qSCT-12-CSSL的表型值,没有发现明显的累加效应,推测这2个耐冷QTLs可能属于相同作用途径的2个基因,一个效应强的QTL掩盖了另一个QTL的效应,表明qSCT-12对qSCT-1有上位作用,预示在育种上不适合将这2个QTLs单独聚合到一起.为了更全面地认识耐冷QTLs间的作用方式,我们配制了更多的不同QTLs间聚合以及多个QTLs聚合在一起的聚合系,为研究耐冷QTLs的作用机制及耐冷育种打下良好的材料基础.
4个耐冷QTL在各自的聚合系中相互间有普遍的互作关系,互作方式表现为正向互作效应,能够有效提高聚合系的耐冷性.2个聚合系中,qSCT-4与qSCT-8的聚合效应明显,表现为QTLs间明显的累加效应;而qSCT-1与qSCT-12聚合后QTLs间的累加效应不明显,qSCT-12对qSCT-1有上位作用.正向累加效应的耐冷QTLs间适于优先聚合产生强耐冷品系.
[1]黄力士,刘凌峰,刘之熙.稻耐冷性研究进展与前景[J].湖南农业科学,2008(1):3-6.
[2]詹庆才,曾曙珍,熊伏星,等.水稻苗期耐冷性QTLs的分子定位[J].湖南农业大学学报:自然科学版,2003,29(1):7-11.
[3]NAGAMINE T,NAKAGAHRA M.Genetic variation of chilling injury at seedling stage in rice,Oryza sativaL.[J].Japan J Breed,1990,40(4):4549-4551.
[4]BERTIN P,KINET J M,BOUHARMONT J.Evaluation of chilling sensitivity in different rice varieties.Relationship between screening procedures applied during germination and vegetative growth[J].Euphytica,1996,89(2):201-210.
[5]QIAN Qian,ZENG Dali,HE Ping,et al.QTL analysis of the rice seedling cold tolerance in a double haploid population derived from anther culture of a hybrid between indies and japoniea rice[J].Chinese Sci Bull,2000,45 (5):448-453.
[6]KIM K M,SOHN J K,CHUNG I K.Analysis of OTP8511 RAPD fragments closely linked with cold sensitivity at seedling stage in rice(Oryza sativaL.)[J].Mol Cell,2000,10(4):382-385.
[7]ANDAYA V C,MACKILL D J.QTLs conferring cold tolerance at the booting stage of rice using recom-binant inbred lines from ajaponica×indicacross[J].Theor Appl Genet,2003,106:1084-1090.
[8]LIU Fengxia,SUN Chuanqing,TAN Lubin,et al.Identification and mapping of quantitative trait loci controlling cold-tolerance of Chinese common wild rice(O.rufipogonGriff.)at booting to flowering stages[J].Chinese Sci Bull,2003,48(19):2068-2071.
[9]ANDAYA V C,MACKILL D J.Mapping of QTLs associated with cold tolerance during the vegetative stage in rice[J].J Exp Bot,2003,54:2579-2585.
[10]SAITO K,HAYANO-SAITO W,MARUYAMA-FUNATSUKI Y,et al.Physical mapping and putative candidate gene identification of a quantitative trait locus Ctb1 for cold tolerance at the booting stage of rice[J].Theor Appl Genet,2004,109(3):515-522.
[11]ZHANG Zhihong,SU Li,CHEN Wei,et al.A major QTL conferring cold tolerance at early seeding stage using re-combinant inbred lines of rice(Oryza sativaL.)[J].Plant Sci,2005,168(2):527-53.
[12]ANDAYA V C,TAI T H.Fine mapping of the qCTS12 locus,a major QTL for seedling cold tolerance in rice[J].Theor Appl Genet,2006,113(3):467-475.
[13]KUROKI M,SAITO K,MATSUBA S,et al.A quantitative trait locus for cold tolerance at the booting stage on rice chromosome 8[J].Theor Appl Genet,2007,115 (5):93-600.
[14]LOU Qiaojun,CHEN Liang,SUN Zongxiu,et al.A major QTL associated with cold tolerance at seedling stage in rice (Oryza sativaL.)[J].Euphytica,2007,158(1):87-94.
[15]JIANG Ling,XUN Meimei,WANG Jiankang,et al.QTL analysis of cold tolerance at seedling stage in rice(Oryza sativaL.)using recombination inbred lines[J].J Cereal Sci,2008,48(1):173-179.
[16]KOSEKI M,NORIYUKI K,YONEBAYASHI S,et al.I-dentification and fine mapping of a major quantitative trait locus originating from wild rice,controlling cold tolerance at the seedling stage[J].Mol Genet Genomics,2010,284 (1):45-54.
[17]SUH J P,JEUNG J U,LEE J I,et al.Identification and analysis of QTLs controlling cold tolerance at the reproductive stage and validation of effective QTLs in cold-tolerant genotypes of rice(Oryza sativaL.)[J].Theor Appl Genet,2010,120(5):985-995.
[18]SUH J P,LEE C K,LEE J H,et al.Identification of quantitative trait loci for seedling cold tolerance using RILs derived from a cross between japonica and tropical japonica rice cultivars[J].Euphytica,2012,184(1):101-108.
[19]CHEN Sheng,LIN Hongxuan,ZHANG Qifa.Improvement of bacterial blight resistance of‘Minghui 63’,an elite restorer line of hybrid rice,by molecular marker-assisted selection[J].Crop Sci,2000,40:239-244.
[20]ZHOU P H,TAN Y F,HE Y Q,et al.Simultaneous improvement for four quality traits of Zhenshan 97,an elite parent of hybrid rice,by molecular marker-assisted selection[J].Theor Appl Genet,2003,106(2),326-331.
[21]ASHIKARI M,MATSUOKA M.Identification,isolation and pyramiding of quantitative trait loci for rice breeding[J].Trends Plant Sci,2006,11(7):344-350.
[22]ZONG Guo,WANG Ahong,HAN Bin,et al.A pyramid breeding of eight grain-yield related quantitative trait loci based on marker-assistant and phenotype selection in rice (Oryza sativaL.)[J].J Genet Genomics,2012,39 (7):335-350.
[23]刘冠明,李文涛,张桂权,等.水稻单片段代换系代换片段的QTL鉴定[J].遗传学报,2004,31(12):1395-1400.
[24]曾瑞珍,施军琼,张桂权,等.籼稻背景的单片段代换系群体的构建[J].作物学报,2006,32(1):88-95.
[25]郑加兴,李容柏,陈保善,等.普通野生稻(Oryza rufipogonGriff.)苗期耐冷性QTL的鉴定和分子定位[J].中国水稻科学,2011,25(1):52-58.
[26]IRRI.Standard evaluation system for rice[M].Manila:IRRI,1988.
[27]McCOUCH S R,TEYTELMAN L,XU Y B,et al.Development and mapping of 2240 new SSR markers for rice (Oryza sativaL.)[J].DNA Res,2002,9(Suppl.):257-279.
[28]奥斯伯F,金斯顿R E,塞得尔J G,等.精编分子生物学实验指南[M].颜子颖,王海林,译.北京:科学出版社,2001:37-38.
[29]ESHED Y,ZAMIR D.An introgression line population ofLycopersicon pennelliiin the cultivated tomato enables the identification and fine mapping of yield-associated QTL[J].Genetics,1995,141:1147-1162.
[30]McCOUCH S R,CHO Y G,YANO M,et al.Report on QTL nomenclature[J].Rice Genet Newslett,1997,l4:11-13.
[31]ASHIKARI M,SAKAKIBARA H,LIN S,et al.Cytokinin oxidase regulates rice grain production[J].Science,2005,309:741-745.
[32]TWARDOW S M,MASOJC P,MILCZARSKI P.Pyramiding genes affecting sprouting resistance in rye by means of marker assisted selection[J].Euphytica,2005,143(3):257-260.
[33]杨梯丰,曾瑞珍,张桂权,等.水稻粒长基因GS3在合育种中的效应[J].分子植物育种,2010,8(1):59-66.
[34]SING S,SIDHU J S,HUANG N,et al.Pyramidig three bacterial blight resistance genes(xa5,xa13 and Xa21)using marker assisted selection into indica rice cultivar PR106[J].Theor App Genet,2001,102:1011-1015.
[35]NARAYANANA N,BAISAKHA N,VERA C M,et al.Molecular breeding for the development of blast and bacterial blight resistance in rice cv.IR50[J].Crop Sci,2002,42(6):2072-2079.
[36]QIU Yongfu,GUO Jianping,HE Guangcun,et al.Development and characterization of japonica rice lines carrying the brown planthopper-resistance genes BPH12 and BPH6[J].Theor Appl Genet,2012,124:485-494.
[37]倪大虎,易成新,李莉,等.分子标记辅助培育抗白叶枯病和稻瘟病三基因聚合系[J].作物学报,2008,34 (1):100-105.
[38]邓其明,周宇爝,蒋昭雪,等.白叶枯病抗性基因Xa21、Xa4和Xa23的聚合及其效应分析[J].作物学报,2005,31(9):1241-1246.
【责任编辑周志红】
Pyramiding and interacting effects of QTLs for cold tolerance at the seedling stage in common wild rice,Oryza rufipogon Griff.
ZHENG Jiaxing1,2,3,ZHANG Yuexiong1,4,QIN Baoxiang1,2,QIU Yongfu1,2,MENG Jiaorong2,4,LIU Fang1,2,MA Zengfeng3,LIU Chi3,LI Rongbai1,2,CHEN Baoshan2,4
(1 College of Agriculture,Guangxi University,Nanning 530005,China;2 State Key Laboratory of Conservation and Utilization of Subtropical Agro-bioresources,Guangxi University,Nanning 530005,China; 3 Institute of Rice Research,Guangxi Academy of Agricultural Sciences,Nanning 530007,China; 4 College of Life Science and Technology,Guangxi University,Nanning 530005,China)
【Objective】There is a rich genetic diversity in common wild rice,Oryza rufipogonGriff..Exploitation and effective analysis of cold tolerance quantitative trait loci(QTLs)from the wild rice could provide gene resources and theoretical support for rice cold tolerant molecular breeding.【Method】In our previous study,a total of 18 cold tolerant QTLs distributing throughout all 12 chromosomes of rice genome were discovered using 230 chromosome segment substitution lines(CSSLs)which were developed from two crosses between the cultivar,9311 as recipient parent and two lines of core resources of the common wild rice,DP15 and DP30 as donor parents.In this study,the interacting and pyramiding effects of four cold tolerant QTLsqSCT-1,qSCT-4,qSCT-8 andqSCT-12 which were previously identified in the CSSLs werestudied using two pyramiding lines,(qSCT-1/qSCT-12)-CSSL and(qSCT-4/qSCT-8)-CSSL obtained from two crosses between qSCT-1-CSSL and qSCT-12-CSSL,and qSCT-4-CSSL and qSCT-8-CSSL respectively against a uniform genetic background.【Result and conclusion】The results indicated that four cold-tolerance QTLs with an additive effect could significantly improve the resistance to rice cold stress separately;there might exist positive interaction effect among these cold tolerance QTLs in pyramiding lines.There was a significant addition effect betweenqSCT-4 andqSCT-8,but no significant epistasis effect betweenqSCT-12 andqSCT-1.
Oryza rufipogonGriff.;cold tolerance;quantitative trait loci(QTLs);chromosome segment substitution lines;pyramiding effects
S336
A
1001-411X(2014)01-0029-08
郑加兴,张月雄,覃宝祥,等.普通野生稻苗期耐冷性QTLs的互作和聚合效应分析[J].华南农业大学学报,2014,35(1):29-36.
2013-03-22优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1609.010.html
郑加兴(1978—),男,博士研究生,E-mail:jiaxing007@126.com;通信作者:李容柏(1957—),男,研究员,博士,E-mail:lirongbai@126.com;陈保善(1959—),男,教授,博士,E-mail:chenyaoj@gxu.edu.cn
国家自然科学基金(30860142);国家转基因生物新品种培育科技重大专项(2009ZX08009-070B);广西科学技术与开发项目(桂科攻1123001-3B);广西大学科研基金项目(XDZ 11008);广西农业科学院基本业务费(201005基)

