Aurora-A mt-P53和c-myc在大肠癌中的表达及意义
苏晓路 李晓鸣 田卫华 张 煦
Aurora-A mt-P53和c-myc在大肠癌中的表达及意义
苏晓路①李晓鸣①田卫华②张 煦③
目的:研究中心体相关激酶Aurora-A、突变型P53(mt-P53)和c-myc在大肠癌中的表达规律,探讨其相互关系及在肿瘤发生发展中的作用。方法:应用组织芯片和免疫组织化学技术(SP法)检测Aurora-A、mt-P53和c-myc在130例大肠癌、癌旁组织和正常大肠组织中的表达,并结合临床病理学参数进行综合分析。结果:Aurora-A在正常大肠组织、癌旁组织和大肠癌中的阳性表达率分别为0,35%,69%。mt-P53分别为0,20%,57%。c-myc分别为0,37%,76%。与正常大肠组织和癌旁相比,癌组织中Aurora-A、mt-P53和c-myc的表达明显升高(P<0.01);三者的表达与肿瘤的浸润程度有关(P<0.05),mt-P53和c-myc还与Dukes'分期和淋巴结转移关系密切(P<0.05)。在大肠癌中Aurora-A的阳性表达与mt-P53、c-myc的阳性表达呈显著正相关(分别为r=0.362,P<0.01;r=0.487,P<0.01),mt-P53和c-myc之间也存在显著正相关(r=0.242,P<0.01)。结论:Aurora-A和c-myc蛋白的过表达与P53的突变在大肠癌的发生、侵袭和转移中发挥着重要作用。综合分析Aurora-A、mt-P53和c-myc蛋白的表达对大肠癌的早期诊断及预后判断具有重要价值。
Aurora-A P53 c-myc 组织芯片 大肠癌
有丝分裂过程的偏差会导致基因组不稳定从而引发肿瘤,研究发现,Aurora-A是维持基因组稳定性所必需的、关键的有丝分裂调节因子,这个中心体相关激酶在肿瘤细胞中过度表达[1]。目前,国外有文献报道Aurora-A和经典抑癌基因P53、原癌基因c-myc在肿瘤的发病机制中可能存在一定联系[2-4]。而大肠癌是威胁人类健康的重要疾病之一,全球每年有超过1百万的新发病例,近50万的患者死于该病。其发病率位于欧美发达国家恶性肿瘤第3位,死亡率位于第2位[5]。我国大肠癌发病率呈上升趋势,发病率位于恶性肿瘤的第3位,而病死率位于第5位[6-7]。本研究利用组织芯片和免疫组化技术检测Aurora-A、mt-P53和c-myc蛋白在大肠癌组织、癌旁组织和正常大肠组织中的表达,旨在探讨它们在大肠癌发生、发展中的作用及相互关系,并为临床综合判断患者的预后提供帮助。
1 材料与方法
1.1 材料
1.1.1 标本选择 收集兰州大学第二医院、甘肃省肿瘤医院和兰州石化医院2001年6月至2013年7月手术切除大肠腺癌石蜡包埋标本130例,其中男69例,女61例;平均年龄52.5(26~77)岁。入选条件:1)病史资料齐全;2)术前未经放疗及化疗患者。组织学类型:管状腺癌45例,乳头状腺癌36例,黏液腺癌49例。组织分化:高分化30例,中分化52例,低分化48例。浸润程度:黏膜及黏膜下层22例,肌层48例,浆膜层60例。有淋巴结转移72例,无淋巴结转移58例。3)取该组大肠腺癌病例中肿瘤手术切除标本切缘处正常大肠组织(病理证实)石蜡包埋标本56例作为对照。4)在大肠癌石蜡包埋标本相应部位标记癌旁组织,在组织芯片制作时取出,选54例作为对照。
1.1.2 组织芯片设计和制备 将大肠腺癌石蜡包埋标本重新切片,HE染色。由病理专家复查HE切片,在显微镜下分别用标记笔画圈标记出典型癌灶(富有肿瘤细胞且无坏死出血的区域)及癌旁组织(距肿瘤2 cm),然后在组织蜡块上相应的区域标记选取组织点,并参照文献[8]的方法应用组织芯片仪制备组织芯片。
1.2 方法
1.2.1 免疫组织化学染色 采用SP法,兔抗人Aurora-A多克隆抗体购自英国AbD seroTec公司,鼠抗人P53单克隆抗体(此抗体与人来源的野生型和突变型P53氨基末端的11-25氨基酸残基所组成的抗原决定簇反映,但免疫组织化学方法只能检出mt-P53,因wt-P53蛋白极不稳定,免疫组织化学一般难以检测)、鼠抗人c-myc单克隆抗体、SP超敏试剂盒、DAB显色试剂盒、PBS缓冲液、柠檬酸盐抗原修复缓冲液和防脱片购自福州迈新公司。染色步骤按说明书进行,抗体Aurora-A工作液浓度为1∶100,P53和c-myc为即用型,三者都需要抗原修复,DAB显色,苏木素复染。以PBS代替一抗作为阴性对照,已知阳性片作为阳性对照。
1.2.2 判定标准 Aurora-A、mt-P53和c-myc阳性染色为黄色、棕黄色或棕褐色颗粒,Aurora-A定位于细胞质,mt-P53定位于细胞核,c-myc则主要定位于细胞核,胞质中也有少量分布。采用二级计分法,染色强度分类:0分为无色;1分为黄色;2分为棕黄色;3分为棕褐色(深浅与背景色相对比)。阳性细胞计数:在400倍镜下选定10个视野肉眼显微镜下观察,每个视野计数100个肿瘤细胞,共计1 000个细胞,计算阳性细胞所占百分比。阳性细胞百分比=阳性细胞数/所计数细胞总数×100%。1分为阳性细胞≤10%;2分为11%~50%;3分为51%~75%;4分为>76%。两者记分相乘后0~3分为阴性;>3分为阳性[9]。
1.3 统计学方法
计数资料采用χ2检验,相关分析采用Spearman等级相关分析。统计学软件采用SPSS 19.0软件包,P<0.05为差异有统计学意义。
2 结果
2.1 Aurora-A、mt-P53和c-myc在大肠癌、癌旁组织、正常大肠组织中的表达
构建六张组织芯片分别含42个位点(包括2个标记点)。其中个别脱落位点用常规切片补充。在正常大肠组织中,Aurora-A低表达,仅个别腺细胞胞质中出现黄色颗粒并呈散在分布,mt-P53和c-myc无一例表达,三者阳性表达率全部为0。在癌旁组织中,Aurora-A、mt-P53和c-myc染色阳性细胞胞质或胞核呈黄色或棕黄色颗粒并散在或片状分布,阳性表达率分别为35%(19/54)、20%(11/54)和37%(20/54),阳性细胞主要见于异型增生的上皮,成纤维细胞、平滑肌细胞和血管内皮细胞中未见表达。Aurora-A、mt-P53和c-myc在大肠癌组织中的表达明显增强,染色强度均强于正常组织和癌旁,阳性细胞胞质或胞核出现棕褐色颗粒并呈片状和/或弥漫分布,阳性表达率分别是69%(90/130)、57%(74/130)和76%(99/130),明显高于癌旁组织(P<0.01)和正常组织(P<0.01)。病理免疫组织化学结果见图1、2、3。
2.2 Aurora-A、mt-P53和c-myc的表达与大肠癌临床病理特征的关系
Aurora-A、mt-P53和c-myc的表达与性别、年龄、组织学分型及病理学分级无关(P>0.05),但都与浸润程度有关(P<0.05),mt-P53和c-myc还与淋巴结转移和Dukes'分期关系密切(P<0.05),而Aurora-A则与淋巴结转移和Dukes'分期无关(P>0.05,表1)。
2.3 Aurora-A、mt-P53和c-myc在大肠癌中的表达关系
将130例大肠腺癌组织Aurora-A、mt-P53和c-myc的表达结果相互对照,经Spearman等级相关分析显示,Aurora-A和mt-P53、c-myc之间存在显著正相关(r=0.362,P<0.01;r=0.487,P<0.01);mt-P53和c-myc之间也存在显著正相关(r=0.242,P<0.01,表2,3)。
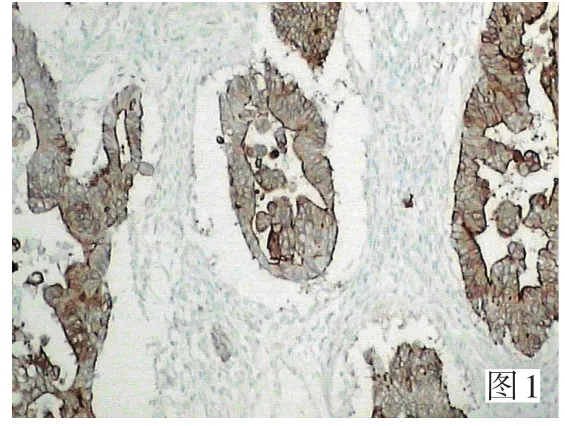
图1 Aurora-A在中分化大肠腺癌中的表达 (SP×200)Figure 1 Expression of Aurora-A in moderately differentiated adenocarcinoma (SP×200)

图2 mt-P53在中分化大肠腺癌中的表达 (SP×200)Figure 2 Expression of mt-P53 in moderately differentiated adenocarcinoma (SP×200)
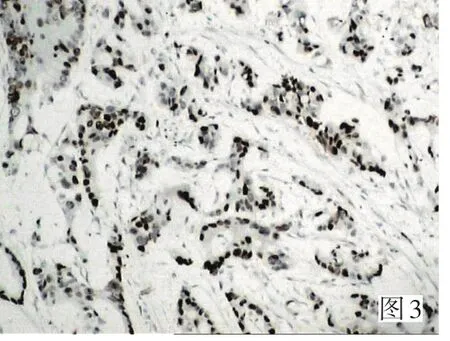
图3 c-myc在低分化大肠腺癌中的表达 (SP×200)Figure 3 Expression of c-myc in poorly differentiated adenocarcinoma (SP×200)

表1 Aurora-A,mt-P53,c-myc蛋白表达与大肠癌临床病理特征的关系Table 1 Relationship of Aurora-A,mt-P53,and c-myc expression with the clinicopathologic characteristics of colorectal cancer

表2 Aurora-A和mt-P53,c-myc在大肠癌中表达的关系Table 2 Correlation among the expression of Aurora-A,mt-P53,and c-myc in colorectal cancer

表3 mt-P53和c-myc在大肠癌中表达的关系Table 3 Correlation between the expression of mt-P53 and c-myc in colorectal cancer
3 讨论
人类Aurora-A属于Aurora家族,是新近发现的一个和中心体相关的丝氨酸/苏氨酸激酶,它在有丝分裂中发挥重要作用,参与调节中心体功能成熟、纺锤体装配和染色体的正确分离,当Aurora-A过表达时可导致中心体扩增、染色体不稳定和细胞恶性转化[1]。因此,高表达的Aurora-A是一种潜在的癌基因,它在有丝分裂中的调节作用可能是其引发肿瘤的原因之一。野生型P53(wt-P53)蛋白在维持基因组稳定方面同样发挥重要作用,它参与细胞周期调控,对细胞分裂及增殖起负调控作用,被认为是细胞生长的“监控器”。wt-P53基因突变将导致其蛋白产物功能的改变,并以负显性的方式控制正常等位基因的活性。研究[2-3]发现wt-P53下调、缺失或突变都会导致中心体扩增和基因组不稳定。与wt-P53相比,mt-P53蛋白由于构象改变,半衰期延长至2~12 h,含量增高,代谢稳定性增加,故可用免疫组织化学方法检出。原癌基因c-myc为一管家基因,其蛋白在细胞质内合成,与蛋白配基(只要是Max蛋白)形成杂合体后转移到细胞核,再与特异性DNA序列相结合,进而激活或抑制许多靶基因的转录,参与细胞的生长、凋亡和分化。当细胞中的c-myc基因被异常激活后,其mRNA和蛋白表达水平异常增高,活化转录,使细胞脱离正常生长调节的限制而具有高度增生潜能,开始向恶性表型转化。因此c-myc作为一种核蛋白转录因子,其过表达常导致肿瘤的发生,最近有研究发现Aurora-A可直接激活c-myc[4]。本文的实验结果显示,与癌旁及正常组织相比,Aurora-A、mt-P53和c-myc在大肠癌中的表达明显增强(P<0.01),提示Aurora-A、mt-P53和c-myc蛋白表达的升高与大肠癌的发生有关,联合检测这三种蛋白的表达有助于临床早期诊断大肠癌。
关于Aurora-A、mt-P53和c-myc与大肠癌临床病理特征的关系,本研究结果显示,c-myc的表达在有淋巴结转移的大肠癌中明显增高,并且与Dukes'分期和浸润深度均有相关性,提示c-myc基因的异常表达与大肠癌的浸润和转移关系密切,可作为判断病人预后的一个独立指标。对于Aurora-A,既往研究显示[10]其表达异常不仅与肿瘤的发生密切相关,而且与肿瘤的侵袭和转移也存在很大程度相关性。我们的实验发现Aurora-A在肿瘤细胞的表达仅与肿瘤的浸润深度有关,其浸润程度越深,Aurora-A的阳性表达率越高,提示Aurora-A蛋白表达的升高在大肠癌的侵袭潜能中起重要作用。另外本研究结果显示mt-P53蛋白在肿瘤细胞的表达率与淋巴结转移和Dukes'分期也均有相关性,其中有淋巴结转移组明显高于无淋巴结转移组,而且mt-P53蛋白的阳性表达率随着肿瘤浸润程度的加深而增高,相比差异有统计学意义,说明mt-P53在大肠癌的侵袭和转移过程中也起着重要作用,其蛋白的过表达提示大肠癌的预后较差。淋巴结转移是目前公认的大肠癌预后不良的重要指标,因此,共同检测Aurora-A、mt-P53和c-myc蛋白的表达水平可有助于大肠癌的早期诊断和预后判断。
对于Aurora-A和mt-P53在大肠癌演变过程中的相互关系,有文献报道[2-3]wt-P53蛋白对Aurora-A起负调控作用,在细胞内以转录活化非依赖的方式(transactivation-independent)直接结合在Aurora-A的N端并抑制其活性,阻止Aurora-A过表达所诱导的中心体扩增和细胞转化。另一方面,Aurora-A高度活化又可抑制wt-P53所介导的负性调节,原因是Aurora-A对wt-P53的Ser315磷酸化,从而促进MDM2介导的wt-P53通过泛素化途径降解,也可对wt-P53的Ser215磷酸化,抑制wt-P53的转录活性,最终使wt-P53失去正常功能。这些发现提示Aurora-A引发肿瘤的原因之二是它能与一些底物蛋白相互作用,影响细胞凋亡和分裂之间的平衡,过表达或过度激活Aurora-A会打破细胞内的Aurora-A-P53平衡,造成细胞恶性增殖。我们采用同一组病例作了两种蛋白表达的检测,结果显示,Aurora-A与mt-P53在大肠癌中的表达显著正相关(P<0.01),并且随着肿瘤细胞浸润程度的加深,二者的表达都有所增强,这些都提示Aurora-A和mt-P53在大肠癌的发生发展过程中存在一定联系,它们协同作用使肿瘤具有侵袭的特征,因此可以作为判断预后的重要指标。
Aurora-A在肿瘤转化中具有枢纽作用,最近研究发现[4]高表达的Aurora-A可以上调c-myc,并通过人端粒酶逆转录酶(hTERT)启动子上c-myc结合位点诱导端粒酶活性,RNAi干扰c-myc后,可以减弱Aurora-A所诱导的hTERT表达和端粒酶活性。此发现提供了细胞恶性转化的又一分子机制,即Aurora-A通过上调c-myc而诱导端粒酶活性。我们的研究结果显示,在90例Aurora-A阳性表达的标本中,c-myc有81例高表达,40例Aurora-A阴性表达的标本中,c-myc有22例阴性表达,经相关分析表明Aurora-A与c-myc的表达呈显著正相关(P<0.01),并且二者都与肿瘤的浸润程度关系密切,提示Aurora-A和c-myc对大肠癌的发生和发展过程具有共同调节作用,使大肠癌细胞具有侵袭性并向远处转移。
c-myc作为原癌基因,可给予细胞双重选择,即增殖或凋亡,其作用的选择是由其所受信号决定的。许多学者认为[11]P53与c-myc之间存在协同作用,即wt-P53蛋白可抑制c-myc蛋白的过表达和细胞转化功能,从而激活c-myc促进细胞凋亡的作用;而mt-P53蛋白则可激活c-myc促进细胞分裂增殖的作用,当mt-P53蛋白积聚时,正常wt-P53蛋白抑制c-myc表达及细胞转化的作用减弱甚至消失,c-myc异常增多,使得诱导细胞凋亡的作用减弱,而诱导细胞增殖和转化的作用加强,促使细胞异常增殖,加快分化并向恶性方向发展。本研究中mt-P53和c-myc蛋白的表达在130例大肠腺癌中也显著正相关(P<0.01),而且二者都与浸润程度、Dukes'分期和淋巴结转移关系密切(P<0.05),提示mt-P53和c-myc蛋白的过表达在大肠肿瘤的发生、侵袭和转移中起着相互促进的作用,检测这两种蛋白在大肠癌中的表达有助于临床判断患者的预后。
本文研究发现从正常大肠组织、癌旁组织到大肠癌,这个进程与Aurora-A、mt-P53和c-myc表达的递增密切相关,三者在肿瘤的发生、浸润和转移中起着相互促进的作用,联合检测这三种蛋白在大肠癌中的表达水平有助于临床早期诊断和及时判断患者预后。另外,由于Aurora-A与肿瘤的发生有关,并且在肿瘤转化中具有枢纽作用,因此,Aurora-A有可能成为肿瘤治疗的一个新靶点。目前,相继报道有小分子Aurora-A抑制剂[12-15],实验发现它们具有抗肿瘤活性,这有可能成为未来抗肿瘤新药的研发方向。
1 Saeki T,Ouchi M,Ouchi T.Physiological and oncogenic Aurora-A pathway[J].Int J Biol Sci,2009,5(7):758-762.
2 Christiane DF,Corinna H,Claudia M,et al.Occurrence of multipolar mitoses and association with Aurora-A/-B kinases and P53 mutations in aneuploid esophageal carcinoma cells[J].BMC Cell Biology,2011,12:13-28.
3 Hsueh KW,Fu SL,Chang CB,et al.A novel Aurora-A-mediated phosphorylation of P53 inhibits its interaction with MDM2[J].Bio Bio Acta,2013,1834(2):508-515.
4 Yanq S,He S,Zhou X,et al.Suppression of Aurora-A oncogenic potential by c-Myc downregulation[J].Exp Mol Med,2010,42(11):759-767.
5 Jemal A,Siegel R,Xu J,et al.Cancer statistics 2010[J].CA Cancer J Clin,2010,60(5):277-300.
6 Zhang SW,Lei ZL,Li GL,et al.A Report of Cancer Incidence and Mortality from 34 Cancer Registries in China,2006[J].China Cancer,2010,19(6):356-365.[张思维,雷正龙,李光琳,等.中国肿瘤登记地区2006年肿瘤发病和死亡资料分析[J].中国肿瘤,2010,19(6):356-365.]
7 Song TQ.Advances in Treatment of Liver Metastasis of Colorectal Cancer[J].Chin J Clin Oncol,2013,40(4):183-186.[宋天强.结直肠癌肝转移的治疗进展[J].中国肿瘤临床,2013,40(4):83-186.]
8 Wang CZ,Zhou XG,Wang P,et al.Technology of tissue chip[J].J of Clin and Expe Medi,2004,3(3):183-184.[王翠芝,周小鸽,王鹏,等.组织芯片制作技术[J].临床和实验医学杂志,2004,3(3):183-184.]
9 Xu LZ,Chief editor.The utility of tumor pathology[M].Shanghai:Shanghai people's Publishing House,1997:123-124.[许良中,主编.实用肿瘤病理方法学[M].上海:上海人民出版社,1997:123-124.]
10 Wang XX,Lu N,Liu ZR,et al.Effect of Aurora-A Overexpression on Invasion and MMP-9 Expression of Esophageal Carcinoma Cells[J].China Biotechnology,2012,32(7):26-30.[王 晓 霞,路娜,刘志荣,等.Aurora-A高表达对食管癌细胞侵袭和MMP-9表达的影响[J].中国生物工程杂志,2012,32(7):26-30.]
11 Sachdeva M,Zhu S,Wu F,et al.P53 represses c-Myc through induction of the tumor suppressor miR-145[J].Proc Natl Acad Sci U S A,2009,106(9):3207-3212.
12 Dar AA,Goff LW,Majid S,et al.Aurora kinase inhibitors--rising stars in cancer therapeutics[J]?Mol Cancer Ther,2010,9(2):268-278.13 Chowdhury A,Chowdhury S,Tsai MY,et al.A novel Aurora kinase-A inhibitor MK-8745 predicts TPX2 as a therapeutic biomarker in non-Hodgkin lymphoma cell lines[J].Leuk Lymphoma,2012,53(3):462-471.
14 Wu JM,Chen CT,Mohane SC,et al.Aurora kinase inhibitors reveal mechanisms of HURP in nucleation of centrosomal and kinetochore microtubules[J].Proc Natl Acad Sci USA,2013,110(19):1779-1787.15 Nair JS,Ho AL,Schwartz GK.The induction of polyploidy or apoptosis by the Aurora A kinase inhibitor MK8745 is P53-dependent[J].Cell Cycle,2012,11(4):807-817.
(2013-08-06收稿)
(2013-11-29修回)
Expression of centrosome-associated kinaseAurora-A,mt-P53,and c-myc in colorectal cancer and its significance
Xiaolu SU1,Xiaoming LI1,Weihua TIAN2,Xu ZHANG3
Xiaolu SU;E-mail:Suxl2004@126.com
1Department of Pathology,Lanzhou University Second Hospital,Lanzhou 730030,China.
2Department of Pathology,Luohu District People's Hospital of Shenzhen City,Shenzhen 518000,China.
3Department of Pathology,School of Basic Medical Sciences,Lanzhou University,Lanzhou 730000,China.
Objective:This study aimed to investigate the expression levels of centrosome-associated kinase Aurora-A,mutant type P53(mt-P53),and c-myc in colorectal cancer.This study was also conducted to investigate the mutual relationship and functions of these factors in tumorigenesis and tumor progression.Methods:We examined the pathological specimens obtained from colorectal cancer,pericancerous tissues,and normal colorectal tissues by tissue microarray technique and immunohistochemistry(SP method)to determine the expression levels of Aurora-A,mt-P53,and c-myc proteins.The clinicopathological parameters were then analyzed.Results:The positive rates of Aurora-A expression in normal colorectal tissues,pericancerous tissues,and colorectal cancer were 0%,35%,and 69%respectively;by comparison,the positive rates of mt-P53 were 0%,20%,and 57%,respectively.For c-myc,the positive rates were 0,37%,and 76%,respectively.The expression levels of Aurora-A,mt-P53,and c-myc were significantly higher in tumor tissues than in normal colorectal tissues and pericancerous tissues(P<0.01).Aurora-A overexpression was related to the depth of invasion(P<0.05).Mt-P53 and c-myc overexpression was related to the depth of invasion,lymph node metastasis,and Dukes'classification(P<0.05).A strong positive correlation was observed between the expressions of Aurora-A,mt-P53,and c-myc in colorectal cancer(r=0.362,P<0.01;r=0.487,P<0.01).A strong positive correlation was also observed between the expressions of mt-P53 and c-myc in colorectal cancer(r=0.242,P<0.01).Conclusion:The overexpression of Aurora-A and c-myc and the mutation of P53 were important in tumorigenesis,tumor invasion,and metastasis of colorectal cancer.Thus,the co-detection of Aurora-A,mt-P53,and c-myc may be useful for the early diagnosis and prognosis of colorectal cancer.
Aurora-A,P53,c-myc,tissue microarray,colorectal cancer
10.3969/j.issn.1000-8179.20131265
①兰州大学第二医院病理科(兰州市730030);②深圳市罗湖区人民医院病理科;③兰州大学基础医学院病理学研究所
苏晓路 Suxl2004@126.com
(本文编辑:杨红欣)

苏晓路 主治医师,硕士研究生,主要研究方向为临床病理诊断。
E-mail:suxl2004@126.com

