改良POSSUM评分在预测老年非小细胞肺癌手术风险中的应用价值
王蓉 高德伟 龚卫琴 梁致如
据中国肿瘤登记中心2012年报显示:肺癌已位居全国恶性肿瘤发病的第一位[1].随着社会老龄化,肺癌在老年人中也有较高的发病率,非小细胞肺癌(non-small cell lung cancer, NSCLC)的中位发病年龄为70岁[2].老年人早期的NSCLC首选治疗方法为手术治疗[3].而老年肺癌患者是否选择手术治疗,不仅要考虑到患者的实际年龄,更需要考虑患者的全身状况、内科合并症及生命预期、手术获益与风险等情况[4].目前评价老年患者能否耐受肺癌手术的方法尚无明确标准.POSSUM(Physiological and Operative Severity Score for the Umeration of Mortality and Morbidity)评分系统是Copeland[5]于1991年提出的,最早用于预测胃肠道手术后并发症发生率和病死率.它包含12项生理学指标,分别是:年龄、心脏征象、呼吸系统、收缩压、脉率、Glasgow昏迷评分、血红蛋白、白细胞、尿素、钠、钾、心电图.及6项手术严重度指标,分别是:手术范围、30天内手术次数、失血量、腹腔感染、恶性肿瘤和手术类别.以上指标按其程度分为1分、2分、4分、8分.1分为最轻,8分为最重.而将POSSUM评分用于老年肺癌手术患者的评估,目前报道甚少.本研究拟通过标准POSSUM评分及改良的POSSUM评分对老年肺癌手术患者术后风险进行预测,并与实际手术并发症发生率和病死率进行比较,来衡量改良POSSUM评分在老年肺癌手术并发症和手术死亡中的预测价值.
1 资料与方法
1.1 一般资料 收集从2007年12月-2013年12月解放军总医院连续住院行肺癌手术的老年患者138例.其中男性88例,女性50例.年龄65岁-86岁,平均(71.2±11.4)岁.术后病理诊断:细支气管肺泡癌62例,腺癌36例,鳞癌29例,腺鳞癌3例,大细胞癌3例,类癌2例,未分化癌2例,复合性癌1例.TNM分期:Ia期56例,Ib期41例,IIa期19例,IIb期11例,IIIa期6例,IIIb期5例.
1.2 手术方式 肺叶切除术66例,其中胸腔镜辅助下肺叶切除术50例;肺楔形切除术38例,其中胸腔镜辅助下肺楔形切除术26例;肺段切除术34例,其中胸腔镜辅助下肺段切除术23例.
1.3 纳入与排除标准 纳入标准:年龄≥65岁;病理证实为NSCLC;术前未行放化疗治疗.排除标准:年龄<65岁;病理证实为小细胞肺癌;术前已行放化疗治疗;合并全身转移的IV期患者;肺转移癌.
1.4 研究方法
1.4.1 资料的收集 根据标准POSSUM评分系统收集每位患者术前24 h的12项生理学指标及6项手术严重度指标.并收集文献报道中可能影响并发症发生和手术死亡的因素:肺功能指标包括:第1秒用力呼气率(forced expiratory in the fi rst second, FEV1%)和肺一氧化碳弥散率(diffusing capacity of the lung for carbon monoxide, DLCO%)、手术时间、手术方式、病理分型、肿瘤分期.并按照标准POSSUM和改良POSSUM分别进行评分.根据COPELAND方程[5]计算术后(30 d内)并发症发生概率(R1)和手术死亡概率(R2)的预测值.并统计术后实际并发症发生例数和手术死亡例数.COPELAND方程如下:
ln[R1/(1-R1)]= -5.91+(0.16X生理学评分)+(0.19X手术侵袭度评分)
ln[R2/(1-R2)]= -7.04+(0.13X生理学评分)+(0.16X手术侵袭度评分)
1.4.2 病例分组 以实际有无手术并发症分为并发症组和无并发症组,因死亡例数少,死亡病例未单独分组.依照标准POSSUM及改良POSSUM评分计算出R1和R2的预测值,分为预测并发症组和实际并发症组;预测病死率组和实际病死率组.
1.5 统计学方法 采用SPSS 17.0和MedCalc 13.0.0统计软件进行统计分析.计量资料采用Mean±SD表示,预测并发症发生率和病死率用百分比表示.各影响因素对术后实际并发症发生率和病死率的影响,采用二值多元Logistic回归分析.采用成组t检验对有、无并发症组的标准POSSUM评分值进行比较.同法,比较改良POSSUM评分值.绘制标准POSSUM和改良POSSUM的受试者工作特征曲线(receiver operating characteristic curve, ROC),计算曲线下面积(area under the curve, AUC),两组间AUC比较采用t检验.计算改良POSSUM评分预测和实际并发症发生率和病死率的符合度.P<0.05为差异有统计学意义.
2 结果
2.1 术后并发症与死亡情况 共有59例患者发生术后并发症77例次,发生率为42.8%.其中发热(排除术后吸收热)17例,术后出血2例,气胸8例,肺不张5例,肺部感染5例,脓胸1例,呼吸衰竭3例,哮喘1例,皮下气肿6例,大面积肺栓塞1例,急性心衰2例,高血压4例,心律失常6例,急性冠脉综合征5例,不全性肠梗阻2例,高胰酶血症2例,急性胆囊炎1例,痛风1例,电解质紊乱2例,谵妄2例,急性肾功能衰竭1例.术后死亡2例,其中因急性大面积肺动脉栓塞死亡1例;因术后出血及肺部感染导致呼吸衰竭死亡1例.
2.2 Logistic回归分析 以术后实际并发症发生率及病死率为因变量,标准POSSUM的12项生理学指标和6项手术严重度指标及FEV1%、DLCO%、手术时间、手术方式、病理分型、肿瘤分期为自变量进行Logistic回归分析.标准POSSUM的18项指标除glasgow昏迷评分外,余下17项指标和FEV1%、DLCO%及肿瘤分期对术后并发症发生有统计学意义(P<0.05).而手术时间、手术方式、病理分型对术后并发症发生率无统计学意义(P>0.05).仅年龄对术后病死率有统计学意义(P<0.05).
结合以上统计分析结果,在原POSSUM评分基础上,将FEV1%和DLCO%赋值带入生理学指标,胸腔感染赋值带入手术侵袭度指标,建立改良POSSUM评分系统(表1).手术时间、手术方式因无统计学意义未赋值带入.肿瘤分期按标准POSSUM赋值带入.
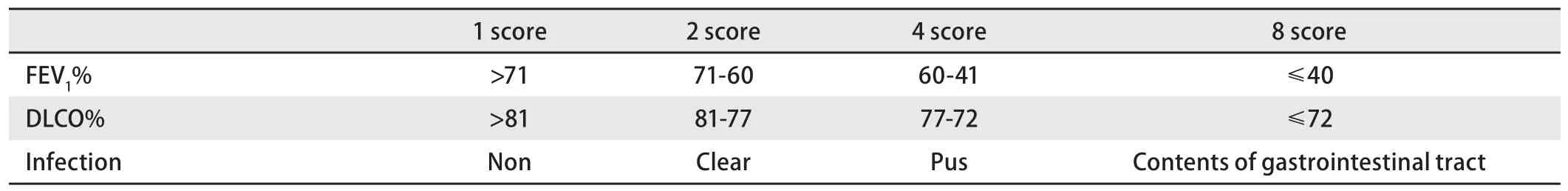
表 1 肺功能及胸腔感染赋值Tab 1 The assignment of lung fuction and chest infection
2.3 标准POSSUM和改良POSSUM生理学评分和手术严重度评分对术后实际并发症发生的影响 在标准POSSUM评分中,实际并发症组与无并发症组的生理学评分、手术严重度评分比较,差异有统计学意义(P<0.01).在改良POSSUM评分中,并发症组与无并发症组的生理学评分、手术严重度评分比较,差异有统计学意义(P<0.01)(表2).

表 2 有无并发症组的标准POSSUM和改良POSSUM评分比较Tab 2 The comparison of standard POSSUM scoring and modified POSSUM scoring between with and without complication groups
2.4 POSSUM和改良POSSUM预测并发症发生率AUC的比较 标准POSSUM和改良POSSUM预测的术后并发症发生率与实际并发症发生分别进行比较并绘制ROC曲线,计算AUC,两组间AUC比较差异有统计学意义(P<0.01)(表3).改良POSSUM的AUC更接近1,较标准POSSUM相比,其对术后并发症发生的预测价值更好.因实际死亡例数较少,无法进行预测病死率与实际死亡人数的ROC曲线绘制.
2.5 POSSUM评分预测并发症发生率和病死率与实际值的比较 POSSUM评分预测并发症发生率与实际并发症发生的O/E值波动在0.83-1.33.但改良POSSUM评分预测病死率与手术死亡的O/E值仅为0-0.50,存在过度预测(表4,表5).
3 讨论
标准POSSUM评分系统最早提出于1991年[5].最新的meta分析显示对于肝胆胰手术来说,标准POSSUM评分过高预测了手术并发症和手术死亡[6].而针对血管外科的V-POSSUM评分[7];针对胃食道手术的O-POSSUM评分[8];针对结直肠手术的Cr-POSSUM评分[9]却能更好地预测术后并发症发生及手术死亡.究其原因,手术技术的不断改进,特别是微创技术的广泛应用,使得术后并发症和手术死亡不断下降,故而较早提出的标准POSSUM预测值偏高.曾有报道由于微创技术的应用,平均年龄72岁的老年患者胸腔镜辅助下肺切除术的手术并发症发生率15%,手术死亡率由25年前的7%下降至0.8%[10].其次,在标准POSSUM评分中一些与专科手术相关的参数并未纳入,以肝胆胰手术为例血清胆红素水平并未纳入在标准POSSUM评分中,也使得其预测率不准确[11].在本研究中,我们根据Logistic回归分析结果,将肺通气指标FEV1%和肺弥散功能指标DLCO%及胸腔感染指标纳入改良POSSUM评分中,与标准POSSUM评分相比,其在术后并发症的预测上有更好的价值,两者AUC比较差异有统计学意义(P<0.05).但也应看到即使是改良POSSUM对手术死亡仍存在过度预测.

表 3 标准POSSUM与改良POSSUM曲线下面积的比较Tab 3 The comparison of AUC between standard POSSUM and modified POSSUM
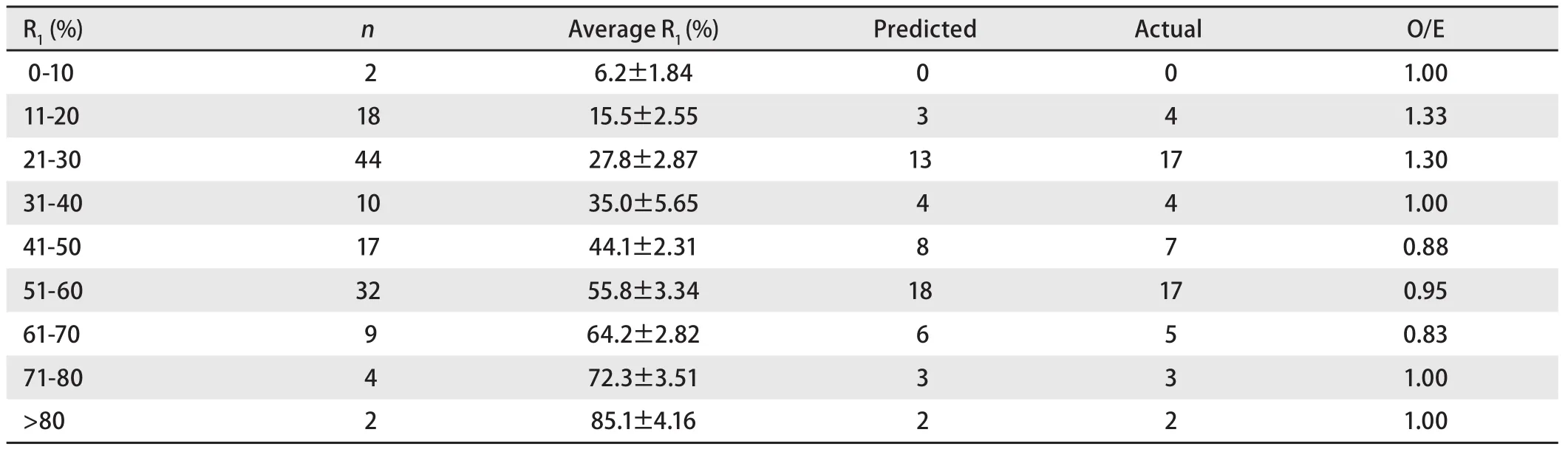
表 4 改良POSSUM预测与实际术后并发症发生的例数对比Tab 4 The comparison between predicted and actual complition cases
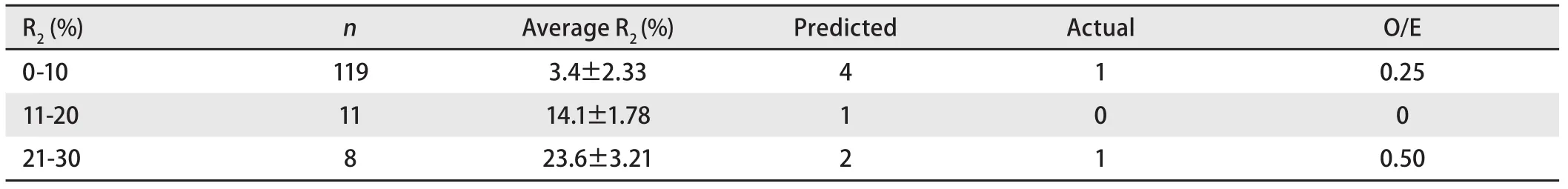
表 5 改良POSSUM预测与实际手术死亡的例数对比Tab 5 The comparison between predicted and actual death cases
尽管手术治疗是老年早期NSCLC的首选治疗方法[12],但是年龄仍是老年肺癌手术死亡的独立危险因素,一项3,000例老年肺癌死亡率的调查显示[13]与年青人相比,30 d、60 d、90 d手术死亡率分别为3.6% vs 2.2%;4.1% vs 2.4%;4.7% vs 2.5%.但是结果不尽相同,Rivera[11]报道年龄与住院时间及术后并发症发生率无关.在本研究中,通过Logistic回归分析,年龄与术后并发症发生和手术死亡均相关.并且肿瘤TNM分期也与术后并发症发生率相关,这可能因为不同的TNM分期患者手术时间、手术方式、手术范围包括肺门纵隔淋巴结清扫的程度不同,直接影响到术后并发症的发生.值得提出的是目前NSCLC IV期的老年患者并不建议手术治疗,故本研究中并未纳入合并全身转移的老年NSCLC患者.
在我们的研究中,手术并发症和手术死亡与手术时间、手术方式及肿瘤的病理分型无关,这与国内的报道并不一致,杨等[14]报道手术时间是肺癌术后并发症发生和手术死亡的危险因素.分析原因本研究中多数患者采用的是胸腔镜辅助下的肺切除术,手术时间大多在2 h-3 h,大大降低了因手术时间过长,单侧肺通气时间长而造成的患侧肺萎陷、健侧肺过度通气带来的通气/血流比例失调.而马等[15]报道手术方式与肺癌术后并发症发生相关,也与本研究不一致.本研究中不同的手术方式,对术后并发症及手术死亡并无影响.由于国外文献[16,17]报道全肺切除术可以使老年患者围术期并发症发生率及病死率增高,应尽量避免.故本研究在手术方式的选择上无全肺切除术.虽有回顾性报道[18-20]肺局限性切除术与肺叶切除术相比,术后生存期相当,但会有更好的肺功能.但本研究的观察时间仅局限在术后30 d内,由于观察时间较短不同手术方式所致的肺功能差异可能并未显现.
总之,改良POSSUM评分对老年NSCLC术后并发症发生有较好的预测价值,可为决策手术治疗提供依据.

