制备方法对Al/Fe2O3纳米铝热剂储存性能的影响①
高 坤,李国平,于宪峰,郑 剑,王 鲁,罗运军
(1.北京理工大学 材料学院,北京 100081;2. 63961部队,北京 100012;3. 中国航天科技集团公司,北京 100048)
制备方法对Al/Fe2O3纳米铝热剂储存性能的影响①
高 坤1,李国平1,于宪峰2,郑 剑3,王 鲁1,罗运军1
(1.北京理工大学 材料学院,北京 100081;2. 63961部队,北京 100012;3. 中国航天科技集团公司,北京 100048)
利用SEM、XRD和DSC研究了制备方法对Al/Fe2O3纳米铝热剂储存性能的影响。结果表明,超声共混法制备的纳米铝热剂放置60 d后,活性铝的平均粒径减小4 nm,使得铝热反应放热量降低13%,之后趋于稳定;机械球磨法制备的纳米铝热剂放置7 d后,活性铝平均粒径减小3 nm,120 d之后,缓慢减小至57.8 nm,活性铝的减少使得铝热反应放热量损失高达16%,;溶胶-凝胶法所制备的纳米铝热剂储存120 d后,活性铝平均粒径减小仅1 nm,明显地减缓了纳米铝粉的氧化,放热量损失仅为6%,并保持稳定。
纳米铝热剂;铝热反应;储存性能
0 引言
纳米铝热剂是纳米铝粉和纳米金属氧化物在纳米级别进行复合[1],在冶金、电池、陶瓷和军事领域有着广泛的应用,其具有能量密度高、感度低、配方灵活等优点[2-4]。纳米铝粉本身具有极大的比表面积、较高的表面能,容易团聚且与氧结合能力强,长期放置会大幅降低Al粉的有效含量,限制了纳米铝的应用。关于单组分纳米铝粉的氧化,国内外学者进行了广泛研究,Campbell等[5]通过分子动力学模拟计算得出纳米铝表面的氧化层厚度增加至4 nm之后,保持稳定不再增加。Phung等[6]利用TEM观察到纳米铝的表面是由一个3~5 nm的非晶表面层覆盖。宋武林等[7]研究了激光-感应复合加热法制备的纳米铝在不同湿度环境下的纳米铝的活性,发现在不同湿度条件下放置后,壳层厚度会逐渐增加到5 nm,之后不再增加,而在复合材料中纳米铝氧化的报道较少。
本研究采用超声共混法、机械球磨法和溶胶-凝胶法,制备了3种Al/Fe2O3纳米铝热剂,并利用X射线衍射仪(XRD)和差示扫描量热分析仪(DSC),研究了储存不同时间的3种铝热剂的物理和热反应性能;同时,对纳米铝热剂中纳米铝的氧化机理进行了分析,对纳米铝热剂的实际应用具有重要的指导意义。
1 实验
1.1 试剂及仪器
30 nm球形α-Fe2O3(98%),阿拉丁化学有限公司; 70 nmAl粉,球形,北京特博万德科技有限公司;六水三合氯化铁(FeCl3·6H2O),分析纯,天津市福晨化学试剂厂;正己烷,分析纯,北京化工厂;乙醇,分析纯,北京化工厂;1-2环氧丙烷(PO),国药集团化学试剂有限公司。
福里茨单罐行星式高能球磨机;宁波新芝SB-5200 DTDN 超声波清洗机;磁力搅拌器;X射线衍射仪,X’Pert PRO MPD型,测试范围θ= 10°~90°。METTLER TOLEDO TGA/DSC 同步热分析仪,升温速度为10 ℃/min,氮气流量40 ml/min,氧化铝陶瓷试样池,样品质量在2~3 mg。
1.2 纳米铝热剂的制备
为了满足反应式(1)的零氧平衡,同时考虑到Al表面的氧化层,本文中采取Al/Fe摩尔比为2∶1。
2Al+Fe2O3= 2Fe+Al2O3
(1)
1.2.1 超声共混法
将摩尔比为2∶1的Al粉和α-Fe2O3加入至装有正己烷烧杯中,利用超声仪进行超声混合,超声混合时间为30 min,120 ℃低压真空干燥,得到产品。
1.2.2 机械球磨法
将Al粉和α-Fe2O3按Al/Fe摩尔比2∶1混合后,在球磨机内进行球磨。采用6、10、20 mm的玛瑙球作为球磨介质,3种球配比为1∶10∶100,球料质量比为20∶1,加入正己烷作为冷却剂,然后球磨混合4 h,球磨机转速300 r/min之后,120 ℃低压真空干燥,得到产品。
1.2.3 溶胶-凝胶法
将一定量的FeCl3·6H2O溶于乙醇溶液,完全溶解后,加入部分环氧丙烷(PO),待溶液温度降至室温,加入Al/Fe摩尔比为2∶1的纳米铝粉,之后加入剩余PO(PO/Fe摩尔比为9∶1),磁力搅拌至凝胶,放至室温下老化6 d。然后,用新鲜乙醇对凝胶进行置换,在120 ℃下进行低压真空干燥,得到产品。
2 结果与讨论
2.1 纳米铝热剂的SEM分析
图1(a)为原料Al粉的SEM图,纳米Al颗粒为球形,表面光滑,平均粒径为70 nm(活性铝+铝表面的氧化层),但粒径分布较宽,样品中也存在粒径在400 nm左右的球形颗粒;图1(b)为纳米α-Fe2O3的SEM图,α-Fe2O3颗粒也为球形,表面光滑,平均粒径为30 nm,且分布均匀。
图1(c)~(e)分别为超声共混法、机械球磨法和溶胶-凝胶法制备的纳米铝热剂的SEM图片。由图1可知,超声共混法所得纳米铝热剂是由纳米Al和α-Fe2O3简单地复合在一起,颗粒表面光滑,有一定的团聚。机械球磨法制备的纳米铝热剂纳米Al和α-Fe2O3复合较为均匀,表面光滑,图1(d)中可看到较大颗粒的Al颗粒已经破裂。溶胶-凝胶法制备的纳米铝热剂,Fe2O3凝胶均匀地包覆在Al粉的表面,使得Al颗粒的表面粗糙,与超声共混法和机械球磨法相比,Fe2O3凝胶与Al颗粒有更大的接触面积。

(a)纳米Al粉 (b)纳米α-Fe2O3

(c)超声法样品 (d)球磨法样品

(e)溶胶-凝胶法样品图1 原料和纳米铝热剂的SEM图片
2.2 纳米铝热剂的XRD分析
图2(a)为原料Al、α-Fe2O3和不同方法制备的3种纳米铝热剂的X射线衍射图。其中,原料铝的特征衍射峰分别出现在2θ为38.42°、44.90°、64.98°、78.12°和82.4°处,分别对应铝面心结构的(111)、(200)、(220)、(311)和(222)晶面;同时,原料铝20°~40°之间有一个非晶包[8],为纳米Al表面的无定形氧化层。原料α-Fe2O3在2θ角为24.16°、33.19°、35.63°、40.90°、49.59°、54.11°、57.58°、62.51°和64.04°出现特征衍射峰,分别对应α-Fe2O3六方结构的(012)、(104)、(110)、(113)、(024)、(116)、(018)、(214)和(300)晶面。溶胶-凝胶法制备的纳米铝热剂同样在 10°~40° 有一个大的非晶包,主要是由于氧化铁凝胶所致[7],同时也包含了无定形氧化铝。
以球磨法为例,纳米铝热剂在不同储存时间测得的X射线衍射结果见图2(b)。Al在38.42°的衍射峰半峰宽由0.162 4°增加至0.194 8°;同时,若设Al在38.42°的特征衍射峰强度与α-Fe2O3在33.11°的特征衍射峰强度的比值为M,储存1 d和120 d的M值由2.18(1 d)减至2.0(120 d),说明活性铝的粒度减小。
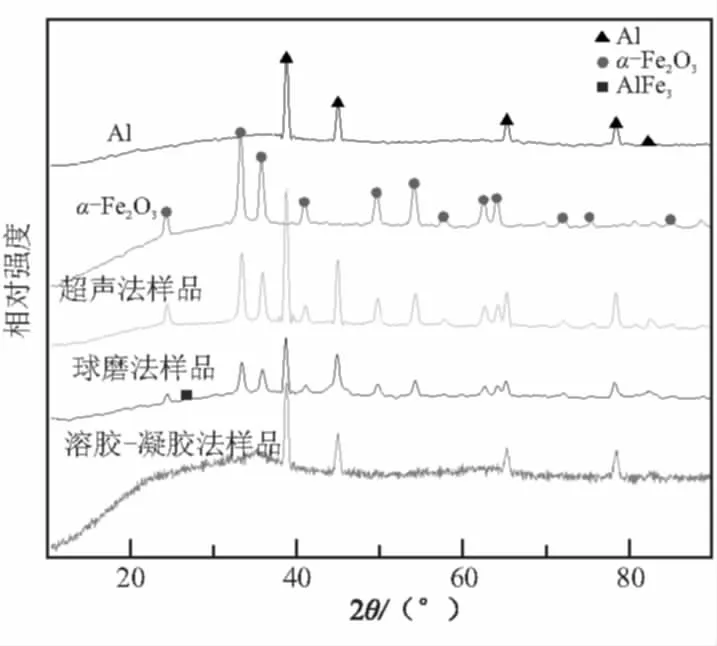
(a)原料及新制备的纳米铝热剂
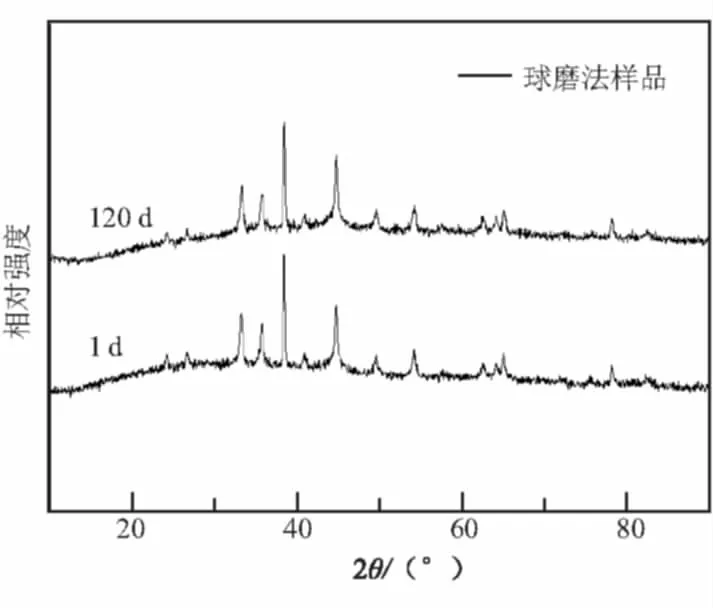
(b)储存120 d之后的球磨样品图2 纳米铝热剂的XRD图谱
利用Scherrer式对3种纳米铝热剂的X射线衍射结果进行计算,得到纳米铝热剂中活性铝的平均粒径随储存时间的变化,见图3。超声法制备的纳米铝热剂中活性铝的平均粒径由66 nm减至62 nm左右;球磨法样品中活性铝的平均粒径从62 nm减为57.5 nm,小于超声法和溶胶-凝胶法。这是因为在球磨过程中,较大粒径的颗粒受到机械力破坏,平均粒径减小所致。溶胶-凝胶法样品中活性铝的平均粒径由66 nm减至65 nm,并保持稳定,大于另外2种样品。超声法和溶胶-凝胶法所制备的纳米铝热剂在储存60 d后,活性铝的粒径趋于稳定;球磨法所制备的纳米铝热剂储存7 d时,活性铝的平均粒径减小较快,之后减小速率变缓。
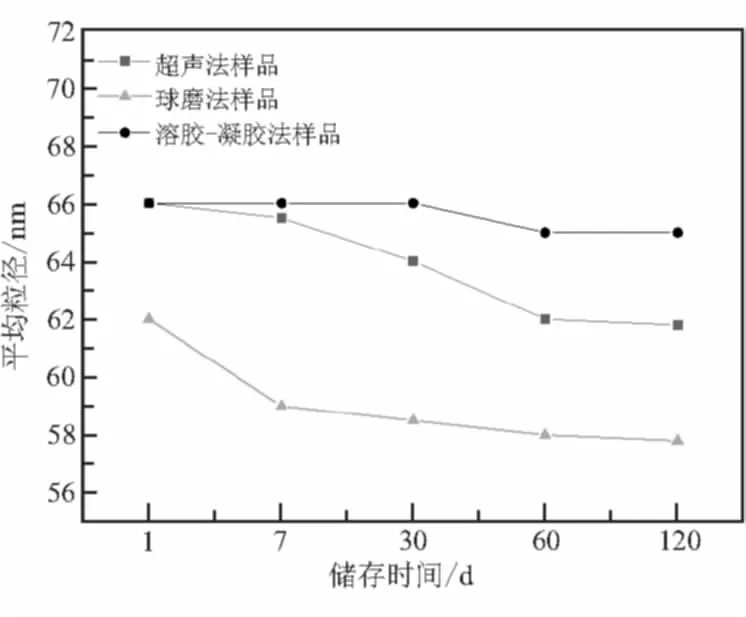
图3 3种纳米铝热剂的粒径变化图
2.3 纳米铝热剂的热反应性能分析
热焓是反映纳米铝热剂热反应性能的一个重要参数,通过测量反应放热量,可作为纳米铝热剂在储存过程中热反应性能变化的一个参考。图4给出了3种Al/Fe2O3纳米铝热剂在刚制备出时的热反应曲线。

图4 3种方法制备纳米铝热剂的DSC曲线
铝热反应发生在500~860 ℃,660 ℃为铝的熔点。因此,存在2个反应放热峰。其中,500~660 ℃为铝热固-固反应放热峰;660~860 ℃为铝热固-液反应放热峰。不同储存时间条件下,Al/Fe2O3纳米铝热剂反应历程相同,其曲线形状类似,而热焓值存在显著差异,可将铝热反应放热量作为对比值[7],结果见图5。
从图5中可看出,超声法样品在刚制备出时,铝热反应放热量小于其他2种方法。这是因为该方法制备的纳米铝热剂颗粒有一定的团聚,在一定程度上限制了铝热反应[7]。但储存7 d后,铝热反应放热量高于球磨法样品,60 d后,减小13%后趋于稳定。球磨法样品在刚制备出时,铝热反应放热量较高,7 d放热量减小16%后,放热量小于超声法和溶胶-凝胶法样品,之后减小速率变缓。溶胶-凝胶法样品中,活性铝和氧化铁凝胶由于具有高的接触面积,铝热反应放热量最高,放热量减小缓慢,60 d后仅减小6%,并保持稳定。3种方法制备的纳米铝热剂中,溶胶-凝胶法所制备的纳米铝热剂铝热反应放热量最高,储存稳定性优于另外2种方法所制备的纳米铝热剂。同时,3种纳米铝热剂放热量的变化趋势与活性铝的粒径变化趋势相一致。

图5 3种纳米铝热剂的铝热反应放热量 随储存时间的变化曲线图
2.4 机理分析
对于纳米铝热剂,要保持高的反应活性,关键在于保持纳米铝的活性。对于相同粒径的纳米铝粉,其氧化层厚度越薄,纳米铝粉的活性越高,铝热反应放热过程越剧烈[9-10]。3种纳米铝热剂中,纳米铝粉的氧化层厚度随着储存时间的增加而增加,但不同方法制备的纳米铝热剂中,纳米铝粉的氧化层厚度存在差异,纳米铝粉的氧化程度也不相同,使得纳米铝热剂的热性能存在差异。
根据Cabrera和Mott关于金属表面氧化层的形成理论[6,11],纳米铝的氧化可用式(2)描述:
(2)
式中x为氧化层的厚度;t为时间;n0为体系平衡时在金属-氧化层界面的金属离子的浓度(与Mott电势Δφ有关);Ω为每个金属离子周围氧的体积(与环境中O2的浓度有关);Di为离子扩散系数。
由式(2)可知,纳米Al的氧化层厚度x随储存时间t的变化与Mott电势Δφ、储存环境中的O2浓度和离子扩散系数Di成正比,与氧化层的厚度x成反比。因此,可以通过氧化层厚度的变化来控制纳米Al的氧化。
纳米铝热剂中纳米铝的氧化可用图6来描述。

(a)纳米铝粉氧化机理
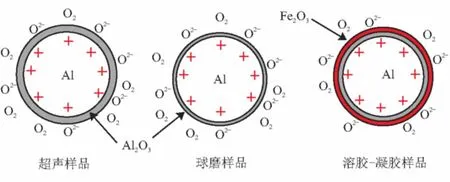
(b)纳米铝热剂中Al的氧化层图6 纳米铝粉氧化层增长示意图
超声法样品中纳米铝的氧化与单组分的纳米铝[9]相似,氧化层增加至4~5 nm左右之后不再增加,铝粉的活性也不再降低。球磨法样品中较大颗粒的纳米铝粉在球磨过程中受到机械破坏力的作用发生破裂[7],使得氧化层厚度变薄或破裂,纳米铝与氧气接触,氧化初期速率较快,7 d之后,随着新的氧化层厚度的增加,氧化速率减缓,活性铝也随之减少。溶胶-凝胶法样品中的纳米铝的表面均匀的包覆了一层氧化铁凝胶。一方面,使得氧化层厚度增加,氧化速率减缓或者停止;另一方面,是氧化铁凝胶将纳米铝和氧气隔离开来,减慢活性铝的氧化速率,能够较好地保持纳米铝的活性。
3 结论
(1)制备方法对于纳米铝热剂的性能有着很大影响。通过XRD和DSC来衡量纳米铝热剂的活性和反应性有着一致的结论。因此,用DSC和XRD来研究纳米铝热剂的储存是可行的。
(2)纳米铝热剂的XRD分析表明,球磨法制备的纳米铝热剂储存120 d后,活性铝粒径由62 nm减小至57.5 nm,减小速率最快。而溶胶-凝胶法制备的纳米铝热剂的活性铝粒径由66 nm减至65 nm,活性铝粒径最大,并保持稳定。活性铝粒径的减小,使得铝热反应的放热量也随之变化。DSC结果表明,纳米铝热剂放热量的变化趋势与活性铝的粒径变化趋势相一致。
(3)在3种制备方法中,溶胶-凝胶法所制备的纳米铝热剂由于纳米铝被氧化铁凝胶包覆,有效地隔离了活性铝与氧气的接触,减缓了活性铝的氧化速率,能够更好地保存活性铝和保持纳米铝热剂的反应活性。
[1] 安亭,赵凤起,裴庆,等.超级铝热剂的制备、表征及其燃烧催化作用[J].无机化学学报,2011,27(2):231-238.
[2] Weismiller M R,Malchi J Y,Lee J G,et al.Effects of fuel and oxidizer particle dimensions on the propagation of aluminum containing thermites[J].P.Combust. Inst. ,2011,33,1989-1996.
[3] 周超,李国平,罗运军.球磨时间对Fe2O3/Al纳米复合材料性能的影响[J].固体火箭技术,2010,33(4):445-448.
[4] Keith B,Michelle L,Alexander E,et al.Combustion wave speeds of nanocomposite Al/Fe2O3:the effects of Fe2O3particle synthesis technique[J].Combustion and Flame,2005,140(4):299-309.
[5] Campbell T J,Aral G, OgataS,et al.Oxidation of aluminum nanoclusters[J].Phys.Rev.B,2005,71(20) .
[6] Phung X,Groza J,Stach E A,et al.Surface characterization of metal nanoparticles[J].Mat.Sci. Eng. a-Struct. ,2003,359(1-2):261-268.
[7] Li Y,Song W L,Zeng Xie C S,et al.Influence of humidity on the thermal behavior of aluminum nanopowders[J].Mater.Chem.Phys.,2006,97(1):127-131.
[8] 李颖.环境因素对纳米铝粉活性影响规律的研究[D].武汉:华中科技大学,2005:37-40.
[9] Puszynski J A.Processing and characterization of aluminum-based nanothermites[J].J.Therm.Anal.Calorim.,2009,96(3):677-685.
[10] Cervantes O G,Kuntz J D,Gash A E,et al.Activation energy of tantalum-tungsten oxide thermite reactions[J].Combust.Flame,2011,158(1):117-122.
[11] Atkinson A.Transport processes during the growth of oxide-films at elevated-temperature[J].Rev.Mod.Phys.,1985,57(2):437-470.
(编辑:薛永利)
Effect of synthesis technology on storage properties of Al/Fe2O3nano-thermites
GAO Kun1,LI Guo-ping1,YU Xian-feng2,ZHENG Jian3,WANG Lu1,LUO Yun-jun1
(1.School of Materials Science and Engineering,Beijing Institute of Technology,Beijing 100081,China; 2.Uniy 63691 of PLA,Beijing 100012 China;3.Aerospace Science and Technology Corporation,Beijing 100048,China)
The effects of preparation method on the storage properties of Al/Fe2O3nano-thermites were investigated by means of SEM, XRD and DSC. The results indicate that the average particle size of active-alumimun of nano-thermites prepared by ultrasonic blending method decreases 4 nm after 60 d storage, resulting in the loss of heat release of thermite reaction by 13%, then stabilizing; the average particle size of active-alumimun of nano-thermites prepared by mechanical ball milling method decreases 3 nm after 7 d storage, and the average particle size slowly decrease to be 57.8 nm after 120d storage, the decrease of active-alumimun makes heat release lost up to 16%; the average particle size of active-alumimun of nano-thermites prepared by sol-gel method decreases 1 nm after 120d storage, obviously slowing down oxidation of nano-alumimun powder, and the loss of heat release is only 6%, this situation maintains stabilization.
nano-thermites;thermite reaction;storage properties
2013-09-02;
2013-10-16。
爆炸科学与技术国家重点实验室基金(YBKT11-01)。
高坤(1987—),男,博士生,研究方向为含能材料和高分子材料。
高运军(1964—),男,教授/博导,研究方向为含能材料和高分子材料。
V512
A
1006-2793(2014)05-0653-05
10.7673/j.issn.1006-2793.2014.05.013

