猪IL-10 SYBR Green I Real-time PCR检测方法的建立
朱希旺,杜以军,李 俊,陈 智,于 江,张玉玉,夏焱春,周明明,王金宝*,吴家强,3*
(1.山东大学 生命科学学院,山东 济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;3.山东省农业科学院 畜牧兽医研究所,山东 济南 250100)
科学研究
猪IL-10 SYBR Green I Real-time PCR检测方法的建立
朱希旺1,2,杜以军2,3,李 俊2,3,陈 智2,3,于 江2,张玉玉2,3,夏焱春1,2,周明明1,2,王金宝1,2*,吴家强1,2,3*
(1.山东大学 生命科学学院,山东 济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;3.山东省农业科学院 畜牧兽医研究所,山东 济南 250100)
白介素-10(IL-10)是一种具有免疫抑制作用的多能细胞因子。能够引发猪免疫抑制效应的多种病毒在感染宿主时均伴随有明显的IL-10上调,其中就包括猪繁殖与呼吸综合征病毒(PRRSV),然而并不是所有的PRRSV毒株都能上调IL-10。为了详细探讨PRRSV免疫抑制与IL-10上调之间的关系以及PRRSV感染上调IL-10的具体分子机制,本研究针对猪IL-10以及看家基因β-actin的基因序列分别设计一对特异性引物,构建了各自含有IL-10、β-actin引物扩增序列的重组质粒为阳性标准品,建立了以2-△△Ct为基础的SYBR GreenⅠreal-time PCR检测方法。该方法线性关系良好;敏感性高,两种基因的检测下限均为1×101copies/μL;特异性强,扩增产物形成单一的特异性熔解峰;重复性良好,批内变异系数小于2%,批间变异系数小于3%;目的基因及内参基因的扩增效率较高,分别为92.7%、97.8%。综上所述,该方法可以用于猪IL-10 mRNA水平的表达分析。
猪;白介素-10;PRRSV;免疫抑制;Real-time PCR
白细胞介素-10(IL-10)是一种具有多种免疫调节作用的细胞因子,其最突出的特点是具有炎症抑制作用[1]。多种细胞都可以产生IL-10,像单核/巨噬细胞、树突状细胞、T/B淋巴细胞、肥大细胞、嗜酸细胞、角质层细胞、自然杀伤细胞等,但以免疫性细胞为主。IL-10最初被称为“细胞因子合成抑制因子”,因为它能够抑制多种炎症因子的合成[2]。IL-10也能够抑制抗原递呈作用以及细胞免疫应答[3]。随着对IL-10研究进展的深入,IL-10与多种炎症性疾病以及免疫性疾病之间的联系正逐渐被建立起来[4]。
许多病毒能够引发猪的持续感染并拥有较高的致病性,主要是因为这些病毒能够对宿主造成严重的免疫抑制以及免疫损伤。有趣的是,这些病毒的感染往往都伴随有高水平的IL-10上调,如口蹄疫病毒(foot-and-mouth disease virus ,FMDV)[5]、猪圆环病毒2型(porcine circovirus type 2,PCV2)[6]、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)[7]等。PRRSV自从20世纪80年代末出现至今已经对世界各地的畜牧业造成了严重的经济损失。目前有关PRRSV感染上调IL-10的机制研究已见报道,但其具体分子机制仍未被完全阐明[8]。然而,并非所有的PRRSV毒株在诱发猪体免疫抑制的同时都能够上调IL-10[9]。因此,为了进一步解析PRRSV感染上调IL-10的具体分子机制,深入探讨PRRSV免疫抑制与IL-10上调之间的关系,需要建立了一种能够准确高效检测猪IL-10 表达变化的方法。
目前,检测细胞因子表达量的方法主要集中在蛋白质水平和mRNA水平。蛋白质水平的检测方法需要依赖特异性的抗体和一定量的目的蛋白,所需时间较长、成本较高;而real-time PCR在mRNA水平检测中凭借其敏感、特异、污染少、可定量、高通量等特点而备受青睐[10-11]。相对定量real-time PCR方法引入了内参基因,能够减少因操作不当等带来的非系统试验误差,从而保证了试验数据的真实性、可靠性。本研究通过反复优化反应体系与反应条件最终建立了以β-actin为内参检测猪IL-10的SYBR GreenⅠreal-time PCR方法,为定量检测IL-10的mRNA表达水平,从分子水平深入研究PRRSV免疫机制提供了有力的技术支撑。
1 材料与方法
1.1 菌种及细胞
大肠杆菌DH5α购自北京全式金生物技术有限公司,猪外周血单核细胞(PBMC)分离自4周龄健康仔猪(PRRSV、PCV2抗原、抗体检测阴性)。
1.2 主要试剂和仪器
TRIzol Reagent购自Invitrogen公司;质粒提取试剂盒购自北京天根生物工程有限公司;TaqDNA聚合酶、dNTP、DNA Marker DL2000、凝胶回收试剂盒、SYBR Premix Ex TaqTM(Tli RNase Plus)试剂盒、PrimeScriptTMRT reagent Kit With gDNA Eraser (Perfect Real Time)试剂盒等购自宝生物工程(大连)有限公司。PTC-2000型PCR仪购自美国MJResearch公司;核酸定量仪购自购自美国Thermo公司;LightCycler®480购自美国罗氏公司;冷冻离心机购自德国Eppendorf公司。
1.3 IL-10及β-actin荧光定量引物的设计与合成
根据Genbank中猪IL-10、β-actin的基因序列,选择保守区使用Premier 5.0软件设计相应引物,经NCBI的BLAST分析证实引物特异性后交由上海生物工程技术服务有限公司合成。荧光定量PCR引物信息见表1。
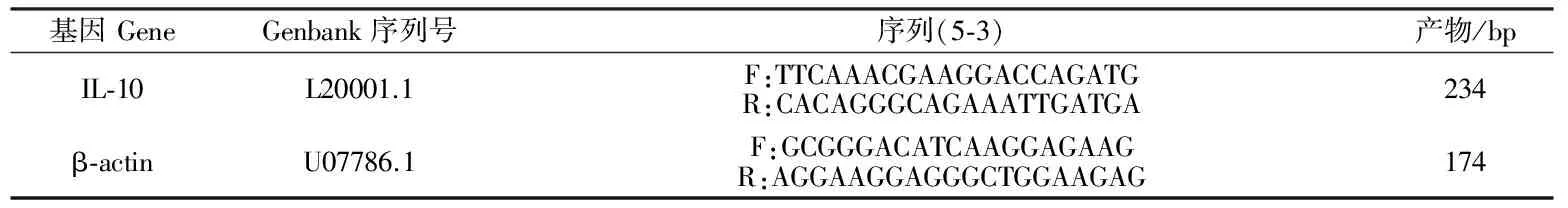
表1 荧光定量PCR引物Table 1 List of primers for real-time PCR
1.4 RNA提取及cDNA的合成
按照TRIzol(Invitrogen)说明书,提取PBMC细胞总RNA,并测定其浓度。根据RNA浓度调整RNA的用量(≤1 μg),利用PrimeScriptTMRT reagent Kit With gDNA Eraser (Perfect Real Time)进行基因组DNA的去除(10 μL体系)并进行反转录(20 μL体系),以Random 6 mers和 Oligo dT Primer 混合的 RT Primer Mix作为反转录引物,37 ℃ 15min反转录,85 ℃ 5 s灭活后置于-20 ℃备用。
1.5 质粒标准品的制备
1.5.1 目的片段的扩增 使用猪IL-10、β-actin的特异性引物,以cDNA为模板进行PCR扩增目的基因片段。选用50 μL反应体系:10×Buffer 5.0 μL,dNTP(2.5 mmol/L) 4.0 μL,上下游引物(10 μmol/ L)各1.0 μL,cDNA模板2 μL,Taq DNA聚合酶(5 u/μL) 1.0 μL,ddH2O 36.0 μL。PCR反应程序:94 ℃ 2 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 5 min。反应结束后,以1.5%琼脂糖凝胶电泳验证扩增产物。
1.5.2 目的片段的克隆与鉴定 用胶回收试剂盒回收目的基因DNA,然后将目的片段与pMD 19-T Vector连接,转化DH5α感受态细胞,涂板后于37 ℃恒温箱中培养,12 h后挑取单菌落进行单克隆培养,提取质粒后进行PCR鉴定,并将PCR阳性质粒送上海生工生物工程技术服务有限公司进行序列测定。
1.5.3 标准品的制备 将测序正确的阳性重组质粒用核酸定量仪测定其浓度(OD260 nm/OD280 nm比值在1.8~2.0之间),并计算标准品的拷贝数。调整拷贝数后进行倍比稀释,分别以1011-100copies/μL的质粒作为标准品,-80 ℃保存备用。
1.6 Real-time PCR反应条件的优化
Real-time PCR反应按照TaKaRa的SYBR Premix Ex TaqTM(Tli RNase Plus)试剂盒进行。通过比较Cp值、荧光强度、熔解曲线以及是否有引物二聚体峰来确定最佳引物浓度、退火温度、模板用量等,以得到最佳的荧光定量PCR反应条件。
1.7 Real-time PCR标准曲线的建立
分别选取5个连续梯度(107~103copies/μL)的标准品用于标准曲线的制作:每个梯度进行三个样品重复,建立20 μL反应体系,根据优化的反应条件经荧光定量PCR仪检测后得出Cp值,并由仪器自动得出标准曲线、斜率以及扩增效率。
1.8 Real-time PCR敏感性试验
以稀释好的1×100-1×107copies/μL的质粒标准品为模板,根据各稀释度Cp值比较得出相应的检测下限。
1.9 Real-time PCR特异性试验
将real-time PCR产物进行熔解曲线以及琼脂糖凝胶电泳分析。
1.10 Real-time PCR重复性试验
每个基因选取107、105、103三个梯度,进行批内重复性试验时,每个稀释度重复10个孔;进行批间重复性试验时,每个梯度重复三批,每批四个重复。将每个梯度的Cp值进行变异系数计算,从而确定该方法的批内与批间重复性。
2 结果与分析
2.1 质粒标准品的制备
以PBMC的cDNA产物为模板,分别以特异性引物PCR扩增猪IL-10、β-actin基因,得到与目的片段大小一致的产物(图1)。产物回收后与pMD 19-T Vector连接,将PCR阳性质粒测序后与标准序列进行一致性比对,结果核苷酸同源性均达到100%。纯化后的阳性质粒OD260 nm/OD280 nm均介于1.8~2.0之间。
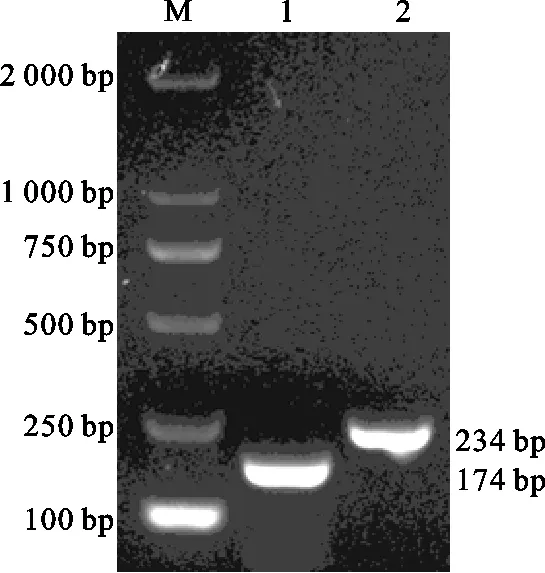
图1 PCR扩增结果Fig.1 PCR products β-actin of and IL-10M.DL 2000 Marker;1.β-actin;2.IL-10
2.2 Real-time PCR反应条件的优化
优化后的IL-10 20 μL反应体系为: 2×SYBR Premix Ex TaqTM(Tli RNase Plus)10 μL、上下游引物(10 μmol/L)各0.4 μL、模板2 μL、RNasefree水7.2 μL。β-actin 20 μL反应体系中上下游引物(10 μmol/L)各0.5 μL,RNasefree水7 μL,其余成分相同。Real-time PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,40个循环。
2.3 Real-time PCR标准曲线的建立
以选取的五个梯度质粒(107~103copies/μL)为模板进行real-time PCR,得到猪IL-10、β-actin的扩增曲线(图2)、标准曲线(图3)以及熔解曲线(图4)。从标准曲线可以看出,标准品起始模板浓度与Cp值呈现良好的线性关系,并且目的基因、内参基因的扩增效率均符合2-△△Ct相对定量方法的基本要求。
2.4 Real-time PCR敏感性试验
试验结果显示,IL-10、β-actin的检出下限均为1×101copies/μL。 这说明该方法具有良好的敏感性,可以用于分析细胞因子的表达差异。

图2 SYBR GreenⅠreal-time PCR扩增曲线 Fig.2 Amplification curves of SYBR Green-Ⅰ real-time PCR

图3 SYBR GreenⅠreal-time PCR标准曲线 Fig.3 Standard curves of SYBR Green-Ⅰ real-time PCR

图4 SYBR GreenⅠreal-time PCR融解曲线 Fig.4 Melting curves of SYBR Green-Ⅰ real-time PCR
2.5 Real-time PCR特异性分析
由图4知,IL-10、β-actin都只有特异性的单峰,并没有杂峰形成。荧光定量PCR产物的琼脂糖凝胶电泳也只有单一的条带(结果未显示)。
2.6 Rea-time PCR重复性试验
结果如表2所示,IL-10与β-actin三个浓度梯度质粒标准品的Cp值批内变异系数及批间变异系数均低于3%,其中IL-10的批内重复性较好。

表2 SYBR GreenⅠreal-time PCR重复性分析Table 2 Repeatability analysis of SYBR green I real-time PCR
3 讨 论
PRRSV至今仍未得到有效的防控,其根本原因在于病毒能够严重干扰宿主的免疫系统,使猪容易发生混合感染和继发感染。病毒感染猪体后使其出现免疫抑制,不仅导致先天免疫应答不足、中和抗体水平应答迟缓,而且能够干扰其它疫苗的免疫效果,造成猪瘟等疫苗免疫失败[12-13]。分析其原因,白介素-10(IL-10)可能在PRRSV的免疫应答的调节中起重要作用。IL-10可以抑制T细胞、NK细胞、B细胞、单核巨噬细胞合成和产生IL-2、IL-6、IFN-γ及TNF-α等细胞因子,因此IL-10被普遍认为是一种免疫抑制因子。当感染了欧洲型或美洲型的PRRSV毒株之后,在感染猪的外周血液单核细胞(PBMCs)中IL-10的mRNA水平会增加,并且在气管肺泡灌洗液(BAL)中的IL-10的浓度也会增加[14]。但也有研究发现,并不是所有的PRRSV毒株都能够上调IL-10。那么,IL-10的免疫抑制作用与PRRSV感染诱导的宿主免疫抑制之间究竟有没有联系?此外,PRRSV感染猪体后经哪些信号通路上调IL-10?IL-10又通过哪些信号通路调节宿主的免疫应答?这些问题都有待于逐步解决。
本试验针对猪IL-10以及看家基因β-actin的基因序列分别设计一对特异性引物,构建了各自含有IL-10、β-actin引物扩增序列的重组质粒为阳性标准品,通过反复优化反应条件与反应体系最终建立了猪IL-10 SYBR GreenⅠreal-time PCR检测方法。该方法线性关系良好,特异性强,敏感性高,重复性好,目的基因与参照基因的扩增效率符合2-△△Ct定量方法的基本要求,可以用于IL-10 在mRNA水平上的表达差异分析,从而为解析PRRSV免疫抑制与IL-10上调之间的关系,阐明病毒上调IL-10的具体分子机制奠定了基础。
[1]Banchereau J,Pascual V,O'Garra A.From IL-2 to IL-37:the expanding spectrum of anti-inflammatory cytokines[J].Nature Immunology,2012,13(10):925-931.
[2]Conti P,Kempuraj D,Kandere K,et al.IL-10,an inflammatory/inhibitory cytokine,but not always [J].Immunology Letters,2003,86:123-129.
[3]Girard-Madoux M J H,Kel J M,Reizis B,et al.IL-10 controls dendritic cell-induced T-cell reactivation in the skin to limit contact hypersensitivity[J].Journal of Allergy and Clinical Immunology,2012,129( 1 ):143-150.
[4]Urbonas V,Eidukaite A,Tamuliene I.Increased interleukin-10 levels correlate with bacteremia and sepsis in febrile neutropenia pediatric oncology patients[J].Cytokine,2012,57( 3):313-315.
[5]Diaz-San Segundo F,Rodriguez-Calvo T,de Avila A,et al,N.Immunosuppression during acute infection with foot-and-mouth disease virus in swine is mediated by IL-10[J].PLoS One,2009,4(5):e5659.
[6]Kekarainen T,Montoya M,Mateu E,et al.Porcine circovirus type 2-induced interleukin-10 modulates recall antigen responses[J].Journal of General Virology,2008,89:760-765.
[7]Suradhat S,Thanawongnuwech R.Upregulation of interleukin-10 gene expression in the leukocytes of pigs infected with porcine reproductive and respiratory syndrome virus[J].Journal of General Virology,2003,84:2 755-2 776.
[8]Shaobo Xiao,Shuang Song,Jing Bi,et al.Porcine reproductive and respiratory syndrome virus infection activates IL-10 production through NF-κB and p38 MAPK pathways in porcine alveolar macrophages[J].Developmental and Comparative Immunology,2013,39:265-272.
[9]Subramaniam S,Sur J H,Kwon B,et al.A virulent strain of porcine reproductive and respiratory syndrome virus does not upregulate interleukin-10 levels in vitro or in vivo[J].Virus Research,2011,155:415-422.
[10]Bustin S,Benes V,Nolan T,et al.Quantitative real-time RT-PCR--a perspective[J].Journal of Molecular Endocrinology,2005,34(3):597-601.
[11]Bustin S.Absolute quantification of mRNA using real-time reverse transcription polymerasechain reaction assay[J].Journal of Molecular Endocrinology,2000,25(2):169-193.
[12]Li H,Yang H.Infection of porcine reproductive and respiratory syndrome virus suppresses the antibody response to classical swine fever virus vaccination[J].Veterinary Microbiology,2003,95(4):295-301.
[13]Suradhat S,Kesdangsakonwut S,Sada W,et al.Negative impact of porcine reproductive and respiratory syndrome virus infection on the efficacy of classical swine fever vaccine[J].Vaccine,2006,24(14):2 634-2 642.
[14]Suradhat S,Thanawongnuwech R,Poovorawan Y.Upregulation of IL-10 gene expression in porcine peripheral blood mononuclear cells by porcine reproductive and respiratory syndrome virus[J].Journal of General Virology,2003,84(2):453-459.
EstablishmentofSYBRGreenI-basedRealativeQuantativeReal-timePCRforPorcineIL-10Detection
ZHU Xi-wang1,2,DU Yi-jun2,3,LI Jun2,3,CHEN Zhi2,3,YU Jiang2,ZHANG Yu-yu2,3XIA Yan-chun1,2,ZHOU Ming-ming1,2,WANG Jin-bao1,2*,WU Jia-qiang1,2,3*
(1.SchoolofLifeSciences,ShandongUniversity,Jinan,Shandong250100,China;2.ShandongKeyLaboratoryofAnimalDiseaseControlandBreeding,Jinan,Shandong250100,China;3.InstituteofAnimalScienceandVeterinaryMedicine,ShandongAcademyofAgriculturalSciences,Jinan,Shandong250100,China)
Interleukin-10(IL-10) is a pluripotential cytokine with immunosuppressive properties.Several virus infections which can cause immunosuppression of swine come along with prominent upregulation of IL-10,among which is the porcine reproductive and respiratory syndrom virus(PRRSV).In spite of this,not all PRRSV strains induce IL-10.In order to figure out the potential molecular mechanism of PRRSV infection on upregulation of IL-10 and the interaction between PRRSV immunosuppression and IL-10-upregulation,two pairs of real-time PCR primers for the amplification of porcine IL-10 and β-actin were designed,standard plasmid recombinants carrying the sequence of these two genes respectively was constructed,and a SYBR GreenI-based 2-△△Ctreal-time PCR detection system was finally established.The results showed that this system displayed good linear relationship,high sensitivity with a detection limit of 1.0×101copies/μL,strong specificity and good repeatability.The real-time PCR products showed single mellting peak,and the coefficient of variation for intra-and inter-assay was less than 3 percent.More important,the PCR efficiencies of IL-10 and β-actin were both close to 100%(92.7%、97.8%respectively).In conclusion,this method can be applied in the mRNA analysis of IL-10 expression.
porcine; IL-10; PRRSV; immunosuppression; real-time PCR
2014-03-12,
2014-04-16
国家自然科学基金(31340047、31370189);山东省现代农业产业技术体系(SDAIT-06-011-07)
朱希旺(1990-),男,山东高唐人,在读硕士,主要从事动物疫病分子免疫学研究。E-mail:zhuxiwang.good@163.com
*[通讯作者]王金宝(1962-),男,山东昌邑人,博士,教授,主要从事动物疫病分子免疫学研究。E-mail:jinbaowang@aliyun.com; 吴家强(1975-),男,山东诸城人,博士,研究员,主要从事动物疫病分子免疫学研究。E-mail:wujiaqiang2000@sina.com
S811.6
A
1005-5228(2014)08-0013-05

