右美托咪定复合腰丛-坐骨神经阻滞对下肢骨折患者血清VEGF的影响
郑海萍 刘世海
右美托咪定复合腰丛-坐骨神经阻滞对下肢骨折患者血清VEGF的影响
郑海萍 刘世海
目的 研究右美托咪定(Dex)复合腰丛-坐骨神经阻滞对下肢骨折内固定手术患者围术期血清血管内皮细胞生长因子(VEGF)水平的影响。方法 选用择期行下肢骨折内固定手术患者50例(ASAⅠ~Ⅱ级), 随机分成A、B两组, 每组25人, A组为腰硬联合麻醉组, B组为右美托咪定复合腰丛-坐骨神经阻滞组。A组患者经L2~L3椎间隙穿刺, 腰麻用药为0.5%布比卡因1.8 ml, 腰麻注药后1.5 h开始经硬膜外管推注0.5%的罗哌卡因液维持麻醉平面及深度, 术中间断静注咪唑安定, 保持患者为睡眠状态。B组患者于神经刺激仪辅助下行腰丛-坐骨神经阻滞, 术中给予右美托咪定镇静, 先1 μg/kg 静脉持续泵注, 10 min后以0.4 μg/(kg·h)速率泵注。分别于T0~T5时点抽血5ml, 测定血清VEGF的浓度。结果 与T0比较, A组T1、T2时点的血压、心率及B组T1、T2、T3时点的 HR均降低(P<0.05);A组及B组T1~T5时点的VEGF浓度均上升(P<0.05)。与A组比较, B组T1、T2时点的血压升高(P<0.05), T1、T2、T3时点的HR下降(P<0.05), B组T1~T5时点的VEGF浓度升高(P<0.05)。结论 Dex复合腰丛-坐骨神经阻滞对患者循环影响较小, 促进VEGF分泌的力度比腰硬联合麻醉更大, 更有利于患者的术后骨折愈合, 是临床值得推荐的方法, 不过对心动过缓的患者要谨慎应用。
右美托咪定;神经阻滞;骨折;血管内皮细胞生长因子下肢骨折患者以往多在椎管内麻醉下完成手术, 但在某些老年人或者存在椎管内麻醉禁忌症的患者, 外周神经阻滞是较好的选择, 其中腰丛-坐骨神经阻滞适合大多数下肢手术, 应用较广。右美托咪定是近年用于镇静的新药, 具有对呼吸影响小的特点, 在临床上应用越来越广, 常作为神经阻滞的辅助用药。有研究显示VEGF与骨折愈合关系密切, 本文旨在研究Dex复合腰丛-坐骨神经阻滞与腰硬联合麻醉比较对下肢骨折患者VEGF分泌的影响。
1 资料与方法
1.1 一般资料 择期行下肢骨折手术患者50例, ASAⅠ级~Ⅱ级, 其中男38例, 女12例, 年龄20~68岁, 体重50~75 kg。排除神经阻滞与椎管内麻醉禁忌患者。随机分为腰硬联合麻醉组(A组) 和腰丛联合骨神经阻滞组(B组), 每组25例。入室后开放静脉通道, 输入羟乙基淀粉注射液500 ml,连续监测BP、ECG、HR、SpO2, 面罩给氧, 常规静脉推注舒芬太尼5~10 μg适当镇痛, 密切观察患者呼吸情况。
1.2 麻醉方法 A组患者行腰硬联合麻醉:患肢在上侧卧位, L3~L4间隙行腰麻穿刺, 成功后予0.5%布比卡因1.8 ml, 麻醉平面上界控制在T10~T12之间。硬膜外腔头向置管3 cm, 腰麻注药后1.5 h开始经硬膜外管推注0.5%的罗哌卡因液3~5 ml以维持麻醉平面及深度, 给予患者咪唑安定1~3 mg, 保持其为睡眠状态。
B组患者行腰丛-坐骨神经阻滞。腰丛神经阻滞:患者取侧卧位。穿刺针是短斜面的22G绝缘针, 长100~150 mm。备局麻药0.4%盐酸罗哌卡因25 ml及1%利多卡因10 ml。预先在L3或L4中线外4~5 cm处确定穿刺点。常规皮肤消毒铺巾后, 使用神经刺激仪来辅助定位, 设定刺激仪初始电流为1 mA, 频率2 Hz, 进针方向稍朝向中线, 当针尖至腰肌间隙接近腰丛时, 可见股四头肌收缩, 减小电流至0.3~0.4 mA后,如仍有股四头肌收缩, 回抽无血注入试验剂量1%利多卡因10 ml, 无不良反应后注入0.4%盐酸罗哌卡因20~25 ml。
坐骨神经阻滞:局麻药0.4%盐酸罗哌卡因25 ml。患者取侧卧位, 手术侧的腿置上, 并且屈髋、屈膝, 辨认出股骨大转子和坐骨结节, 用标记笔在这两者间画一条线, 经此线中点作垂线, 线上约5 cm为进针点。常规皮肤消毒铺巾, 穿刺时使用神经刺激仪来辅助定位, 设定刺激仪初始电流为1 mA, 频率2 Hz, 当穿刺针靠近坐骨神经时, 由弱到强地引起腓肠肌收缩, 伴足跖屈, 减小电流至0.3~0.4 mA后, 如仍有收缩, 回抽无血注入试验剂量1%利多卡因10 ml, 无不良反应后注入0.4%盐酸罗哌卡因20~25 ml。
B组患者术中均给予Dex镇静, 先1 μg/kg 静脉持续泵注, 10 min后以0.4 μg/(kg·h)速率泵注。
1.2 观察指标 两组患者常规监测生命体征, 分别于麻醉前(T0)、切皮后0.5 h(T1)、术毕即刻(T2)、术后6 h(T3)、术后24 h(T4)、术后48 h(T5)肘静脉穿刺抽取外周血5 ml, 用2%EDTA抗凝, 离心分离血清, -20℃保存。采用双抗夹心ELISA法测定血清VEGF的浓度。
1.3 统计学方法 采用SPSS 13.0统计学软件进行分析,计量资料采用均数±标准差表示, 组内比较采用重复测量数据的方差分析, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的性别构成、年龄和体重差别均无统计学意义( P>0.05), 见表1。
表1 两组患者一般资料
表1 两组患者一般资料
分组性别(男/女)年龄(岁)体重(kg) A组18/745±657±7 B组20/544±756±6
2.2 两组患者的各时点血压、心率及SpO2的比较 与T0比较, A组T1、T2时点的血压、心率及B组T1、T2、T3时点的 HR均出现下降(P<0.05);与A组比较, B组T1、T2时点的血压升高(P<0.05), T1、T2、T3时点的HR下降(P<0.05)。两组患者各时点SpO2的比较差异无统计学意义(P>0.05)。
2.3 两组患者围术期血清VEGF浓度的比较 与T0比较, A组及B组T1~T5时点的VEGF浓度均上升(P<0.05);与A组比较, B组T1~T5时点的VEGF浓度升高(P<0.05)。
表2 两组患者各时点血压、心率及SpO2的变化
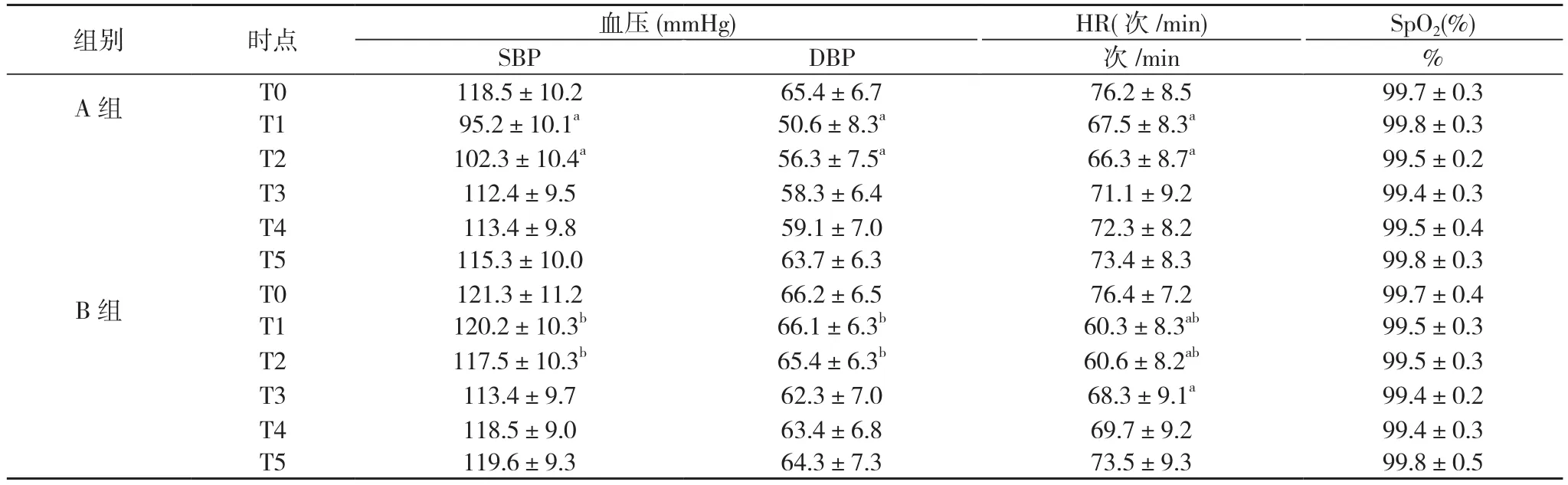
表2 两组患者各时点血压、心率及SpO2的变化
注:与T0比较,aP<0.05;与A组比较,bP<0.05
组别时点血压(mmHg) HR(次/min) SpO2(%) SBPDBP次/min % A组T0 T1 99.5±0.4 99.8±0.3 B组T0 T1 99.7±0.3 99.8±0.3 T2102.3±10.4a56.3±7.5a66.3±8.7a99.5±0.2 T3112.4±9.558.3±6.471.1±9.299.4±0.3 T4 T5 118.5±10.2 95.2±10.1a65.4±6.7 50.6±8.3a76.2±8.5 67.5±8.3a113.4±9.8 115.3±10.0 59.1±7.0 63.7±6.3 72.3±8.2 73.4±8.3 99.4±0.3 99.8±0.5 99.7±0.4 99.5±0.3 T2117.5±10.3b65.4±6.3b60.6±8.2ab99.5±0.3 T3113.4±9.762.3±7.068.3±9.1a99.4±0.2 T4 T5 121.3±11.2 120.2±10.3b66.2±6.5 66.1±6.3b76.4±7.2 60.3±8.3ab118.5±9.0 119.6±9.3 63.4±6.8 64.3±7.3 69.7±9.2 73.5±9.3
表3 两组患者围术期血清VEGF浓度的变化

表3 两组患者围术期血清VEGF浓度的变化
注:与T0比较,aP<0.05;与A组比较,bP<0.05
指标组别T0T1T2T3T4T5 VEGFA160.2±70.9170.9±70.5a190.3±76.6a240.3±81.3a273.6±87.4a380.2±90.1a(pg/ml)B164.7±72.1190.2±78.4ab230.7±80.9ab299.3±80.1ab392.7±91.2ab464.4±92.3ab
3 讨论
目前下肢骨折患者的手术多在椎管内麻醉或外周神经阻滞下完成, 后者在老年及有椎管内麻醉禁忌的患者中优势明显[1], 应用越来越广。Dex可以选择性地与α2、α1肾上腺素能受体结合, 结合的比例为1600:1, 分布半衰期大约为6 min, 消除半衰期大约为2 h。有报道Dex有抗炎作用[2], 能提高脓毒血症大鼠的生存率[3]。而且, Dex可降低围术期患者血糖、血浆皮质醇、肾上腺素、去甲肾上腺素水平, 降低应激反应[4]。有研究认为Dex与外周神经阻滞联合应用是远端骨折患者的较佳麻醉方案[5]。目前有关麻醉方式对骨折愈合影响因素的研究较少。
骨折患者术后的康复与多种因素相关, 包括:(1)全身性因素:营养不良或患有各种代谢障碍性疾病等。(2)局部性因素:①骨折的部位、类型、程度;②治疗或护理;③骨折端的血供或周围软组织损伤程度;④骨折局部感染;⑤金属内固定器材质量等[6,7]。其中局部血液供应是影响骨折愈合的根本因素。
骨折修复是一个极其复杂的过程, 可分为三阶段:血肿机化期、原始骨痂形成期、骨痂改造塑形期。骨折的愈合是骨折断端的修复重建过程, 最终的结果是达到骨的正常结构,并发挥正常的生理功能。血管形成, 恢复骨折端供血是骨折修复的前提。血管生成对骨折段供氧、提供营养物质、运输代谢废物起到举足轻重的作用, 为局部骨再生及代谢提供了有利的微环境。
VEGF是一种特异地作用于血管内皮细胞的生长因子,在人和动物的脑、肾、肝、脾、肺及骨骼等组织内广泛分布。VEGF作为血管生成的最重要因素, 对骨折愈合有促进作用。因此, 选用VEGF指标进行检测, 对于了解右美托咪定复合神经阻滞对骨折愈合过程的影响具有重要意义, 同时比较腰硬联合麻醉, 观察不同麻醉方式对患者生命体征及VEGF浓度的影响。
本研究结果显示, 与腰硬联合麻醉比较, Dex与腰丛-坐骨神经阻滞联合应用对下肢骨折患者的血压影响较小, 患者的循环水平比较稳定。B组患者于切皮前及术毕时的心率比A组患者要低, 说明Dex与腰丛-坐骨神经阻滞联合应用对患者心率有一定影响。有报道Dex可致心动过缓[8], 这些结果提醒对有心动过缓的患者要慎用Dex。
同时VEGF的结果表明, 与术前比较, 两组患者T1-T5时点的VEGF浓度升高。说明两种麻醉方式均可以促进VEGF的分泌。与与腰硬联合麻醉比较, Dex与腰丛-坐骨神经阻滞联合应用T1~T5时点的VEGF浓度升高, 说明后者对患者促进VEGF的分泌的力度更大, 理论上可以加快骨折愈合, 有利于患者的快速康复。VEGF促进骨折加快愈合的主要机制有以下3个方面:①促进新血管生成, 恢复骨折局部血运[9]。②对成骨细胞等的直接作用。研究发现骨折部位的成骨细胞具有VEGF受体的表达, 因此VEGF可以直接作用于成骨细胞[10]。③对其他生长因子的调节作用。VEGF能够促进组织中转化生长因子B的表达[11],以及血小板衍生生长因子, 成纤维细胞生长因子等[12]。
本麻醉方案是适合下肢骨折手术患者的, 能促进VEGF的分泌, 有利于患者的术后骨折愈合, 是临床值得推荐的方法, 不过对心动过缓的患者要谨慎应用。
[1] 方秀春,李艳.PNS 定位腰丛-坐骨神经联合阻滞应用于下肢骨科手术的可行性分析.河北医学,2013,19(4):487-490.
[2] Taniguchit, Kuritaa, Kobayashik, et al.Dose-and time-related effects of dexmedetomidine onmortality and inflammatory responses to endotoxin-induced shock in rats.J Anesth, 2008, 22(3): 221-228.[3] 信玉昌,谢克亮,谢红.右美托嘧啶对脓毒血症大鼠生存率及IL- 6、IL- 10 的影响.临床医学工程, 2012,19(5):710-711.
[4] 孙斌,李南,钱刚,等.右美托咪定对静吸复合麻醉患者围术期应激功能的影响.山西医科大学学报, 2011,42 (10):847-849.[5] 史艳燕,余聪,赵彬飞,等.右美托咪定联合咪达哩仑辅助臂丛神经阻滞镇静效果.武汉大学学报 (医学版 ), 2013,34(1):118-121.
[6] 盛华刚.影响骨折愈合因素的研究进展.北方药学, 2013, 10(3): 53.
[7] 孙贤杰.骨折愈合的影响因素.中国医药指南, 2012,10(17):82-84.
[8] 任燕伶,张卫,李志松,等.不同速率输注右美托咪定对老年白内障手术患者的镇静效应.临床麻醉学杂志, 2012,28(1):31-33.
[9] 杨操,杨述华,杜靖远,等.VEGF基因转染促进股骨头坏死修复.临床骨科杂志, 2004,7(1):90-93.
[10] Petersen W, Pufe T.Expression of VEGFR-1 and VEGFR-2 in degenerative Achilles tendons.J Orthop Res, 2004, 420:286-291.
[11] Zhang F, Liu H, Stile F, et al.Effect of vascular endothelial growth factor on rat Achilles tendon healing.Plast Reconstr Surg, 2003, 112: 1613-1619.
[12] Lubiatowski P, Gurunluoglu R,Skugor B,et al.Gene therapy by adenovirus-mediated vascular endothelial growth factor and angiopoietin-1 promotes perfusion of muscle flapa.Plast Reconstr Surg, 2002,110:149-158.
528315 佛山市顺德区乐从医院麻醉科

