子痫前期患者胎盘组织中TNF-α、Caspase-3表达的研究
王小梅 张维倩 任梅江 郭伟男
子痫前期患者胎盘组织中TNF-α、Caspase-3表达的研究
王小梅 张维倩 任梅江 郭伟男
目的 探讨TNF-α、Caspase-3在子痫前期患者胎盘组织中的表达及意义。方法 子痫前期患者60例(包括子痫前期轻度、子痫前期重度各30例)为实验组, 正常妊娠妇女30例为对照组, 利用免疫组织化学SP法检测两组胎盘组织中TNF-α、Caspase-3的表达。结果 实验组TNF-α的表达均较对照组明显升高(P<0.05), 且随着子痫前期的病情加重, TNF-α的表达逐渐增加。实验组Caspase-3的表达均较对照组明显升高(P<0.05), 且随着子痫前期病情的加重, Caspase-3的表达逐渐增加。结论 TNF-α、Caspase-3在患者胎盘组织中随病情的加重逐渐升高的表达, 有助于预测子痫前期的发生发展。
TNF-α;Caspase-3;子痫前期;胎盘组织
子痫前期是妊娠期特有的疾病, 是妊娠期高血压疾病的一种较严重类型。病变可累及多个器官, 严重影响母婴健康, 为孕产妇和围生儿高发病率及死亡率的主要原因之一。有研究表明, 血管内皮细胞损伤是子痫前期发病及病理变化的重要环节, 而TNF-α对血管内皮有直接的损伤作用[1]。Caspase-3是细胞凋亡中的重要蛋白酶, 已有研究表明, 胎盘合体滋养细胞凋亡和坏死形成的合体滋养细胞微粒增多是子痫前期发生的一个原因[2]。本研究通过测定TNF-α、Caspase-3在患者胎盘组织中的表达, 观察其与子痫前期的相关性。
1 资料与方法
1.1 一般资料 选择于2012年5月~2014年1月在本院产科住院分娩的子痫前期患者60例(包括子痫前期轻度、子痫前期重度各30例)为实验组, 其中子痫前期轻度患者的平均年龄(29.12±4.35)岁, 平均孕周(38.03±1.98)周;子痫前期重度患者平均年龄(29.34±4.03)岁, 平均孕周(37.78±2.17)周。选择同期在本院分娩的正常妊娠妇女30例为对照组,平均年龄(29.23±5.41)岁;平均孕周(38.10±1.89)周(37~42周)。所有研究对象均无多胎妊娠、无反复流产史、未经生殖技术帮助、无慢性高血压、糖尿病、无心血管疾病、慢性肝病肾病病史及免疫系统疾病。两组孕妇一般资料比较差异无统计学意义(P>0.05)。
1.2 诊断标准 子痫前期轻度, 子痫前期重度的诊断标准参照谢幸、苟文丽第8版妇产科学[3]。
1.3 主要试剂 兔抗人TNF-α多克隆抗体购自北京博奥森物技术有限公司。鼠抗人Caspase-3多克隆抗体、SP免疫组化系列工作液试剂盒、DAB显色液均购自北京中衫金桥生物技术有限公司。具体操作参照试剂盒说明书。
1.4 实验方法 三组孕妇均于胎盘娩出后20 min内采集标本,从胎盘母体面中央切取胎盘组织约1.0 cm×1.0 cm×1.0 cm, 注意避开梗死及钙化区。用生理盐水反复冲洗, 用10%中性福尔马林溶液固定24 h以上, 常规制成石蜡组织块。采用免疫组化SP法测定胎盘组织中TNF-α、Caspase-3的表达。试验设PBS代替一抗作为空白对照。
1.5 结果判定 将根据细胞内染色强度和阳性细胞数分级。根据染色强度分级:无染色或染色不清计为0分;淡黄色计为1分;少量深棕色颗粒计为2分;大量深棕色或褐色颗粒计为3分。估算阳性细胞数:无阳性细胞计0分;<25%计1分;25%~50%计2分;>50%计3分。取以上两项积分之和:积分0~1分为(-);2~3分为(+);4~5分为(+);>5分为(+++)。
1.6 统计学方法 所有数据均采用SPSS13.0进行统计学处理, 计量资料采用单因素方差分析;计数资料采用χ2检验和秩和检验;变量间的相关分析采用Spearman等级相关分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 TNF-α、Caspase-3两者在对照组及子痫前期轻度、子痫前期重度中的表达。
2.1.1 TNF-α的表达 胎盘合体滋养细胞内可见TNF-α棕黄色阳性颗粒, 其主要表达于胞浆和胞膜。对照组胎盘组织中未见或仅见少量弱阳性细胞。而子痫前期轻度及重度组中TNF-α的表达量明显增加。TNF-α在对照组的表达阳性率53.34%, 在子痫前期轻度组胎盘中表达的阳性率为83.33%,在子痫前期重度组胎盘中表达的阳性率约为96.67%。TNF-α在对照组、子痫前期轻度组及子痫前期重度组三组间均有不同程度的表达, 差异具有统计学意义(P<0.05), 且随着子痫前期的病情加重, TNF-α的表达逐渐增加。见表1。
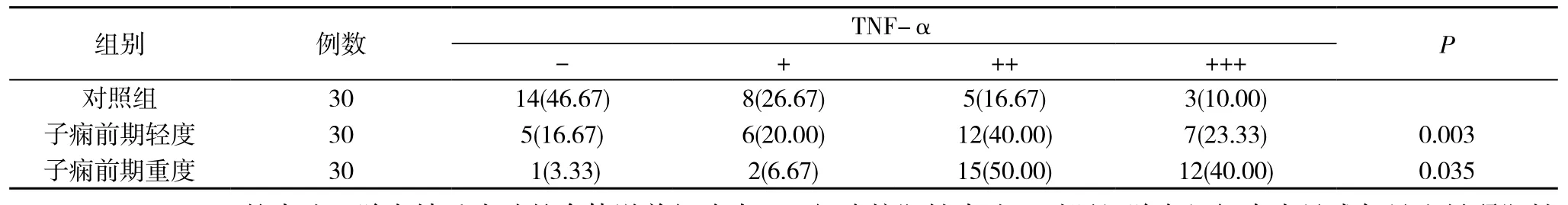
表1 免疫组化中TNF-α在三组的表达[n(%)]
2.1.2 Caspase-3的表达 胎盘绒毛小叶的合体滋养细胞内可见Caspase-3棕黄色阳性颗粒, 主要表达于细胞浆, 部分于细胞核阳性表达。对照组胎盘组织中未见或仅见少量弱阳性细胞, 而子痫前期轻度及重度组中Caspase-3的表达量明显增加。Caspase-3在对照组的中胎盘表达的阳性率为46.66%,在子痫前期轻度组胎盘中表达的阳性率为80.00%, 在子痫前期重度组胎盘中表达的阳性率约为93.33%。Caspase-3在对照组、子痫前期轻度组及子痫前期重度组三组间均有不同程度的表达, 差异具有统计学意义(P<0.05), 且随着子痫前期的病情加重Caspase-3的表达逐渐增加。见表2。

表2 免疫组化中Caspase-3在三组的表达[n(%)]
2.2 Caspase-3和TNF-α的相关性分析 子痫前期组:子痫前期轻度组两者呈正相关, 相关系数r=0.678, P=0.008<0.05;子痫前期重度组两者呈正相关, 相关系数r=0.820, P=0.021<0.05。对照组:两者呈正相关, 相关系数r=0.542, P=0.000<0.05。
3 讨论
子痫前期是妊娠期特有的疾病, 是妊娠期高血压疾病的严重类型, 其发病原因尚未完全阐明[4]。目前研究认为,血管内皮细胞损伤释放血管活性物质, 是导致高血压病的先兆[5], 也是子痫前期病理变化的中心环节[6]。由于终止妊娠后多数患者的病理变化可以逆转, 这说明胎盘在子痫前期的发病中起着重要的作用[7]。
妊娠期母体会出现一系列血管炎性反应的适应性变化,而子痫前期则使这种适应性变化发生紊乱。蜕膜中的细胞数量大大增加, 其激活时释放的有害物质造成内皮损伤。TNF-α、IL-6和IL-8等细胞因子被命名为促炎性细胞因子, 这些细胞因子在细胞信号转导系统中起重要作用, 调解着机体的生理功能, 而这些细胞因子又可以导致血管内皮细胞形态与功能的改变。有研究表明, TNF-α对血管内皮有直接的损伤作用, 并且妊娠高血压病患者血中TNF-α含量的增高与血管内皮细胞损伤呈正相关[8]。而TNF-α在子痫前期的氧化应激中产生了重要作用, 造成产生吞噬脂质的巨噬细胞、血小板减少, 微血管凝血, 毛细血管通透性增加,致使脂质过氧化物产生增多, 从而损伤内皮。本实验利用免疫组化法检测了正常孕妇、子痫前期轻度与重度患者胎盘中TNF-α的表达。结果表明后两者中TNF-α的表达较正常妊娠胎盘明显增高。体外实验证明, TNF-α可使血管内皮出现如下形态学改变:血管内皮细胞明显拉长变形, 成为棱形甚至伸出长长的伪足;细胞表面微绒毛明显缩短甚至脱落,且有的细胞表面绒毛呈泡状结构, 可见细胞膜表面有缺损[9], 胞内质网扩张, 线粒体浓缩、深染;细胞间连接疏松, 红细胞可漏出管腔[10]。TNF-α除对血管内皮细胞造成直接损伤外, 还可能导致内皮细胞的功能紊乱, 如增加血管收缩因子(如内皮素)的生成和释放, 减少血管舒张因子(如一氧化氮)的生成和释放, 使血管调节因子失衡[11]。以上形态改变可致使血管受损、通透性增加和痉挛, 而导致血压升高、蛋白尿和全身水肿。
Caspase-3属于Caspase蛋白家族, 该类蛋白的活性部位为极保守的半胱氨酸残基(以字母C代表), 它能特异性地切割(用aspase代表)天冬氨酸。Caspase-3是细胞凋亡过程中最主要的终末剪切酶, 主要表达于胎盘合体滋养细胞和细胞滋养细胞。研究表明, 胎盘合体滋养细胞凋亡和坏死形成的合体滋养细胞微粒(STBMs)在母体血液循环的增多是子痫前期发生的一个原因。合体滋养细胞微粒可诱导单核细胞产生TNF-α、IL-12、IL-18和INF-γ等炎性细胞因子[12], 而且合体滋养细胞微粒是单核细胞强有力的活化剂, 通过 NF-κB(是将信息从胞浆传至胞核引起相应基因表达的重要转录因子)信号传达通路触发炎症系统[13]。另一方面, 同型半胱氨酸可以促进氧自由基的生成, 进而损伤血管内皮细胞, 致其功能紊乱[14]。而Caspase-3在子痫前期胎盘组织中表达增多, 证明其合体滋养细胞凋亡比正常妊娠组多, 相比于正常妊娠而言, 合体滋养细胞微粒进入母体血液循环增多, 继而导致子痫前期的发生和发展。本实验证实, Caspase-3在各组的胎盘中均呈阳性表达, 主要分布在胎盘的合体滋养细胞细胞浆, 部分分布于细胞核, 并且随着子痫前期病情的加重而表达增加。
因此, 本实验表明TNF-α、Caspase-3在对照组、子痫前期轻度组及子痫前期重度组的表达程度不同, 随子痫前期病情进展, 二者的表达分别逐渐升高, 可能为该病发病的重要原因。病理性妊娠患者的胎盘中大量的TNF-α表达,刺激更多的炎性因子释放, 加重血管内皮损伤, 且TNF-α、Caspase-3成正相关, 紧密联系, 相互影响, 共同参与子痫前期发生及胎盘的病理改变。因此从分子生物学水平上的进一步研究, 有望揭示子痫前期的确切机制, 从而为该病的早期预防、早期治疗提供有力的理论依据。
[1] Fromow itz FB, V iola MV, Chao S, et al.Rat P21 expression in the progression of breast cancer.Hum Pathol, 1987, 18:1268-1275.
[2] Redman CW, Sargent IL.Latest advances in understanding preeclampsia.Science, 2005, 308:1592-1594.
[3] 谢 幸.苟文丽妇产科学.第8版.北京:人民卫生出版社.2013:67-70.
[4] Roberts JM, Lain KY.Recent insights into the pathogenesis of preeclampsia.Placenta, 2002, 23(5):359-372.
[5] Rogersr G, Throp JM.Obstet Gynecol, Surv, 1997, 52(12):723-727.
[6] Roberts GM.Endothelial dysfunction in preeclampsia.Sem in Repord Endurinol, 1998, 16:5215.
[7] Roberts JM, Redman CW.P reeclamp sia:more than pregnancy induced hypertention.Lancet, 1993, 341(8858):1447-1451.
[8] 孙丽霞, 刘香环, 侯丽君, 等.妊高征患者血中肿瘤坏死因子与血管内皮细胞含量的测定及相关性研究.现代妇产科进展, 2001, 10(4):256-257.
[9] 董红梅, 喻伦银, 贾宗智, 等.肿瘤坏死因子-α在妊高征发病中的作用.汕头大学医学院学报, 2002, 15(4):193-202.
[10] 杨菁, 徐望明, 谢青贞, 等.妊娠高血压综合征患者胎盘和脐带血管内皮细胞损伤与肿瘤坏死因子的关系.中华妇产科杂志, 2000, 35(5):279-281.
[11] 沙志一, 金惠铭.肿瘤坏死因子对体外培养的血管内皮细胞的作用.中国病理生理杂志, 1995, 11:455-456.
[12] SJ, Sacks GP, Soorana SR, et al.Systemic inflammatorypriming in normal pregnancy and preeclampsia:the role of circu-lating syncytiotrophoblast microparticles .The Journal of Im-munology, Germain 2007, 178(9):5949-5956.
[13] Messerli M, May K, Hansson SR, et al.Feto-maternal interactionsinpregnancies:placental microparticles activate peripheral bloodmonocytes.Placenta, 2010, 31(2):106-112.
[14] 樊李平, 付芬.妊娠期高血压疾病与亚甲基四氢叶酸还原酶基因的相关性研究进展.江西医药, 2007, 42(2):171-173.
2014-05-05]
050800 正定县妇幼保健院

