南充市污水微生物絮凝剂产生菌的筛选及特性的研究
彭兰慧,何革生,黄盖群;高 辉
1.南充市嘉陵区环境监测站,四川南充,637005;2.南充市嘉陵区环境保护局,四川南充,637005;3.四川省农业科学院蚕业研究所,四川南充,637000;4.西华师范大学生命科学学院,四川南充,637002
南充市污水微生物絮凝剂产生菌的筛选及特性的研究
彭兰慧1,何革生2,黄盖群3;高 辉4
1.南充市嘉陵区环境监测站,四川南充,637005;2.南充市嘉陵区环境保护局,四川南充,637005;3.四川省农业科学院蚕业研究所,四川南充,637000;4.西华师范大学生命科学学院,四川南充,637002
从南充市嘉东污水处理厂活性污泥中分离出一株絮凝活性较高、絮凝剂产量较好的菌株(A3),通过生理生化分析及16S rDNA序列鉴定该菌株为根瘤土壤杆菌(Agrobacteriumsp.)。对A3生长特性进行了研究,结果表明:A3菌株的最佳碳源为蔗糖,最佳氮源为尿素。在室温下,pH值为10.0时,A3菌株絮凝力最高为94.70%;最适的金属离子、发酵液添量、发酵温度分别为Ca2+、2 mL、30℃。
微生物絮凝剂;生长特性;絮凝特性
当前,随着人类社会的发展,水污染越来越严重。为保证水资源的可持续利用,必须解决水污染问题,人类在水处理方面做了大量工作,开发出多种水处理方法,如絮凝沉淀法、生化法、离子交换法、吸附法、化学氧化法、电渗析法和生态处理法等。在絮凝沉淀法中,絮凝剂起着非常重要的作用[1]。絮凝剂可分为有机高分子絮凝剂、无机絮凝剂、微生物絮凝剂。其中,微生物合成的具有絮凝能力的生物大分子,不仅具有传统絮凝剂的优点,更具有传统絮凝剂所没有的优点,因此有关微生物絮凝剂方面的研究越来越受国内外的关注[2]。随着人们对微生物絮凝剂研究的不断深入,微生物絮凝剂在水处理方面的应用范围也越来越广。微生物絮凝剂不仅具有高效、无毒、无污染和使用条件粗放等特点,而且产生菌来源广泛,种类多,是极具有开发价值的水处理剂。本研究从污水活性土壤中分离得到一株絮凝活性较高、絮凝剂产量较好的菌株,并对其絮凝剂的产生条件和絮凝条件以及菌株在不同培养条件和絮凝条件下对高岭土悬浮液的絮凝效果进行研究,为进一步研究微生物絮凝剂的絮凝机理研究提供参考。
1 材料与方法
1.1 实验材料1.1.1 菌种来源
实验菌种来源于南充市嘉东污水处理厂的活性污泥。
1.1.2 培养基
(1)富集及筛选培养基 细菌培养基(LB):蛋白胨10 g,酵母粉5 g,NaCl 10 g,蒸馏水1 000 mL,pH7.0,121℃灭菌20 min。细菌培养基(LA):蛋白胨10 g,酵母粉5 g,NaCl10 g,琼脂粉15 g,蒸馏水1 000 mL,pH7.0,121℃灭菌20min。
(2)发酵用培养基 葡萄糖20 g,KH2PO42 g,K2HPO45 g,NaCl 0.1 g,(NH4)2CO31.5 g,MgSO4·7H2O 0.2 g,蒸馏水1 000 mL,pH 8.0,115℃灭菌30 min。
(3)碳源测试培养基 碳源20.0g/L,K2HPO45.0 g/L,KH2PO42.0g/L,NaCl 0.1 g/L,(NH4)2SO40.2 g/L,脲 0.5 g/L,酵母粉0.5 g/L,MgSO40.2 g/L,pH 8.0,115℃灭菌30 min。
供测试的碳源有葡萄糖、果糖、蔗糖、麦芽糖、乳糖、甘油、乙醇、淀粉。
(4)氮源测试培养基 葡萄糖20.0 g/L,K2HPO45.0 g/L,KH2PO42.0 g/L,NaCl 0.1 g/L,氮源1.5 g/L,MgSO40.2 g/L,pH 8.0,115℃灭菌30 min。
供测试的氮源有蛋白胨、牛肉膏、酵母粉、尿素、谷氨酸、硝酸钾、碳酸铵、硫酸铵、硝酸铵。
1.1.3 主要实验仪器与设备
超净工作台、高压灭菌锅、高速离心机、恒温培养箱、恒温水浴摇床、分光光度计、冰箱、分析天平。
1.2 菌株的筛选与分离鉴定
1.2.1 菌种的富集
取活性污泥约10.0 g,加入无菌水100 mL,摇匀后静置15 min,取上清液1 mL加入到富集培养基,30℃、150 r/min培养48 h后,取1 mL培养液转接到新的富集培养基中,相同条件下培养48 h,再重复一次。
1.2.2 菌种的分离
用无菌吸管吸取富集培养液1 mL,移入盛有9 mL无菌水的试管中,制成10-1稀释液,再用无菌吸管吸取10-1稀释液1 mL,移入另一盛有9 mL无菌水的试管中,制成10-2稀释液,以此类推,分别制成10-3、10-4、10-5、10-6的稀释液。然后,用无菌吸管吸取0.1 mL10-4、10-5、10-6稀释度的菌液,接种到LA分离培养基上,用无菌玻璃涂布棒进行涂布,每个稀释度做5个平行样,最后放到30℃恒温培养箱中培养1~2 d,观察LA培养基上微生物的生长情况。最后,选取生长良好、表面光滑且带粘性的细菌单菌落,转接到LA斜面培养基上于培养箱中30℃培养24 h后,放于4℃冰箱中保存,用于进一步筛选。
1.2.3 初筛
将分离获得的菌株分别接入装有50 mL发酵培养基的250 mL锥形瓶中,置于摇床中于30℃、150r/min培养72 h,分别取相同量发酵液加入高岭土悬浮液,目测各菌株发酵液对高岭土悬液絮凝效果情况,记录下絮凝沉淀颗粒大小和上清液比较清澈的菌株。
1.2.4 复筛
将初筛获得的菌株接种到装有50 mL灭菌发酵培养基的250 mL三角瓶中,在30℃、150r/min条件下培养72 h,将所得发酵液进行絮凝活性测定。
1.2.5 菌株的鉴定
对筛选出絮凝活性最高的菌株,根据菌落特征,进行初步鉴定;然后,再进行分子生物学鉴定,按照传统提取细菌基因组DNA[3]方法,选择16S rDNA基因通用引物序列分别为:(5-AGAGTTTGATCCTGGCTCAG-3) (5′-AAGGAGGTGATCCAGCCGCA-3′)。PCR反应条件为:95℃预变性5 min,95℃变性30 s,52℃退火30 s,72℃延伸1 min,35个循环。将PCR扩增产物用试剂盒纯化,送上海捷瑞生物工程有限公司测序。
1.2.6 絮凝率的测定方法
参照文献[4]的方法进行。
1.3 培养条件的优化
分别改变发酵培养基中碳源、氮源的种类,取48 h发酵液2 mL处理含有0.2 g高岭土100 mL悬浊液,对培养条件进行优化[5]。
1.4 细菌絮凝剂絮凝效果
选择pH值、不同金属离子、发酵液添加量、温度4个主要影响因素,对1.1.3中的高岭土悬浊液进行絮凝处理[6]。
2 结果与分析
2.1 菌种的筛选
经3次连续富集培养,得到了样品的混浊培养液,表明样品中的微生物在富集培养基上可以大量繁殖。利用稀释平板法对富集培养液中的微生物进行分离,结果得到8株优势菌株。根据培养基上生长的菌株的菌落形态、颜色、大小等特征,对它们进行初步分类。将这8株菌作为初步筛选的对象,并分别编号为A1、A2、A3、A4、B1、B2、C1、C2。经初筛,A1、A2、A4、B1、B2、C1、C2产生絮凝块小,速度慢;A3絮凝时絮凝块较大且沉降速度快,絮凝效果比较好。从初筛得到的8株菌株中获得1株絮凝活性较好的絮凝剂产生菌A3,絮凝率是94.70%(表1)。将A3接种到发酵培养基中于30℃、150 r/min培养72 h。A3接种8 h,发酵液开始变浑浊,12 h后浊度明显增加,28 h后发酵液开始有少量气泡,随着培养时间的增加,气泡量也增加。
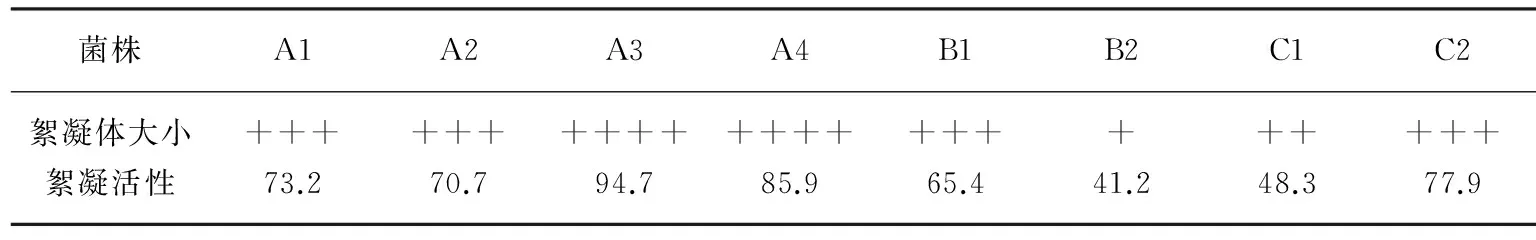
表1 产生絮凝剂菌株的筛选结果
2.2 菌株的观察与鉴定
对筛选出的优势菌株A3进行分离、鉴定,菌株呈杆状,革兰氏阴性菌,有椭圆形芽孢。菌落形态规则,表面湿润、凸起,菌体为乳白色且不透明。获得的菌株A3 16S rDNA扩增片段为1 467 bp,测序结果表明,该序列与根瘤土壤杆菌16S rDNA序列有较高的同源性(99.78%),结合形态学和生理生化特征鉴定其为根瘤土壤杆菌(Agrobacteriumsp.)。
2.3 培养条件的优化
2.3.1 碳源对絮凝活性的影响
选取葡萄糖、果糖、乳糖、麦芽糖、蔗糖、淀粉、乙醇、甘油作为A3菌株的碳源,测定其生长量,结果表明(图1),A3菌株对碳源的利用存在差异,其中以淀粉作为碳源细菌的生长量最高,达0.144 g,但长势不好。以蔗糖、麦芽糖作为碳源,细菌生长量分别为0.135 g、0.118 g,且比较好,说明蔗糖、麦芽糖最适合作为A3菌株的碳源。从图1还可看出,乙醇、甘油作为碳源添加,细菌生长量仅为0.078 g、0.095 g,且细菌长势不好,故不宜作为A3的碳源。
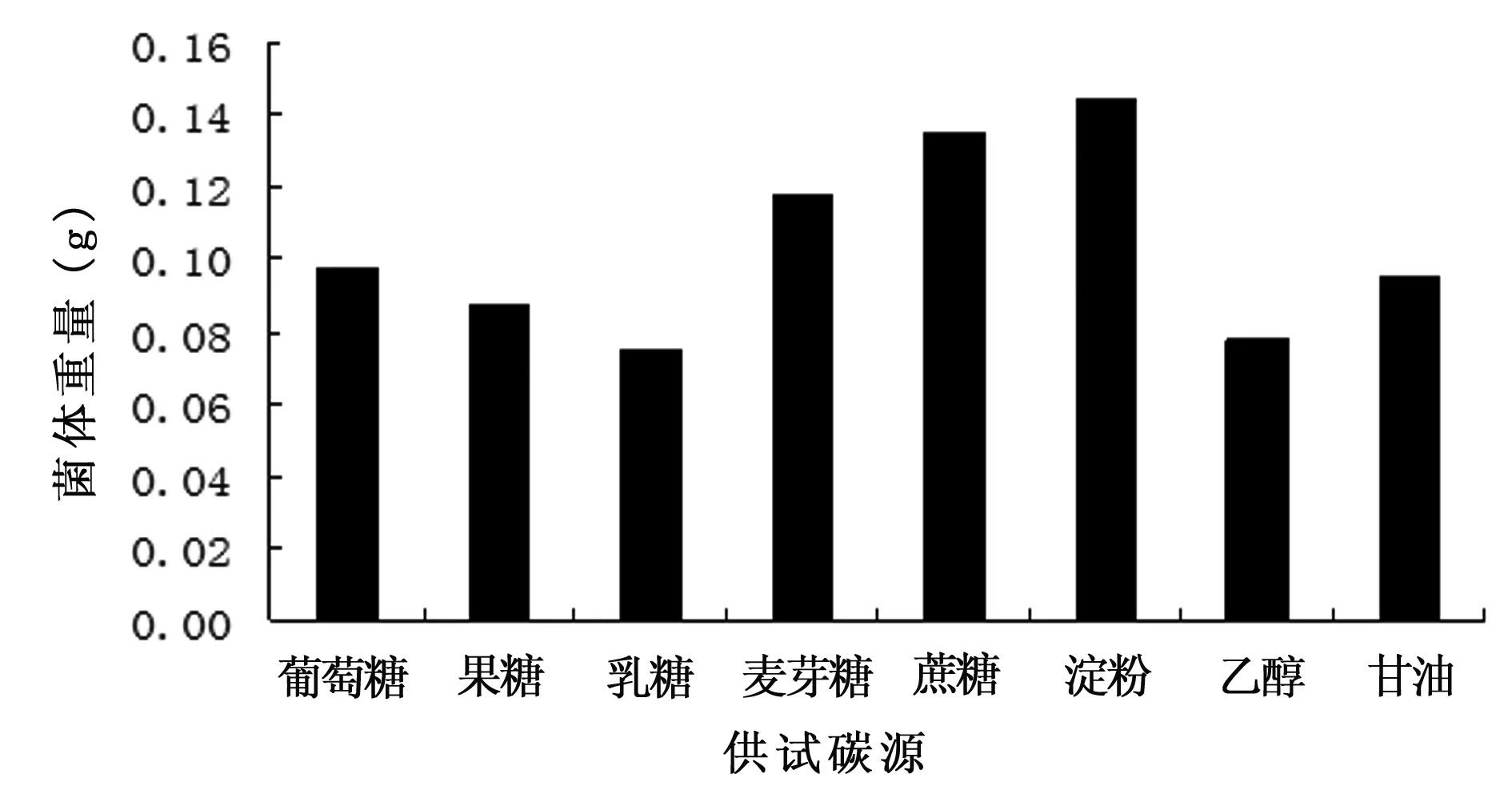
图1 不同碳源对絮凝活性的影响
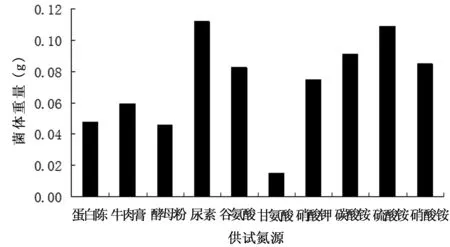
图2 不同碳源对絮凝活性的影响
2.3.2 氮源对絮凝活性的影响
选取蛋白胨、牛肉膏、酵母粉、尿素、谷氨酸、甘氨酸、硝酸钾、碳酸铵、硫酸铵、硝酸铵作为A3菌株的氮源,测定其生长量,结果表明(图2),A3对氮源的利用存在差异,尿素、硫酸铵、碳酸铵作为氮源添加对菌株生长有利,菌体生长量分别为0.112 g、0.109 g、0.091 g,其中对尿素的利用最好,较适宜作为氮源添加。甘氨酸作为氮源添加效果最差,菌体生长重量仅为0.015 g,而且菌株生长情况较差,不适宜作为A3菌株的氮源。
2.4 絮凝条件优化
2.4.1 pH对A3发酵液絮凝率的影响
在其他条件不变的情况下,培养基pH值分别调为6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0,实验结果表明(图3),在pH值为8.0~12.0范围内菌体絮凝率较高,pH值为10.0时絮凝率最高,达到91.42%;pH在10.0以上,随着pH值的升高絮凝率反而下降,表明强碱性抑制微生物絮凝活性物质的分泌;在pH值为10.0时达到最大,表明适当的碱性条件下有利于微生物的生长。由图4可见,在pH值为6.0~7.0的酸性条件下,絮凝作用较弱,而且随着酸性的减弱,尤其当pH值超过7.0时,絮凝活性迅速升高,并基本维持在71%以上。因此,该微生物絮凝剂适宜的pH值范围为8.0~12.0,其中pH值为10.0时最佳。
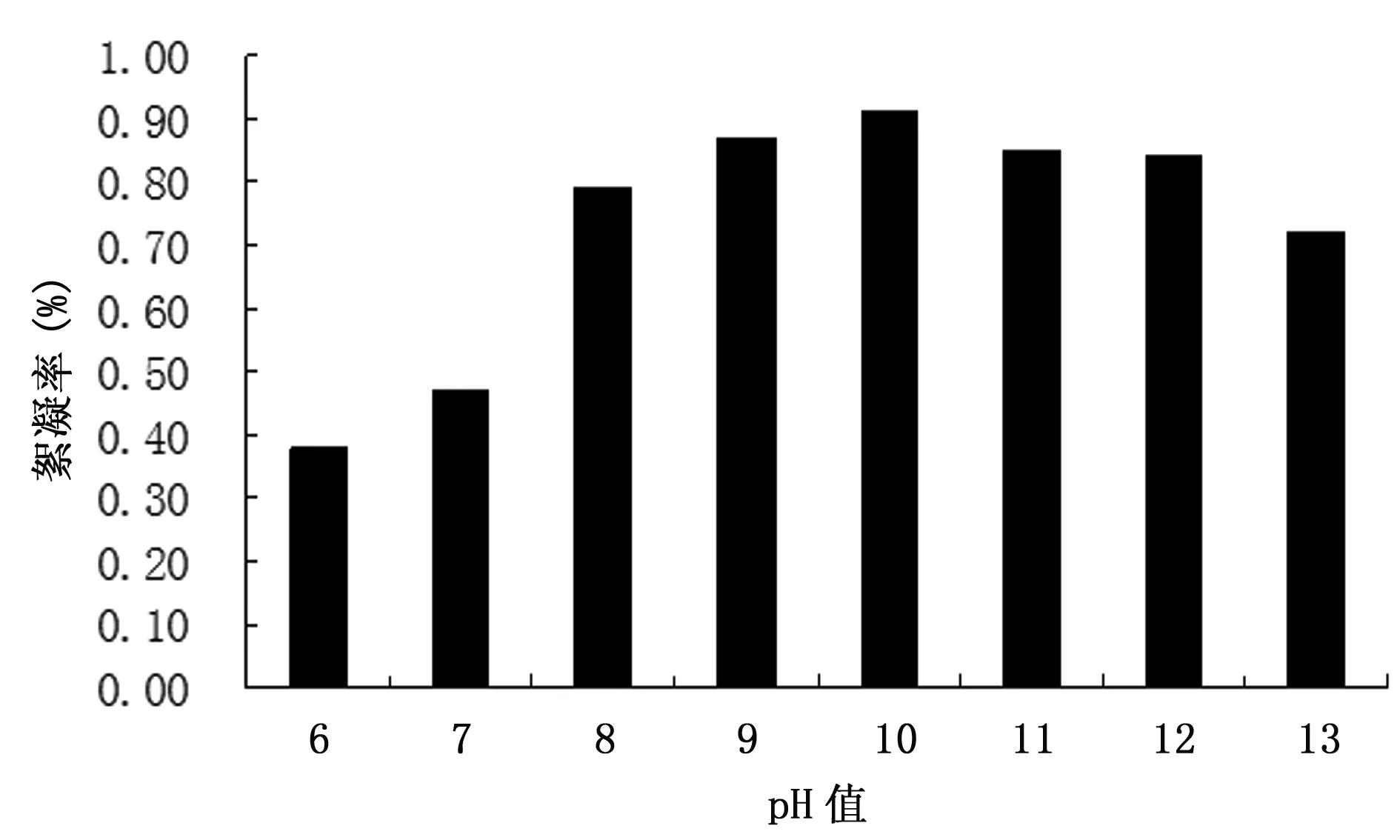
图3 pH值对絮凝活性的影响
2.4.2 金属离子对A3发酵液絮凝率的影响
在培养基中分别加入2mL 0.5g/L的Mg2+、Ca2+、Na2+、Fe2+、K2+、Al3+、Cu2+等不同的金属离子,实验结果显示(图4),未加任何金属离子的空白实验的絮凝效果最差,絮凝率仅为25.30%;但添加不同的金属离子对絮凝活性有不同的作用,其中Al3+、Cu2+对悬浊液的絮凝作用不大,絮凝率仅为43.4%、37.1%;其他的金属离子均有明显的助凝效果,其中以Ca2+的助凝效果最好,絮凝率达93.6%。

图4 不同金属离子对絮凝活性的影响

图5 不同发酵液添加量对絮凝活性的影响
2.4.3 发酵液添加量对A3发酵液絮凝率的影响
设5个发酵液添加量梯度:1 mL、2 mL、3 mL、4 mL、5 mL,实验结果表明(图5),在低浓度范围内,随着发酵液添加量的增加,絮凝率随之提高;在2 mL添加量时,絮凝率达到最高值84.9%;但随着浓度的再增加,所形成的絮凝体会重新变成稳定胶体,絮凝率反而不断下降,因此确定最佳的发酵液添加量为2 mL。
2.4.4 不同温度对A3发酵液絮凝率的影响
实验共设5个温度梯度:20℃、25℃、30℃、35℃、40℃,结果表明(图6),菌株A3在20℃~30℃时,絮凝剂絮凝率随着温度的升高而增加,在30℃时絮凝率达到最大值87.7%;但在30℃~40℃时,絮凝剂絮凝率随着温度的升高而逐渐降低,在40℃时絮凝率降到55.4%。由此得出最佳培养温度为30℃,该温度和细菌的最佳生长温度一致。
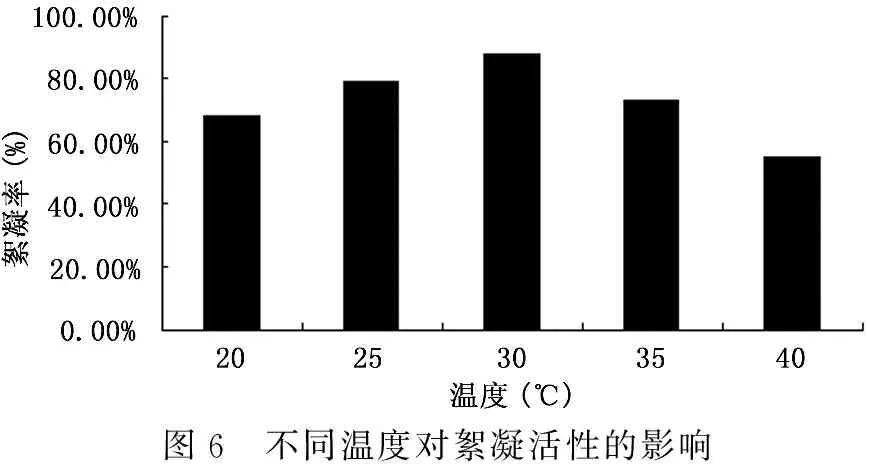
图6 不同温度对絮凝活性的影响
3 结论与讨论
本实验从南充市嘉东污水处理厂的活性污泥中获得了8株具有絮凝效果的菌株,且快速分离了1株产絮凝剂的微生物,菌株标号为A3,絮凝率为94.70%。通过对获得的菌株A3 16S rDNA扩增片段为1 467 bp,测序结果表明该序列与根瘤土壤杆菌16S rDNA序列有较高的同源性,为99.78%,结合生理生化分析及16S rDNA序列鉴定该菌株为根瘤土壤杆菌(Agrobacteriumsp.)。采用单因素法研究培养基中碳源、氮源对其絮凝活性的影响,并对A3菌株进行优化培养。初步确定A3菌株生长的最佳碳源为蔗糖,最佳氮源为尿素;培养基应调成碱性,pH值为10.0时A3菌株絮凝率为94.70%。最终确定pH值最适范围为8.0~12.0,其中pH值为10.0时絮凝效果最佳;培养基添加金属离子均有明显的助凝效果,其中以Ca2+的助凝效果最好,絮凝率可达93.6%;最佳的发酵液添加量为2 mL;最佳培养温度为30℃。本研究获得的高效微生物絮凝剂能否适合其他不同条件的污水环境,还需要作进一步的实验研究。在今后的研究中将对筛选出的优势菌株进行遗传改造,大幅度提高微生物的降解能力,以适应不同的废水处理要求,从而降低污水处理成本,提高处理效率。
[1]徐斌,王竞,周集体.微生物利用废弃物产生絮凝剂的研究与应用[J].工业水处理,2000,20(5):1-3
[2]傅旭庆,汪大,徐新华.微生物絮凝剂及其絮凝机理[J].污染防治技术,1998,11(1):6-9
[3]覃宗华,蔡建平,叶秀华,等.纳豆芽胞杆菌16S rRNA基因的克隆及其系统进化分析[J].中国微生态学杂志,2005(5):324-326
[4]Zhang Z Q.Lin B,Xia S Q,et al.Production and application of a novel bio-flocculant by multiple microorganism consortia using brewery wastewater carbon source[J].Journal of Environmental Sciences,2007,19(6):667-673
[5]尹华,彭辉,贾宗剑,等.微生物絮凝剂产生菌的筛选及其絮凝除浊性能[J].城市环境与城市生态,2000,13(1):8-10
[6]程金平,郑敏,张兰英,等.影响微生物絮凝剂产生的因素研究[J].环境科学技术,2001(30):28-31
(责任编辑:汪材印)
2014-05-12
彭兰慧(1983-),女,四川隆昌人,助理工程师,主要研究方向:环境工程及环境监测。
10.3969/j.issn.1673-2006.2014.09.028
X172
A
1673-2006(2014)09-0090-04

