膀胱尿路上皮细胞癌患者血清CYFRA21-1水平的测定*
孔朝辉,朱晓博,范小玲
河南省人民医院泌尿外科 郑州 450003
膀胱尿路上皮细胞癌患者血清CYFRA21-1水平的测定*
孔朝辉,朱晓博#,范小玲
河南省人民医院泌尿外科 郑州 450003
#通讯作者,男,1983年12月生,硕士,主治医师,研究方向:泌尿系肿瘤及泌尿男科学,E-mail:mohenzhxb@163.com
CYFRA21-1;膀胱尿路上皮细胞癌
目的:检测膀胱尿路上皮细胞癌患者血清中CYFRA21-1水平并探讨其临床意义。方法采用电化学发光免疫分析技术检测57例膀胱尿路上皮细胞癌患者和52例泌尿系统良性疾病患者以及49例健康个体血清CYFRA21-1水平。结果膀胱尿路上皮细胞癌患者血清CYFRA21-1水平和阳性率均高于泌尿系统良性疾病患者与健康人群(F/χ2=28.949、15.221,P均<0.05)。膀胱尿路上皮细胞癌病理分级与血清CYFRA21-1水平及阳性率均无关(P均>0.05)。T3及T3M+期肿瘤较Ta、T1、T2期肿瘤患者血清CYFRA21-1水平及阳性率均升高(F/χ2=2.096、34.232,P均<0.05);与初发肿瘤相比,复发膀胱尿路上皮细胞癌患者血清CYFRA21-1水平及阳性率均升高(t/χ2=3.968、9.541,P均<0.05)。结论血清CYFRA21-1可以作为膀胱尿路上皮细胞癌的一个可靠的肿瘤标志物,特别是在监测膀胱尿路上皮癌转移或复发时更具优势。
膀胱癌是泌尿系统常见的恶性肿瘤之一,在我国泌尿系肿瘤中其发病率和病死率均居首位,其中以膀胱尿路上皮细胞癌最常见,占膀胱癌的90%以上[1]。膀胱癌复发率很高,60%~70%的患者可能复发,11%的复发患者可进展为浸润性肿瘤[2]。目前膀胱癌的诊断和随访主要依靠膀胱镜和细胞学检查,但因其为侵入性检查,使得临床应用受到一定限制。该研究采用电化学发光免疫分析技术对膀胱尿路上皮细胞癌患者血清CYFRA21-1水平进行检测,探讨其水平变化在膀胱癌患者诊治中的临床应用价值。
1 对象与方法
1.1研究对象肿瘤组:收集2010年10月至2012年3月河南省人民医院收治的膀胱尿路上皮细胞癌患者57例,男35例,女22例,年龄38~79岁,中位年龄53岁。初发肿瘤43例,复发肿瘤14例。所有病例均经病理确诊,术后进行病理分级、分期,其中1级(高分化)14例,2级(中分化)19例,3级(低分化)24例;Ta期19例,T1期17例,T2期11例,T3期5例,T3M+期5例。良性病变组:为同期住院的泌尿系统良性疾病患者52例,男33例,女19例,年龄29~78岁,中位年龄46岁。健康对照组:为同期在该医院体检的无感染、内分泌及肝肾等疾病的健康个体49例,男31例,女18例,年龄25~77岁,中位年龄45岁。
1.2血清CYFRA21-1检测方法采集空腹静脉血液2 mL,用质量分数为15% K2-EDTA 20 μL抗凝,置于专用塑料试管中,3 000 r/min离心分离血清,置-20 ℃保存,检测时37 ℃溶解。CYFRA21-1试剂盒购自瑞士罗氏公司,检测仪器为罗氏公司Elecsys2010仪器,所有操作均按说明书进行,采用电化学发光免疫分析技术检测血清CYFRA21-1水平。参照试剂盒说明书,CYFRA21-1参考临界值为3.3 μg/L,>3.3 μg/L为阳性。
1.3统计学处理采用SPSS 13.0进行数据分析。不同组间血清CYFRA21-1水平的比较采用两独立样本的t检验或单因素方差分析和LSD-t检验,CYFRA21-1阳性率的比较采用χ2检验。检验水准α=0.05。
2 结果
2.1肿瘤组、良性病变组及健康对照组血清CYFRA21-1水平和阳性率比较结果见表1。由表1可知,肿瘤组血清CYFRA21-1水平及阳性率均高于良性病变组及健康对照组;良性病变组与健康对照组血清CYFRA21-1水平及阳性率相比,差异均无统计学意义。
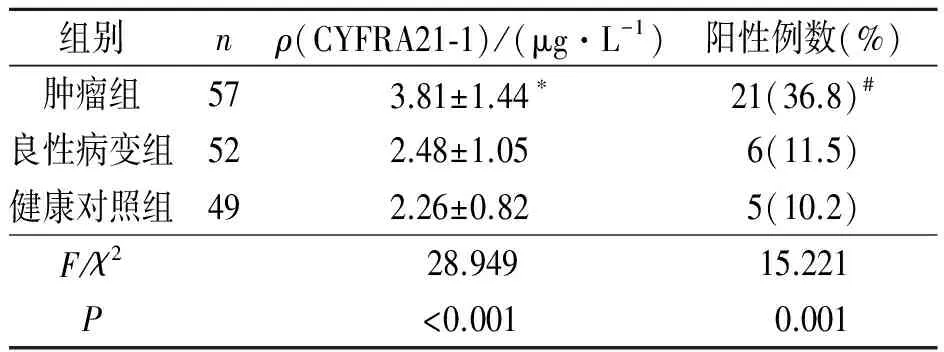
表1 3组血清CYFRA21-1水平和阳性率比较
*:与其他2组比较,P<0.05;#:与其他2组比较,P<0.01。
2.2膀胱尿路上皮细胞癌临床病理特征与血清CYFRA21-1水平和阳性率的关系结果见表2。由表2可知,膀胱尿路上皮细胞癌病理分级与血清CYFRA21-1水平及阳性率均无关。随着病理分期的增加,血清CYFRA21-1水平及阳性率均逐渐升高。与初发肿瘤相比,复发肿瘤患者血清CYFRA21-1水平及阳性率均升高。

表2 膀胱尿路上皮细胞癌临床病理特征与血清CYFRA21-1水平和阳性率的关系
*:与Ta、T1、T2期比较,P<0.05; #:与T3期比较,P<0.05; △:与Ta、T1、T2期比较,P<0.001;▲:与T3期比较,P<0.001。
3 讨论
肿瘤标志物在泌尿生殖肿瘤的诊断、指导治疗、监测复发或转移、判断预后等方面的应用日益广泛。PSA、β-HCG、AFP等已成为前列腺癌和生殖细胞肿瘤诊疗的常规检查,但肿瘤标志物在膀胱尿路上皮细胞癌中的应用仍处在探索阶段[3]。
CYFRA21-1即细胞角蛋白19片段,属于细胞角蛋白家族,是存在于所有上皮细胞中的细胞结构蛋白。细胞角蛋白19为角蛋白的一个亚基,相对分子质量为40 000,其可溶性片段上的2个抗原决定簇可特异性地与2个单克隆抗体BM19-21、KS19-1相结合,称之为CYFRA21-1。正常情况下,CYFRA21-1以寡聚物形式存在,含量极低。当上皮细胞癌变时,被激活的蛋白酶加速了细胞角蛋白的降解,大量CYFRA21-1被释放出来,使其在血液、尿液等体液中的水平上升[4]。Washino等[3]检测85例膀胱尿路上皮细胞癌患者外周血中CEA、CA19-9及CYFRA21-1水平时发现,肿瘤分期和分级越高,血清CYFRA21-1水平越高;而无论肿瘤分级分期高低,血清CEA和CA19-9水平无差异。Andreadis等[5]研究发现CYFRA21-1水平与膀胱肿瘤分化没有相关性,但与膀胱癌的远处转移密切相关,并可用于评估膀胱癌化疗的治疗反应。国内目前仅见尿液中CYFRA21-1水平与膀胱癌关系的报道[6-7],尚无关于膀胱尿路上皮细胞癌患者血中CYFRA21-1水平的研究。
作者研究发现,与正常人群及泌尿系统良性疾病患者相比,膀胱尿路上皮细胞癌患者血清CYFRA21-1水平及阳性率均明显升高,但阳性率仅36.8%,仍然偏低。因而作者认为,CYFRA21-1不适于作为膀胱尿路上皮细胞癌的早期筛查和早期诊断的指标,因为其阳性率较低,而直径5 mm以上的早期膀胱尿路上皮细胞癌已可以通过超声来诊断,与超声相比,CYFRA21-1不具备优势。然而对于复发性膀胱癌及判断膀胱癌有无远处转移方面,CYFRA21-1具有明显的优势。膀胱癌术后随访的目的在于及早发现肿瘤的复发或转移,以便及时治疗。在该研究中,无远处转移时,在Ta~T2期,随着膀胱癌分期增高,CYFRA21-1水平及阳性率虽有升高趋势,但差异无统计学意义;T3期以后CYFRA21-1水平及阳性率均显著升高;有远处转移时CYFRA21-1水平达到(11.27±3.61) μg/L,阳性率达到100.0%,均有显著升高。同初发肿瘤相比,复发肿瘤患者血清CYFRA21-1水平及阳性率均显著升高。因此,CYFRA21-1可作为判断膀胱尿路上皮细胞癌有无复发和转移的参考指标。另外作者还发现,随着膀胱尿路上皮细胞癌病理分级的升高,血清CYFRA21-1水平及阳性率呈逐级升高趋势,但差异无统计学意义。这与Washino等[3]的报道不一致,而与Andreadis等[5]的报道相符,即膀胱癌病理分级与CYFRA21-1水平高低无关,血清CYFRA21-1检测不能用于判断膀胱肿瘤的病理分级。至于CYFRA21-1水平随膀胱尿路上皮细胞癌病理分级升高而有升高趋势,作者分析可能与病理分级越高时其临床分期往往也越高有关。该研究未探讨CYFRA21-1水平与膀胱癌预后的关系,有报道[3]表明,膀胱癌患者治疗前的CYFRA21-1水平越高,其远期生存率越低,预后越差,尚需进一步研究证实。
总之,该研究表明,血清CYFRA21-1可以作为膀胱尿路上皮细胞癌一个可靠的肿瘤标志物,特别是在监测膀胱尿路上皮细胞癌转移或复发时更具优势。
[1]Metts MC,Metts JC,Milito SJ,et al.Bladder cancer:a review of diagnosis and management[J].J Natl Med Assoc,2000,92(6):285
[2]Sylvester RJ,Van Der Meijden AP,Oosterlinck W,et al.Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials[J].Eur Urol,2006,49(3):466
[3]Washino S,Hirai M,Matsuzaki A,et al.Clinical usefulness of CEA, CA19-9, and CYFRA 21-1 as tumor markers for urothelial bladder carcinoma[J].Urol Int,2011,87(4):420
[4]Satyam A,Singh P,Sharma M,et al.CYFRA 21-1: a potential molecular marker for noninvasive differential diagnosis of urothelial carcinoma of bladder[J].Biomarkers,2011,16(5):413
[5]Andreadis C,Touloupidis S,Galaktidou G,et al.Serum CYFRA 21-1 in patients with invasive bladder cancer and its relevance as a tumor marker during chemotherapy[J].J Urol,2005,174(5):1771
[6]李刚,付成.联合检测尿液中CYFRA21-1及端粒酶活性在膀胱癌早期诊断中的意义[J].实用肿瘤学杂志,2008,22(5):417
[7]周莉莉,高云朝.尿细胞角蛋白CYFRA 21-1浓度检测对膀胱移行细胞癌的诊断价值[J].苏州大学学报:医学版,2008,28(4):620
(2014-06-03收稿 责任编辑姜春霞)
Detection of serum CYFRA21-1 in patients with urothelial bladder carcinoma
KONGZhaohui,ZHUXiaobo,FANXiaoling
DepartmentofUrology,HenanProvincialPeople'sHospital,Zhengzhou450003
CYFRA21-1; urothelial bladder carcinoma
Aim: To study value of serum CYFRA21-1 in urothelial bladder carcinoma and its clinical significance. Methods: Electrochemiluminescence method was used to detect serum CYFRA21-1 level of 158 patients, including 57 cases with urothelial bladder carcinoma(group 1), 52 cases with benign diseases of the urinary system(group 2), and 49 healthy individuals(group 3). Results: Compared with group 2 and group 3, serum CYFRA21-1 level and positive rate were significantly higher in group 1 (F/χ2=28.949,15.221,P<0.05). In group 1, serum CYFRA21-1 levels did not differ significantly among each grade (P>0.05). The CYFRA21-1 level and positive rate increased significantly in T3and T3M+ stage compared to Ta, T1and T2stage(F/χ2=2.096,34.232,P<0.05). Compared with primary tumor, serum CYFRA21-1 level and positive rate were significantly increased in recurrent urothelial bladder carcinoma (t/χ2=3.968,9.541,P<0.05). Conclusion: Serum CYFRA21-1 seems to be a marker of urothelial bladder carcinoma. It is useful for monitoring this disease, especially for the metastatic and recurrent tumor.
10.13705/j.issn.1671-6825.2014.06.010
*河南省科技攻关计划项目 112102310232
R737.14

