人脐带沃顿胶干细胞对急性大鼠脊髓损伤的作用及脊髓组织中TNF-α和BDNF表达的影响*
渠瑞娜,马珊珊,田 毅,姚 宁,崔渊博,张文进,韩 康,宋及时,杨 波#,关方霞1,#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院 郑州 450052
人脐带沃顿胶干细胞对急性大鼠脊髓损伤的作用及脊髓组织中TNF-α和BDNF表达的影响*
渠瑞娜1),马珊珊1),田 毅2),姚 宁1),崔渊博1),张文进2),韩 康1),宋及时1),杨 波2)#,关方霞1,2)#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院 郑州 450052
#通讯作者:杨波,男,1963年1月生,硕士,教授,研究方向:中枢神经功能损伤与重建,E-mail:yangbo96@126.com;关方霞,女,1969年2月生,博士,教授,研究方向:干细胞与再生医学,E-mail:guanfangxia@126.com
人脐带沃顿胶干细胞;脊髓损伤;肿瘤坏死因子-α;脑源性神经营养因子;大鼠
目的:探讨人脐带沃顿胶干细胞(WJCs)移植对急性脊髓损伤大鼠的治疗作用及其可能机制。方法81只大鼠分为假手术组、模型组和WJCs移植组,每组27只。每组取6只,采用BBB评分法评估脊髓损伤后1、3、7、14、21和28 d各组大鼠的运动功能,采用透射电镜检测损伤局部超微结构并检测损伤后28 d脑源性神经营养因子(BDNF)的表达,其余大鼠采用实时荧光定量PCR和Western blot检测损伤后0、3、6、12、24、72、168 h损伤脊髓组织中肿瘤坏死因子(TNF-α)的表达。结果脊髓损伤后模型组与WJCs移植组大鼠的运动功能均有不同程度的恢复,其中WJCs移植组较模型组恢复更明显。与模型组相比,WJCs移植组损伤区脊髓组织结构相对完整。模型组和WJCs移植组损伤脊髓组织中TNF-α mRNA和蛋白以及BDNF蛋白的表达较假手术组增加(P<0.05);与模型组相比,WJCs移植组中TNF-α的表达降低,而BDNF的表达增加(P<0.05)。结论WJCs移植可改变脊髓损伤区的微环境,抑制损伤脊髓组织中TNF-α的表达,同时增加BDNF的表达,促进大鼠神经功能恢复,减少脊髓继发性损伤。
脊髓损伤(spinal cord injury,SCI)是一种十分严重的综合性中枢神经系统损伤。一般认为,SCI会引起血脑屏障暂时性破坏,使得中性粒细胞、单核/巨噬细胞进入中枢神经系统,并释放炎症因子,引起局部剧烈的免疫炎症反应,造成继发性SCI[1]。干细胞是一类具有自我更新和多向分化潜能的细胞。近年来,干细胞所具有的独特性质及其在难治性疾病中的治疗效果为SCI的治疗带来了希望。有研究[2]发现,SCI后多种炎症因子的表达呈现增高趋势。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是出现在中枢神经系统损伤早期的细胞因子,可能是众多细胞因子的重要启动因子,可诱导神经毒性分子的释放,损害神经细胞,引起脊髓组织坏死[3-4]。而脑源性神经营养因子(brain derived neurotrophic factor, BDNF)能够阻止损伤引起的神经元退变,重建神经回路[5]。所以在SCI后严格控制损伤局部组织的炎症反应、提高神经营养因子的表达对于损伤恢复起着至关重要的作用。已有动物实验[6]证实间充质干细胞可促进SCI后的功能恢复。作者所在实验室的前期研究[7]表明人脐带沃顿胶干细胞(Wharton′s jelly cells,WJCs) 能够促进SCI大鼠运动功能的恢复。但是,WJCs治疗SCI的分子机制还不清楚。该实验中,作者观察了WJCs移植后SCI大鼠脊髓组织中TNF-α和BDNF表达的变化,揭示WJCs移植治疗SCI与相关炎症因子表达的关系,旨在探讨WJCs移植治疗大鼠SCI的可能机制。
1 材料与方法
1.1材料健康成年雌性SD大鼠81只,体重190~210 g,由河南省实验动物中心提供(动物合格证号:0016386),饲养条件符合清洁级标准。脐带组织由郑州大学第一附属医院产科健康正常剖宫产的产妇志愿者捐赠,检测传染性相关指标均呈阴性。该研究经郑州大学第一附属医院伦理委员会批准。Trizol试剂、逆转录试剂盒、实时荧光定量试剂盒均购自TaKaRa公司;引物由上海生工生物技术服务有限公司合成;Western blot相关试剂购自北京鼎国生物技术有限公司;兔抗鼠TNF-α抗体、兔抗鼠BDNF抗体购自Santa Cruz公司。
1.2WJCs的分离培养与鉴定新鲜脐带用生理盐水冲洗干净后剔除动脉和静脉血管以及脐带表面的薄膜,将沃顿胶组织剪成1.0~1.5 mm3的组织块,转移至75 mL的细胞培养瓶,添加6 mL含体积分数10%胎牛血清和100 U/mL青链霉素双抗的DMEM/F12培养基,置于37 ℃、体积分数5%的CO2恒温孵育箱内培养。3 d后更换培养基,每2~3 d换液1次。待细胞贴壁量达80%~90%时,用胰蛋白酶消化后传代,此后每2~3 d换液1次。取第3代或第4代细胞用流式细胞仪检测其表面抗原。
1.3大鼠SCI模型的制作体积分数10%水合氯醛约4 mL/kg腹腔注射,麻醉显效后,脱毛暴露手术区,将大鼠固定于立体定位仪,常规消毒铺巾。以第1腰椎棘突为中心作背部皮肤正中切口,长约2 cm,钝性分离皮下黏膜,沿中线切断椎旁肌群的肌腱,充分暴露左侧第1腰椎棘突与椎板、椎弓,在显微镜直视下使用眼科小弯钳先咬除第1腰椎椎骨棘突,然后沿棘突断端从尾侧向头侧方向咬除背侧椎板直至椎体的中部,再垂直向左侧椎弓背侧咬除至椎弓根,形成一个L形的骨窗,骨窗的咬痕宽度为1 mm,最后再用眼科手术刀沿暴露腰L3段脊髓的后正中裂行左侧半切横断,明胶海绵止血,显微镜下确认无渗血后逐层缝合肌肉、皮肤。术后20万U青霉素皮下或肌内注射,观察大鼠呼吸变化。
1.4实验动物分组将实验动物分成3组:假手术组(仅在椎板制作L形骨窗后逐层缝合)、模型组(L形骨窗下行脊髓单纯半切损伤)和WJCs移植组(半切损伤后通过股静脉移植1×106个WJCs细胞),术后20万U青霉素皮下注射。
1.5各组大鼠运动功能恢复情况观察各组随机取6只大鼠,分别于术后1、3、7、14、21和28 d据Basso、Beattie、Bresnahan(BBB)评分量表[8],用双盲法评判并记录分值。
1.6各组大鼠脊髓超微结构变化的观察术后28 d,将1.5中的大鼠麻醉处死,取脊髓组织制作脊髓超微切片,其中切片、染色、观察、报告等均由河南省中医学院病理教研室透射电镜室完成。术后28 d所取组织同时用于检测BDNF mRNA和蛋白的表达。
1.7各组大鼠脊髓组织TNF-α和BDNFmRNA表达检测每组剩余大鼠分别于移植术后0、3、6、12、24、72、168 h各取3只,检测TNF-α mRNA的表达。大鼠麻醉后固定于手术台上,无菌操作条件下分离脊髓组织,以损伤处为中心,截取大鼠椎体3 cm,用预冷的生理盐水冲洗后,存放于液氮中备用。用Trizol法抽提总mRNA,逆转录合成cDNA,以GAPDH作为内参,所用相关引物序列、产物大小及退火温度见表1。按照荧光定量PCR试剂盒说明书配制反应体系,利用Fast 7500 Real Time System进行实时荧光定量PCR。反应条件为95 ℃ 30 s,95 ℃ 3 s,60 ℃ 30 s,40个循环。每个样品设3个复孔。反应结束后观察记录扩增曲线和熔解曲线。数据分析采用比较CT法,相对表达量=2-ΔΔCT,取均值。同法检测术后28 d BDNF mRNA的表达。
1.8各组大鼠脊髓组织TNF-α和BDNF蛋白表达的检测用RAPI裂解脊髓组织后12 000 r/min、4 ℃离心10 min,取上清液,于-20 ℃保存,用BCA法测量蛋白浓度,行聚丙烯酰胺凝胶电泳。转膜1.5 h后于50 g/L的脱脂奶粉溶液中室温封闭1 h,加TNF-α一抗(按1:500稀释)、BDNF一抗(按1:1 000稀释)过夜孵育,TBST洗膜3次。用辣根过氧化物酶标记的山羊抗鼠二抗室温孵育2 h,TBST洗膜3次,ECL化学发光显影成像,最后用Image J图像分析软件进行蛋白灰度分析。
1.9统计学处理用SPSS 19.0处理数据。采用重复测量数据的方差分析比较各组大鼠BBB评分,采用单因素方差分析比较3组大鼠术后不同时间TNF-α及BDNF mRNA和蛋白表达的差异,两两比较采用SNK-q检验。检验水准α=0.05。
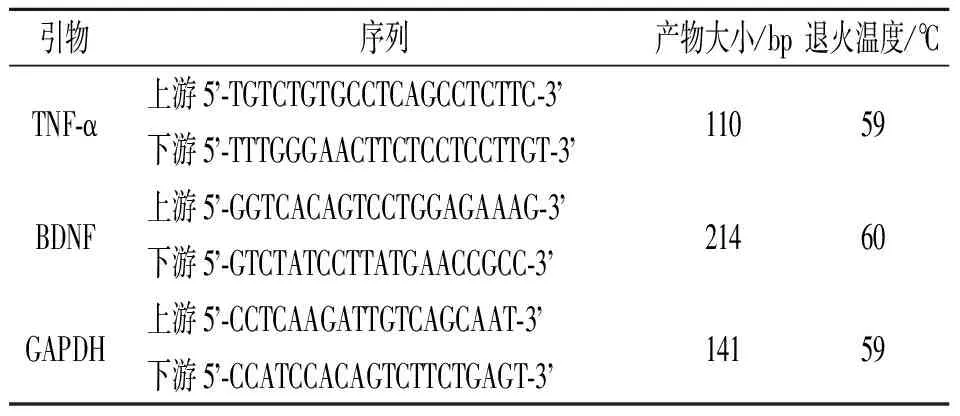
表1 所用引物序列、产物大小及退火温度
2 结果
2.1术后各组大鼠左后肢运动功能恢复情况实验中各组动物均无死亡。假手术组大鼠术后无明显异常,可见轻微反应迟钝表现,麻醉清醒后运动功能即可恢复正常。模型组和WJCs移植组大鼠术中行脊髓半切时可见左后肢突然抽搐,说明造模成功。麻醉清醒后各组大鼠均出现左下肢迟缓性瘫痪。损伤3 d后大鼠进食逐渐增加,精神好转,但左下肢无活动,行动时被拖着移动,损伤处皮肤愈合良好但背部肌张力增高。14 d时能够观察到WJCs移植组大鼠左后肢3个关节屈曲及负重站立,28 d可看到左后肢能够参与行走,但是身体不稳。各组大鼠不同时间点BBB运动功能评分比较见表2。
2.2各组大鼠损伤局部超微结构观察术后28 d,电镜结果显示,假手术组中脊髓结构完整,可见雪旺细胞、少量无髓神经纤维、大量有髓神经纤维以及大量的突触,突触结构清晰(图1A)。模型组中神经纤维散在,结缔组织以及突触形态模糊或结构消失,雪旺细胞胞体固缩、结构消失,突触消失和崩解(图1B)。WJCs移植组损伤周边无类神经元样细胞,损伤中心雪旺细胞刺激性增殖较少,髓鞘增厚,髓鞘板规则、致密,无空泡样变,轴浆内神经微丝、微管大量增生(图1C)。
2.3各组大鼠脊髓组织中TNF-αmRNA及蛋白表达的变化见表3、4和图2。实时荧光定量PCR结果显示,相对于假手术组,模型组和WJCs移植组中TNF-α mRNA的表达在术后3 h开始增加,6 h后达峰值,约于损伤后168 h恢复至正常水平。WJCs移植组中TNF-α mRNA的表达在损伤后6 h开始低于模型组,并以术后6 h和12 h最明显。Western blot结果显示,与假手术组相比,模型组和WJCs移植组中TNF-α蛋白的表达在术后3 h开始增强,在72 h和168 h达到峰值;但是WJCs移植组中TNF-α蛋白的表达均低于同时间点的模型组。
2.4各组大鼠脊髓组织中BDNFmRNA及蛋白的表达变化见图3和表5。

表2 各组大鼠不同时间点BBB运动功能评分比较
F组间=6 668.705,P<0.001;F时间= 576.458,P<0.001;F交互=165.142,P<0.001;*:与假手术组相比,P<0.05;#:与模型组相比,P<0.05。

图1 SCI 28 d假手术组(A)、模型组(B)和WJCs移植组(C)大鼠脊髓组织的超微结构(×50 000)白色箭头表示神经纤维间的连接。

表3 不同时间点各组大鼠脊髓组织中TNF-α mRNA的表达
*:与假手术组相比,P<0.05;#:与模型组相比,P<0.05。

表4 不同时间点各组大鼠脊髓组织中TNF-α 蛋白的表达
*:与假手术组相比,P<0.05;#:与模型组相比,P<0.05。
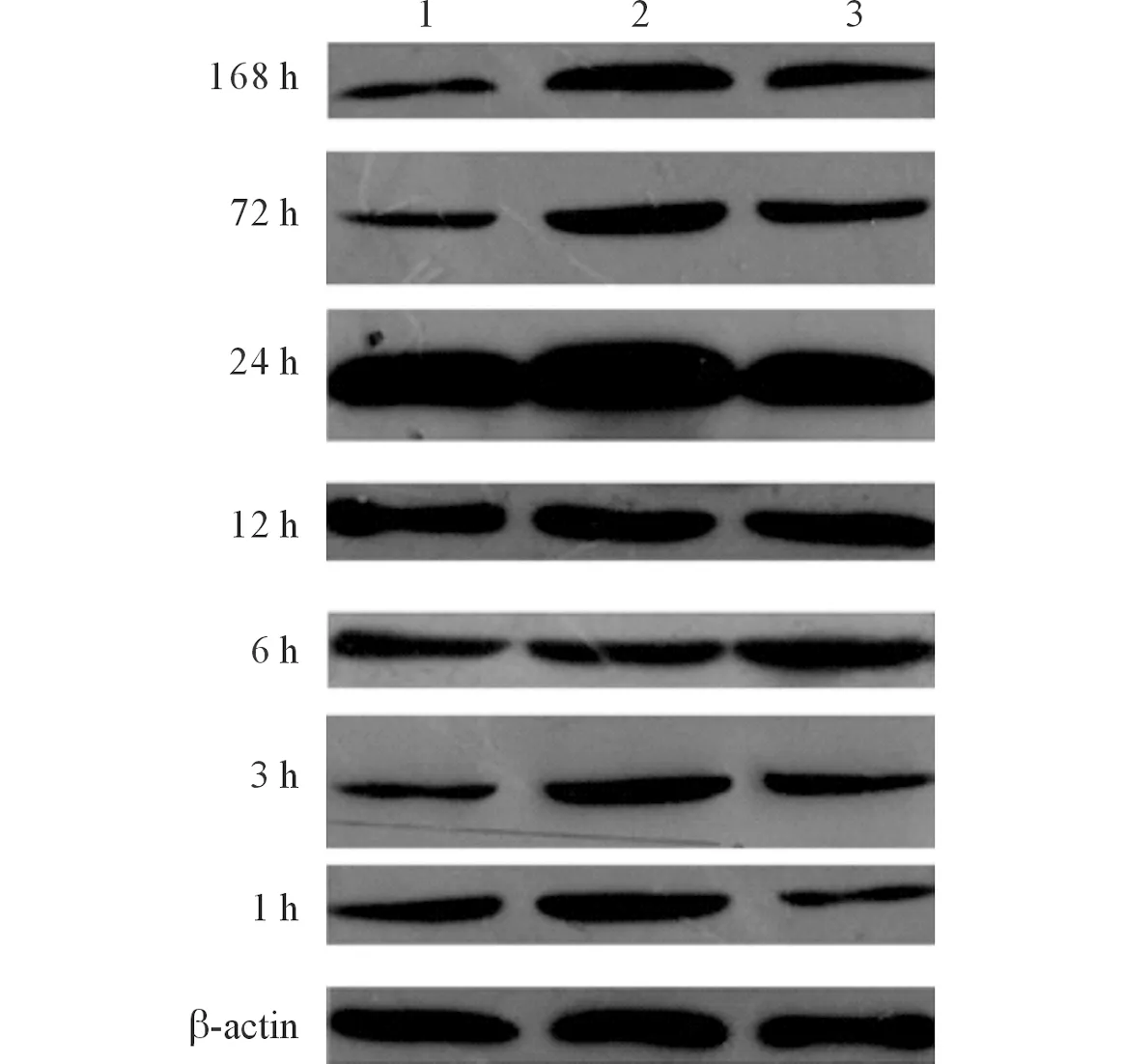
图2 各组大鼠脊髓组织中TNF-α蛋白的表达

图3 SCI后28 d 3组大鼠脊髓组织中BDNF蛋白的表达

表5 SCI后28 d 3组大鼠脊髓组织中BDNF mRNA和蛋白的表达
*:与假手术组相比,P<0.05;#:与模型组相比,P<0.05。
3 讨论
SCI由于其损伤机制的不同分为原发性和继发性损伤两种。原发性损伤是直接损伤,多为不可逆的创伤性损伤;继发性损伤为创伤后的病理生理过程,其损伤机制十分复杂[1,9]。干细胞的自我更新和多向分化潜能为SCI的治疗带来希望并已显示出疗效[10-11]。WJCs可以在宿主体内向损伤区聚集、存活,并能够使SCI大鼠的神经功能有所恢复[11-12],但其作用机制并不完全清楚。WJCs移植治疗SCI的可能机制主要有以下几种:①替代损伤部位坏死的组织细胞和受损伤的神经元[12]。②为损伤局部微环境提供营养支持[13]。③抑制损伤局部的免疫炎症反应[14]。目前认为WJCs的抑炎作用可能是其主要机制。WJCs对炎症因子的作用可能有以下几个方面:打破趋化因子与其受体之间的平衡,从而减轻继发性SCI;在SCI早期调节炎症因子的表达(上调抑炎因子的表达,下调促炎因子的表达)并与相应的效应细胞相互作用,调节炎症级联反应,起到保护神经元的作用。
该实验首先通过BBB评分和透射电镜检测WJCs移植对大鼠运动功能和损伤区域形态结构的影响。结果显示WJCs移植组大鼠运动功能明显恢复;损伤区神经微丝、微管大量增生,部分与脊髓组织相融合。该结果说明WJCs移植可以修复大鼠损伤组织,这与前期的研究[7]结果一致。
TNF-α是具有多种生物学活性的细胞因子,在感染免疫、细胞的增殖分化与细胞凋亡中发挥重要作用。当机体处于炎症状态时,TNF-α的合成与分泌会增加,并通过诱导细胞凋亡在清除受损细胞中起着重要的作用[13]。作者的研究发现,SCI后,WJCs移植组TNF-α mRNA和蛋白的表达高于假手术组,但低于模型组,说明WJCs移植可以降低损伤脊髓中TNF-α的表达,从而减轻炎症反应。
BDNF能够促进神经元的再生,对于损伤后神经元功能的维持,再生修复等发挥着极其重要的作用[14]。SCI的急性期内,神经元和星形胶质细胞共同合成BDNF,其主要功能是神经保护;损伤后期,在单核细胞趋化蛋白-1的趋化作用下巨噬细胞和小胶质细胞在损伤部位聚集、活性增强,同时生成BDNF,其主要作用是神经功能的恢复[13]。该实验结果显示SCI 28 d后,模型组与WJCs移植组中BDNF蛋白的表达均高于假手术组,与模型组相比,WJCs移植组中BDNF的表达升高。该结果说明WJCs移植可促进SCI组织中BDNF的表达,从而有利于减轻脊髓神经元细胞的损伤,促进神经损伤的修复和再生。
综上所述,WJCs静脉移植可改善SCI区的微环境,抑制损伤脊髓组织中炎症因子TNF-α的表达,同时增加BDNF的表达,进而为大鼠神经功能恢复提供营养支持。这可能是WJCs调节免疫炎症反应,减少脊髓继发性损伤,促进损伤大鼠脊髓结构与功能恢复的机制之一。该实验结果为进一步深入探索干细胞移植治疗SCI的作用机制提供了理论依据和研究思路。
[1]朱青,汪晶,刘元渊,等.脊髓损伤的病理机制和细胞移植治疗进展[J].神经损伤与功能重建,2013,8(3):217
[2]Zhang ZJ,Cao DL,Zhang X,et al.Chemokine contribution to neuropathic pain: respective induction of CXCL1 and CXCR2 in spinal cord astrocytes and neurons[J].Pain,2013,154(10):2185
[3]Hermann GE,Rogers RC,Bresnahan JC,et al.Tumor necrosis factor-alpha induces cFOS and strongly potentiates glutamate-mediated cell death in the rat spinal cord[J].Neurobiol Dis,2001,8(4):590
[4]Andrade P,Visser-Vandewalle V,Hoffmann C,et al.Role of TNF-alpha during central sensitization in preclinical studies[J].Neurol Sci,2011,32(5):757
[5]Hiebert GW,Khodarahmi K,Mcgraw J,et al.Brain-derived neurotrophic factor applied to the motor cortex promotes sprouting of corticospinal fibers but not regeneration into a peripheral nerve transplant[J].J Neurosci Res,2002,69(2):160
[6]邓许勇,周荣平,鲁凯伍,等.氯化锂联合脐血干细胞移植修复大鼠脊髓损伤[J].南方医科大学学报,2010,30(11):2436
[7]张文进,黄华,关方霞,等.人脐带间充质干细胞治疗脊髓损伤及其对内源性细胞增殖的影响[J].实用医学杂志,2013,29(6):880
[8]Basso DM,Beattie MD,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1
[9]胡爱民,张治国,侯志贞,等.褪黑素对大鼠实验性脊髓损伤的神经保护作用[J].解放军医学杂志,2011,36(2):164
[10]Wakabayashi K,Nagai A,Sheikh AM,et al.Transplantation of human mesenchymal stem cells promotes functional improvement and increased expression of neurotrophic factors in a rat focal cerebral ischemia model[J].J Neurosci Res,2010,88(5):1017
[11]Li J,Lepski G.Cell transplantation for spinal cord injury: a systematic review[J].Biomed Res Int,2013,2013:786475
[12]Dai G,Liu X,Zhang Z,et al.Transplantation of autologous bone marrow mesenchymal stem cells in the treatment of complete and chronic cervical spinal cord injury[J].Brain Res,2013,1533:73
[13]张群,王竞秋,宋焱峰,等.大鼠急性脊髓损伤后MCP-1及BDNF表达变化的实验研究[J].甘肃医药,2013,32(3):184
[14]徐玉生,张松,金伟林,等.褪黑素对大鼠脊髓损伤后肿瘤坏死因子-α表达的影响[J].郑州大学学报:医学版,2014,49(1):41
(2014-04-22收稿 责任编辑徐春燕)
Effects of Wharton′s jelly cell transplant on acute spinal cord injury in rats and expressions of TNF-α and BDNF in spinal cord tissue
QURuina1),MAShanshan1),TIANYi2),YAONing1),CUIYuanbo1),ZHANGWenjin2),HANKang1),SONGJishi1),YANGBo2),GUANFangxia1,2)
1)SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)TheFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
human Wharton′s jelly cell; spinal cord injury; TNF-α; BDNF;rat
Aim: To explore the effect of Wharton′s jelly cells (WJCs) transplant on the expressions of tumor necrosis factor alpha (TNF-α) and brain-derived neurotrophic factor(BDNF) in rats with acute spinal cord injury(SCI), and to investigate the function of WJCs in the inflammatory response and nerve repair after acute SCI. Methods: A total of 81 rats were allocated into sham operation group, model group and WJCs group(27 rats in each group).In the WJCs group, 200 μL WJCs cell suspension (about 1×106cells) was injected by femoral vein at 10 min after the injury. Neurologic function was accessed by BBB score at 1 d, 3 d, 7 d, 14 d, 21 d and 28 d respectively after transplantation; the ultrastructures of injured spinal cord were detected by transmission electron microscopy; the mRNA and protein expressions of BDNF in the spinal cord tissue were detected by real-time quantitative PCR and Western blot, respectively at 28 d, and those of TNF-α level were detected at 0 h, 3 h, 6 h, 12 h, 24 h, 72 h, 168 h after transplantation. Results: Neural function was recovered to some extent both in WJCs group and model group, and the former was much better. Compared with model group, the structure of SCI area of WJCs group was relatively intact. Compared with the sham operation group, the expressions of BDNF protein and TNF-α mRNA and protein were increased significantly both in model group and WJCs group(P<0.05); compared with model group, the expressions of TNF-α mRNA and protein decreased(P<0.05), while that of BDNF increased in the WJCs group(P<0.05) .Conclusion: WJCs transplantation can change the microenvironment of the injured spinal cord by inhibiting the expression of TNF-α while promoting the expression of BDNF in the lesion, therefore reducing secondary spinal cord injury, which may be a potential mechanism underlying the recovery of motor function of injured rats.
10.13705/j.issn.1671-6825.2014.06.001
*国家自然科学基金资助项目 81071008,U1404313;河南省杰出青年基金 114100510005;河南省科技攻关项目 122102310203;人事部留学回国人员择优资助项目
R681.5+4

